结肠息肉内镜下切除后再发危险因素分析
赵佳琳 董卫国
结肠息肉是从结肠黏膜表面突出到肠腔的隆起型病变,发生率为1%~43%[1]。作为常见恶性肿瘤——结肠癌的癌前病变,其恶变途径主要包括腺瘤途径和最新发现的锯齿状息肉途径,炎性息肉和增生性息肉则很少发生癌变[2]。随着肠镜检查的普及和内镜下息肉治疗手段的发展,结肠息肉的早期检出率和切除率明显提升,这有助于减少结肠癌的患病及死亡风险[3]。尽管如此,结肠息肉经肠镜下治愈后仍然有较高的再发率。研究表明,其术后5年复发率高达60%[4]。当前国内外对诱导结肠息肉再发因素的研究多集中于常规腺瘤的病理学和生物学特征,或是某两种内镜下治疗手段的疗效对比,且结论不一,尚未达成共识[5,6]。而本研究还将锯齿状息肉纳入分析对象,并着眼于常见慢性病、消化系统伴随疾病、生活方式、机体代谢指标以及几种临床最多使用的肠镜下息肉切除方式,旨在研究影响结肠息肉再发的多方面相关因素,为临床上筛选出有高复发倾向的人群提供数据资料,为息肉切除后肠镜随访计划的制定及结直肠癌的防治提供依据。
资料与方法
1.一般资料:回顾性纳入2019年12月~2021年12月于武汉大学人民医院消化内科住院行肠镜下结肠息肉治疗,并且有术后首次肠镜复查记录的患者共244例,其中男性157例,女性87例;患者年龄为33~84岁,平均年龄为58.97±10.84岁。纳入标准:①由经验丰富的三甲医院医师进行到达回盲部的完整肠镜检查并诊断为结肠息肉;②检查过程中发现的所有息肉均行肠镜下完整切除且送至病理科进行活检;③术后首次肠镜复查在武汉大学人民医院进行;④复查间隔时间至少为6个月以排除术中漏诊;⑤年龄≥18岁;⑥临床资料完整。排除标准:①家族性息肉病、Peutz-Jeghers综合征、炎症性肠病;②结肠癌病史;③结肠外科术史;④合并血液系统疾病、恶性肿瘤、肝硬化等严重的基础疾病。本研究获得武汉大学人民医院医学伦理学委员会批准(伦理学审批号:WDRY2022-K260)。
2.肠镜检查及结肠息肉手术方法:由武汉大学人民医院经验丰富的临床医师为患者行达到回盲部的结肠镜检查,根据具体情况选择不同术式完整切除肠镜下所见全部息肉,包括钳除术、高频电凝电切、氩离子凝固术(argon plasma coagulation,APC)、内镜下黏膜切除术(endoscopic mucosal resection,EMR)、内镜下黏膜剥离术(endoscopic submucosal dissection,ESD),息肉标本送武汉大学人民医院病理科进行病检。
3.研究方法:将再发定义为结肠息肉切除后至少6个月复查肠镜时发现息肉,无论息肉的位置与上次是否相同[7]。244例患者分为再发组(n=168)和未再发组(n=76),比较两组的性别、年龄、体重指数(body mass index,BMI)、饮食、运动、合并慢性疾病、生化指标、息肉特征、手术方式等临床资料;当息肉多发时,息肉直径以最大息肉的直径为主,病理诊断以癌变概率最高的为主;根据所切息肉的病理类型分为癌前息肉(腺瘤、锯齿状息肉)和非癌前息肉(炎性息肉、增生性息肉);左半结肠包括降结肠和乙状结肠,右半结肠包括升结肠和横结肠,全结肠包括上述所有部位。
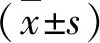
结 果
1.两组基本资料比较:再发组年龄大于未再发组(P<0.05),年龄>58岁及男性比例高于未再发组(P<0.05),超重、饮食、运动、高血压、冠心病、糖尿病、脂肪肝、胃息肉、结肠黑变、胆囊切除比例与未再发组比较,差异均无统计学意义(P>0.05),详见表1。
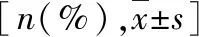
表1 两组基本资料比较
2.两组生化指标比较:再发组HDL水平低于未再发组(P<0.05),丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)、尿酸、空腹血糖、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、超敏C反应蛋白(hypersensitivity C-reactive protein hsCRP)水平与未再发组比较,差异均无统计学意义(P>0.05),详见表2。
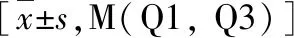
表2 两组生化指标比较
3.两组息肉特征和手术方式比较:再发组息肉数目大于未再发组(P<0.05),息肉数目≥3个、息肉分布于全结肠、多部位息肉、癌前息肉比例高于未再发组(P<0.05),息肉分布于右半结肠比例低于未再发组(P<0.05),息肉直径、手术方式与未再发组比较,差异均无统计学意义(P>0.05),详见表3。
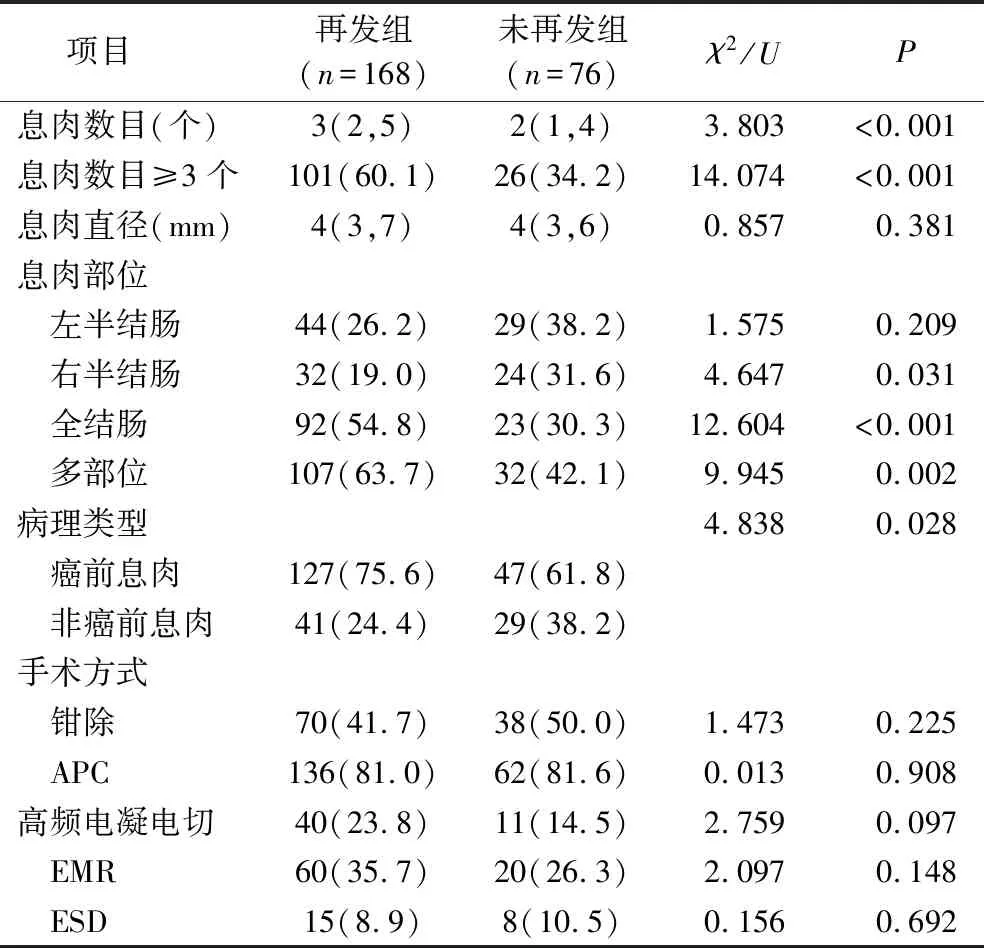
表3 两组息肉特征和手术方式比较[n(%),M(Q1,Q3)]
4.结肠息肉切除后再发危险因素的多因素Logistic回归分析:以结肠切除术后患者是否再发为因变量(再发为“1”,未再发为“0”),性别(男性为“1”,女性为“0”)、息肉分布于全结肠(是为“1”,否为“0”)、病理分型(癌前息肉为“1”,非癌前息肉为“0”)及年龄、HDL水平、息肉数目、息肉直径(均为连续变量)为自变量,纳入模型进行多因素Logistic回归分析,结果显示,男性、年龄、息肉分布于全结肠是结肠息肉切除后再发的危险因素,详见表4。
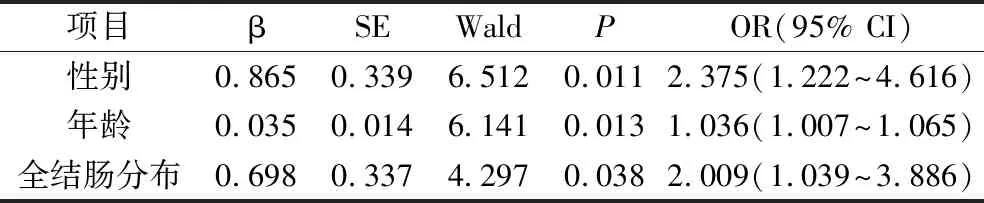
表4 结肠息肉切除术后再发危险因素的多因素Logistic回归分析
讨 论
结直肠癌是世界范围内常见的恶性肿瘤之一,并已成为癌症死亡的第四大原因,且发病年龄逐渐趋于年轻化[8]。常见的预防手段之一是切除癌前病灶。国外的研究数据表明,内镜下切除癌前病变可以预防76%~90%的癌症相关并发症,并将病死率降低53%[9]。腺瘤和锯齿状息肉较炎性息肉和增生性息肉相比发展为癌症的可能性更大这一观点已成为共识,且患者即使接受过息肉或肿瘤切除仍有原发病灶癌变或病变再发的可能[10]。因此,结直肠癌及癌前息肉的预防仍是重要的公共卫生目标之一,为患者提供结肠息肉切除后的肠镜监测有利于远期预后。对于临床医师来说,识别息肉切除后再发的危险因素并为有复发风险的人群选择合适的随访时间有助于结直肠癌的防治工作。
多个国家的结直肠癌筛查结果表明,女性的癌症与腺瘤发生率较男性低,约占总发生率的1/3,病死率也不如男性高[11]。本研究结果表示,结肠息肉再发组男性的比例高于未再发组,且性别是再发的独立危险因素。这种性别差异的原因尚不明确,可能与雌激素有关,雌激素替代疗法的证据足够表明循环雌激素在抑制结直肠癌发展方面发挥了作用[12]。一方面,雌激素受体-β已被确定为肿瘤抑制因子;另一发面,KCNQ1/KCNE3钾通道受到雌激素调节,而KCNQ1正是结直肠癌中的肿瘤抑制因子,其持续表达可抑制Wnt/β-连环蛋白信号通路,此通路是众所周知的促肿瘤生长通路[13]。
高龄被认为是与结肠息肉再发关系密切的因素之一,并且随着年龄的增长,腺瘤性息肉占比显著上升,尤其是在年龄>60岁的患者群体中,这或许是因为老年人机体免疫力下降、结肠功能障碍导致肠道慢性炎症以及肿瘤相关基因的不稳定性[14,15]。在本研究中,再发组年龄高于未再发组,多因素Logistic回归分析结果表明,年龄每增加1岁,再发风险增加 0.2~3.6倍。对年龄进行分层发现,再发组>58岁的患者比例更高,提示年龄>58岁的结肠息肉患者在行肠镜下治疗后需警惕再发的风险。值得注意的是,早发性结直肠癌(即在50岁以下患者中诊断出的结直肠癌)的发生率和病死率一直在稳步上升,而年轻患者的早癌患病与再发风险因素尚不明确,仍需开展更多的实验予以证实[16]。
近年来,代谢因素逐渐成为结直肠癌发病风险因子中不容忽视的因素之一,高血压、糖尿病、非酒精性脂肪性肝病等常见的代谢性疾病被发现参与了结直肠癌的发生与发展进程[17]。脂质谱与结肠息肉间的关系已被广泛研究,一些实验证明,血清甘油三酯和胆固醇水平升高会促进息肉的形成,这种脂质异常可能导致高胰岛素血症和胰岛素抵抗,后者与胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)受体的相互作用能抑制细胞凋亡,促进结肠细胞增殖并诱导癌变[18]。本研究发现,息肉再发组HDL的水平低于未再发组,导致这种现象的具体机制尚不明确。相关研究表明,其潜在途径与炎性细胞因子紧密相关。炎症级联反应会导致血清HDL水平下降,进而影响胆固醇的运输,而高脂血症则会刺激结直肠黏膜细胞增生或异常增殖[19]。
息肉的自身特征是影响再发的关键因素,主要包括息肉的数量、大小、位置、组织学。多个国家的共识指南用息肉的数目、直径、病理分型来决定术后肠镜监测的间隔时间[20]。目前,患3个以上结肠息肉更易复发的观点已被广泛接受。国内有研究表明,肠息肉数≥3个是再发的独立危险因素[21]。尽管欧洲胃肠内镜学会(European Society of Gastrointestinal Endoscopy,ESGE)建议完全切除至少1个≥10mm的腺瘤需要在3年后进行肠镜检查,但息肉大小的测量无论是肠镜还是病理均存在较大的偏差,无法作为高质量证据推荐肠镜监测间隔时间[22]。
除了腺瘤与异型增生,锯齿状息肉也已经被公认为是重要的癌前病变,其癌变通路通常由BRAF或KRAS基因的突变启动,随后通过肿瘤抑制基因的甲基化进展[23]。因此,英国胃肠病学会/大不列颠及爱尔兰结肠直肠协会/英国公共卫生指南使用术语“癌前息肉”,包括锯齿状息肉和腺瘤性息肉[10]。息肉的生长部位与再发也息息相关,有数据表明,左半结肠的息肉发生率高于右半结肠,可能原因是近端结肠上皮胚胎的起源和相关遗传与远端结肠比较存在差异,对于影响息肉发生的因素具有更高的敏感度[24]。息肉多部位分布或全结肠散在分布的患者也有较高的复发风险[25,26]。本研究结果表明,再发组息肉数目大于未再发组,息肉数≥3个、多部位息肉、有恶变风险息肉比例高于未再发组,而右半结肠息肉比例低于未再发组,且息肉分布于全结肠是再发的独立危险因素,因此,患有≥3个息肉、息肉全结肠或多部位分布、息肉病理类型为癌前息肉的患者再发风险较大,行息肉切除后需定期进行肠镜监测。
综上所述,性别、年龄、血清HDL水平、结肠息肉的数量、位置与病理均会影响息肉术后的再发情况,其中男性、老年、癌前息肉是再发的独立风险因素,但本研究受到样本量小、单中心回顾性研究的限制,尚未发现高血压、糖尿病、脂肪肝等基础疾病,BMI、饮食、运动、血糖、尿酸、TG、TC、LDL等代谢指标以及肠镜下手术方式对息肉再发的影响,且获得的结论仍需开展多中心、大样本量研究予以进一步证实。
利益冲突声明:所有作者均声明不存在利益冲突。

