儿童肺炎支原体感染的临床特征及混合感染相关因素研究
李子鑫 武文祺 杨 玲 刘 芳
特应性是指个体对环境中常见过敏原产生免疫球蛋白E(immunoglobulin E,IgE)型免疫应答的一种具有遗传倾向的特质,特应性体质个体合并其他疾病时会表现出其独特的临床特征[1]。研究表明,特应性体质与肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)的病情相关,并致使重症肺炎支原体肺炎(severe mycoplasma pneumoniae pneumonia, SMPP)和MPP相关肺外并发症发生风险增加[2]。近年来,世界范围内特应性疾病发生率逐年上升[3]。特应性体质个体不胜少数,医疗策略应充分考虑到该患者群体的特殊性进行调整和严格验证。但目前关于特应性体质MPP患儿群体的临床研究较少,临床医生对其疾病特点认知有限。因此,本研究分析特应性体质MPP患儿的临床特征,探讨其发生SMPP的临床预测指标,旨在为该部分患儿的诊治提供新思路,以供临床参考。
资料与方法
1.临床资料:连续纳入2019年9月~2022年9月在上海交通大学医学院附属新华医院儿呼吸内科确诊为肺炎支原体肺炎的年龄≤14岁的住院患儿共250例,根据是否为特应性体质分为特应性组(n=149)和非特应性组(n=101)。本研究经上海交通大学医学院附属新华医院医学伦理学委员会批准(伦理学审批号:XHEC-D-2023-012),所有患者均签署知情同意书。
2.诊断、纳入与排除标准:(1)诊断标准:①MPP的诊断标准:符合儿童社区获得性肺炎诊断标准,参考《儿童社区获得性肺炎诊疗规范(2019年版)》[4]。同时符合肺炎支原体(mycoplasma pneumoniae,MP)感染诊断标准:血清MP-IgM抗体效价≥1∶160;SMPP的诊断标准:符合MPP诊断标准的同时符合重症肺炎标准,参考《儿童社区获得性肺炎诊疗规范(2019年版)》[4];②特应性体质的判断标准:有明确的个人过敏史和(或)血清吸入和食物过敏原过筛试验结果阳性,即sIgE≥0.35U/L。(2)纳入标准:①年龄≤14岁;②出院主诊断为肺炎支原体肺炎。(3)排除标准:①存在其他病原体等混合感染;②3个月内应用免疫抑制剂;③先天性发育缺陷或患有严重基础疾病;④病例资料不全。
2.观察指标:①收集250例MPP患儿的临床资料包括性别、年龄、住院天数、个人及家族过敏史等一般资料;发热、热峰、发热天数、咳嗽、咳嗽天数、肺部啰音、哮鸣音等临床症状及体征;②实验室指标主要包括乳酸脱氢酶(lactate dehydrogenase,LDH)、血清淀粉样蛋白A(serum amyloid A,SAA)、IgE、嗜酸性粒细胞计数、C反应蛋白(C-reactive protein, CRP)、炎性因子;③肺炎类型及有无肺实变、肺不张、胸腔积液等影像学报告;④临床治疗情况包括有无吸氧、支气管镜肺泡灌洗、使用激素以及激素累积应用剂量等。通过组间差异性分析讨论特应性体质MPP患儿的临床特征。
4.统计学方法:应用SPSS 25.0统计学软件对数据进行统计分析。采用K-S正态性检验后发现本研究的计量资料均不符合正态分布,故均采用中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用两独立样本Mann-WhitneyU检验。计数资料及分类变量以例数(百分比)[n(%)]表示,组间比较采用χ2检验或Fisher确切概率法。采用单因素和多因素Logistic回归分析探讨特应性体质儿童发生SMPP的独立危险因素;采用受试者工作特征(receiver operating characteristic, ROC)曲线评价LDH、IgE、SAA及三者联合检测对特应性儿童发生SMPP的预测效能,并通过绘制曲线,评估各指标对特应性体质儿童发生SMPP的预测价值,以P<0.05为差异有统计学意义。
结 果
1.特应性组和非特应性组的一般资料和临床特征比较:本研究共纳入250例MPP患儿,其中特应性组149例,非特应性组101例,两组间年龄、男女性别比例、住院天数、肺炎类型、发热、热峰、发热天数、咳嗽、咳嗽天数、肺部啰音、肺实变和肺不张发生率方面比较,差异均无统计学意义(P>0.05);特应性组MPP患儿的家族过敏史阳性(44.3% vs 15.8%,P<0.001)、重症肺炎(28.2% vs 11.9%,P=0.002)、日间咳嗽症状评分(3分 vs 3分,P<0.001)、夜间咳嗽症状评分(3分 vs 2分,P<0.001)及喘息(28.2% vs 8.9%,P<0.001)、肺部哮鸣音阳性(22.1% vs 11.9%,P=0.038)、合并胸腔积液(1.0% vs 7.4%,P=0.031)比例均高于非特应性组,差异均有统计学意义;治疗方面,特应性组需要激素治疗的占比较高(45.6% vs 31.7%,P<0.05)且激素累积应用剂量较高(P<0.05),差异均有统计学意义;氧气和支气管镜肺泡灌洗治疗方面比较,差异无统计学意义(P>0.05),详见表1。

表1 特应性组和非特应性组MPP患儿一般资料和临床特征比较[n(%),M(Q1,Q3)]
2.特应性组和非特应性组的实验室指标比较:特应性组SAA、IgE、IgA、IgM水平显著高于非特应性组,差异均有统计学意义(P均<0.05)。两组间的白细胞计数、嗜酸性粒细胞计数、D-二聚体、CRP、乳酸脱氢酶(lactate dehydrogenase,LDH)、IgG、白细胞介素(interleukin,IL)-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平比较,差异均无统计学意义(P>0.05),详见表2。
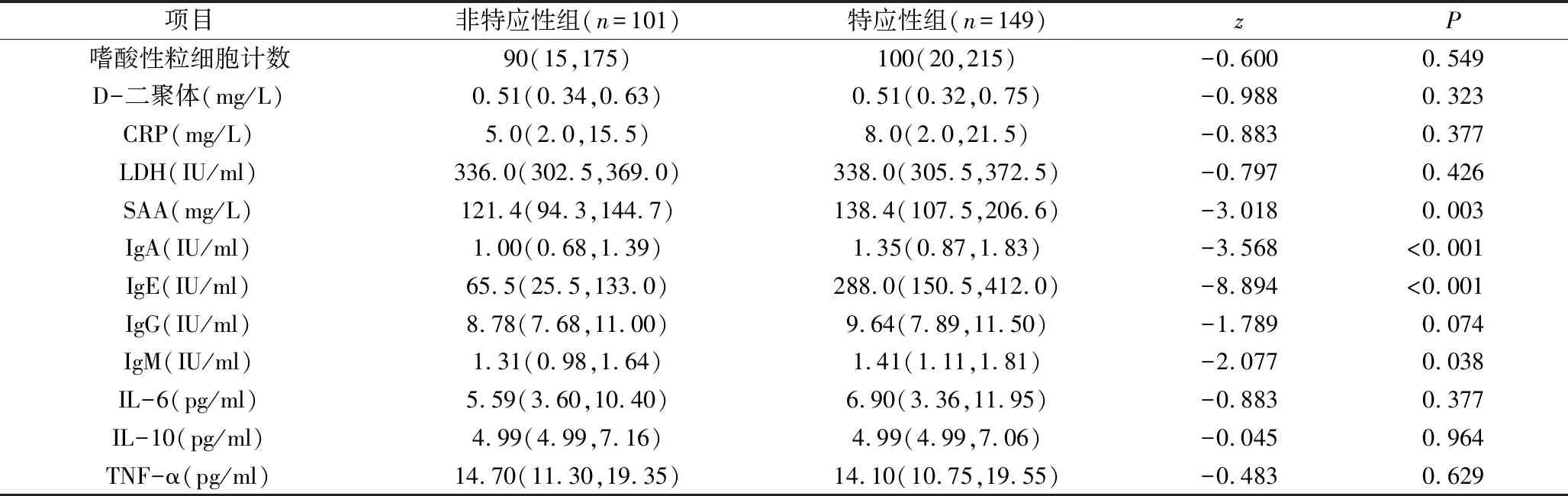
表2 特应性组和非特应性组MPP患儿实验室指标比较[n(%),M(Q1,Q3)]
3.特应性体质儿童发生SMPP的单因素和多因素Logistic回归分析:将性别、年龄、肺炎类型、CRP、SAA、LDH、IgA、IgE、IgG、IgM、IL-6、IL-10、TNF-α作为自变量,以是否发生SMPP为因变量进行单因素Logistic回归分析,将其中差异有统计学意义的因子纳入多因素Logistic回归分析。结果显示,SAA(OR=1.015)、LDH(OR=1.009)、IgE(OR=1.011)为特应性体质儿童发生SMPP的独立危险因素(P<0.05),详见表3。

表3 特应性体质儿童发生SMPP的单因素和多因素Logistic回归分析
4.特应性体质儿童重症MPP预测指标分析:将IgE、SAA、LDH纳入多因素Logistic回归,建立三者联合检测的预测模型。采用ROC曲线进一步评价SAA、LDH、IgE及联合检测模型的预测价值。结果表明,血清IgE、SAA、LDH及三者联合检测的指标均可用来预测特应性体质儿童重症MPP,其曲线下面积分别为0.790、0.781、0.799、0.881,以联合检测的预测价值最高,其敏感度为81.0%,特异性为85.0%,详见表4和图1。
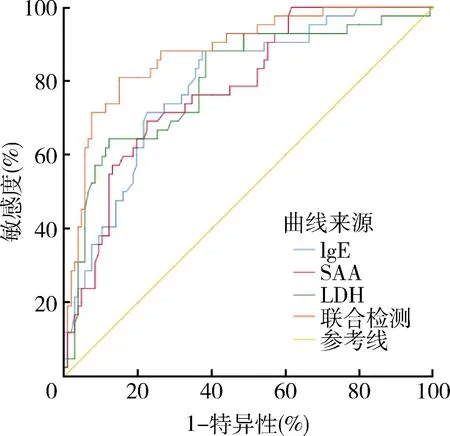
图1 IgE、SAA、LDH及三者联合检测对特应性体质MPP患儿发生SMPP预测价值的ROC曲线

表4 单个指标及联合检测对特应性体质儿童发生SMPP的预测效能
讨 论
MPP是儿童社区获得性肺炎的常见类型之一,通常病情较轻,预后良好,但仍有部分患儿可发展为SMPP,导致胸腔积液、呼吸衰竭等严重并发症及肺坏死、肺不张等后遗症,对儿童健康造成威胁[5,6]。证据表明,特应性体质儿童发生MPP相关肺外并发症和SMPP的风险增加[2]。了解特应性体质MPP患儿的临床特征对于该群体患儿的诊疗具有一定临床价值。本研究发现,特应性体质MPP患儿具有咳嗽症状更明显、易出现喘息等特征,存在明显的高气道反应。此外,特应性组患儿合并胸腔积液和发生重症肺炎的比例显著高于非特应性组,并且更需要吸氧和类固醇激素的治疗,表明特应性体质MPP患儿更易出现病情加重、治疗需求更高。
本研究结果显示,特应性组患儿血清IgE水平显著高于非特应性组,考虑与支原体本身可作为过敏原导致患儿致敏从而表达更高水平的IgE有关。本研究发现,IgE水平是特应性体质儿童发生SMPP的独立危险因素和预测指标之一,这与Wang等[7]的结论一致。既往认为,MP的致病途径主要通过对宿主细胞的黏附、破坏造成肺泡损伤,导致肺功能损害[8]。更多研究表明,MP的致病作用与感染后的免疫炎性反应失衡相关[9, 10]。Wang等[7]和Yang等[19]研究发现,免疫反应失衡可导致MPP患儿发生多个肺外系统的严重并发症,并可能延长病程。由于异常升高的IgE水平是免疫失衡的标志之一[11]。笔者推测IgE水平能够在一定程度上反映特应性体质MPP患儿异常免疫状态,从而间接反映特应性体质MPP患儿的病情。
本研究表明,LDH水平是SMPP的独立危险因素。ROC曲线分析显示,当LDH>378.5U/L时,该患儿发生SMPP的可能性大,与邓黎明等[12]研究结论一致。LDH作为糖酵解途径中一种重要的酶,广泛存在于组织细胞中,当组织遭到破坏时会释放酶入血,导致血液中LDH迅速增高,LDH水平可作为细胞和组织损伤的标志物[13]。MP通过黏附、破坏肺组织细胞膜进而释放LDH入血,使得外周血LDH水平显著升高,因此,LDH可作为反映MPP病情的指标之一。但目前对于预测SMPP发生的LDH最佳临界值尚未达到共识,有待更多、更大样本量的临床研究进一步确认[14]。此外,本研究中LDH水平在特应性组与非特应性组组间比较,差异无统计学意义,这提示特应性体质对LDH水平无显著影响。
SAA是肝细胞分泌的一种敏感的急性期反应蛋白,当机体受支原体等刺激时,血清SAA可在短时间内迅速升高,且其半衰期短,病情好转时可迅速下降[15]。本研究发现,特应性组MPP患儿血清SAA水平显著高于非特应性组,但关于特应性体质与SAA间的关系,目前未查到相关文献。笔者考虑可能与特应性体质患儿存在免疫紊乱、炎性细胞因子水平异常间接刺激SAA分泌增加。其次,本研究发现SAA是影响特应性体质MPP患儿发生SMPP的独立危险因素。肖飞等[16]和左路广等[17]研究指出,较高水平的SAA提示病情较重、预后不佳,且特应性体质MPP患儿SAA水平随着病情的加重显著上升。以上表明SAA检测对特应性体质儿童SMPP的早期诊断及病情评估具有一定的价值,但特应性体质MPP患儿血清SAA升高的机制尚不清楚,需要进一步研究阐明。
研究表明,Th1细胞产生的IL-6、TNF-α等促炎性细胞因子在MPP致病过程中起主要作用,而代表Th2细胞的IL-10作为抑炎性细胞因子则是在抵抗MP感染和抑制炎性反应中发挥作用[18]。MPP存在Th1/Th2细胞比例的失衡[19, 20]。本研究发现,特应性与非特应性组MPP患儿的IL-6、TNF-α、IL-10水平无明显差异,同时,其水平并不是特应性体质儿童发生SMPP的独立危险因素,可能与特应性体质MPP患儿本身具有其特殊的免疫特征有关[18, 21]。但目前此类研究较少,需要更多的基础和临床研究来阐述Th1/Th2细胞及IL-6、TNF-α、IL-10等细胞因子与特应性体质儿童MPP疾病之间关系。
本研究存在一定的局限性:①本研究为单中心回顾性研究,且纳入的病例数有限,可能存在一定偏倚;②本研究未能使用一种病情严重程度评分系统,无法反映特应性体质与SMPP疾病程度之间的相关程度。
综上所述,特应性体质MPP患儿具备其独特的临床特征,容易出现病情加重、治疗需求较高,临床医师需要关注该群体患儿的病情变化并及时调整治疗方案以避免SMPP的发生。此外,血清IgE、LDH、SAA三者联合检测对特应性体质儿童发生SMPP具有一定的临床预测价值。
利益冲突声明:所有作者均声明不存在利益冲突。

