响应面法优化蛹虫草液体发酵配方及条件的研究
童奇伟 周吉亮 罗珊珊 曹天旭 蒋佳颖 杜萍*
响应面法优化蛹虫草液体发酵配方及条件的研究
童奇伟1周吉亮2罗珊珊2曹天旭2蒋佳颖2杜萍2*
(1. 重庆三峡学院生物与食品工程学院,重庆 万州 404100;2. 长江师范学院现代农业与生物工程学院,重庆 涪陵 408100)
蛹虫草是一种珍稀的药食两用真菌,为提高其菌丝体的液体发酵效率,首先通过单因素试验确定了蛹虫草液体发酵的最优碳源、氮源及适宜培养的pH、温度、装液量和转速6个因素。然后采用Plackett-Burman试验设计,确定葡萄糖、牛肉膏、温度是影响蛹虫草液体发酵菌丝体生物量的关键因素。利用响应面法设计三因素三水平试验,最终获得蛹虫草菌丝体液体发酵的最佳配方及条件为:牛肉膏13.34 g/L、葡萄糖20.00 g/L、MgSO41.5 g/L、KH2PO41.5 g/L,pH 6.5,摇床转速150 r/min,温度27 ℃。验证试验表明,优化后条件培养的菌丝生物量可达1.489 g/105 mL,是优化前的2倍,与模型预测值基本一致,优化效果较好,可为蛹虫草液体深层发酵培养及后续工厂化生产提供技术参考。
蛹虫草;液体发酵;响应面法;菌丝生物量
蛹虫草()又名北冬虫夏草,是子囊菌亚门、麦角菌科、虫草属的一种药食两用真菌[1-3]。蛹虫草与珍稀药用菌冬虫夏草在有效成分、功效等方面有诸多相似之处。相比冬虫夏草,蛹虫草还具有生长周期短、更易人工培养的优势。近年来,蛹虫草作为冬虫夏草的替代品被广泛开发利用,其子实体富含虫草多糖、虫草素和甾醇类等多种活性成分[4-6]。虫草素(Cordyce-pin)作为其利用最为广泛的活性成分,具有抗菌、抗炎、抗病毒等功效,常被用来治疗人体免疫方面的疾病[7-9]。
液体发酵培养法因生产周期短、可连续发酵、便捷、获取发酵活性物质成本低而被广泛应用。蛹虫草液体培养菌丝体的化学组成与子实体接近[10],其液体培养基配方及发酵条件的研究多采用单因素或正交试验方法,选取的培养基配方及条件的因素不够全面,得到的工艺条件有较大偏差。响应面分析法通过回归方程分析优化试验条件,预测响应值,反映各因素之间对结果的交互影响,可有效确定多个影响因子的最佳组合条件。因此,本研究采用响应面法优化蛹虫草液体发酵配方及条件,为提高工业发酵蛹虫草菌丝体生物量提供参考。
1 材料与方法
1.1 材料
供试菌种。蛹虫草母种为野生标本分离菌种,菌株编号为JLCY-LI819,标本于2016年7月16日由北华大学林学院由士江采自吉林省吉林市永吉县口前镇,经ITS序列鉴定为,即蛹虫草,基因序列号为MT525327,现保存于长江师范学院食用菌栽培实验室。
供试培养基配方。PDA培养基(用于母种扩繁):马铃薯200 g/L、葡萄糖20 g/L、琼脂15 g/L,pH自然。基础培养基:碳源20 g/L、氮源10 g/L、KH2PO40.5 g/L、MgSO40.5 g/L,pH自然。
1.2 方法
1.2.1 单因素试验
(1)碳源试验。设葡萄糖、果糖、木糖、蔗糖、甘露醇、糊精、乳糖、可溶性淀粉和麦芽糖9种供试碳源,分别添加到以蛋白胨为氮源的基础培养基中,250 mL锥形瓶装液量为100 mL,常规方法制备培养液,待灭菌冷却后接入2块1 cm2大小的蛹虫草菌块,于27 ℃、130 r/min摇床培养7天,每天观察菌丝生长情况及长势,培养结束后,用纯净水将菌丝体冲洗干净,置于50 ℃烘箱干燥至恒重后测定菌丝生物量(干重),每处理5次重复。
(2)氮源试验。设尿素、硝酸铵、蛋白胨、麸皮、麦芽浸膏、酵母膏与牛肉膏7种供试氮源,分别添加到以葡萄糖为碳源的基础培养基中,其他操作同碳源试验,下同。
(3)pH试验。采用葡萄糖为碳源,蛋白胨为氮源的基础培养基,将培养液的pH分别调节至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5与8.0。
(4)温度试验。采用葡萄糖为碳源,蛋白胨为氮源的基础培养基,培养温度分别设置为19、21、23、25、27与31 ℃。
(5)转速试验。采用葡萄糖为碳源,蛋白胨为氮源的基础培养基,发酵液pH调节到6.5,转速分别设置为110、120、130、140、150与160 r/min。
(6)装液量试验。采用葡萄糖为碳源,蛋白胨为氮源的基础培养基,发酵液pH调节到6.5,转速130 r/min,装液量分别设置为30、45、60、75、90、105、120与130 mL。
1.2.2 蛹虫草液体发酵Plackett-Burman设计
根据单因素试验结果,以菌丝体生物量为评价指标,通过Design-Expert 8.0.6软件设计6因素2水平的Placket-Burman响应面试验(表1),筛选对蛹虫草菌丝生长影响显著的因素,并分析不同因素间的相互作用。
1.2.3 蛹虫草液体发酵Box-Behnken 试验
在1.2.2试验结果的基础上,以葡萄糖浓度、牛肉膏浓度与培养温度为自变量,通过Box-Behnken设计3因素3水平的响应面试验(表2),以菌丝体生物量为响应值,对菌丝体生物量进行二次多元回归方程拟合,得到各因素与响应值之间函数关系的回归方程,根据试验生成的等高线和响应面图确定最优的发酵条件。
1.2.4 模型的验证
以发酵实验验证响应面模型优化的最佳条件,比较模型预测值与实验值,验证模型的有效性,实验重复4 次,取平均值。从15组条件中选出一组最佳的培养工艺,对分析出来的最佳工艺条件模型再进行4次重复试验,以验证响应面分析结果的准确性和实际可行性,并与响应面优化前获得的菌丝生物量进行比较。
1.2.5 数据分析
采用Microsoft Excel 2016对试验数据进行整理,利用SPSS 25.0软件进行数据的差异显著性检测及方差分析(< 0.05),GraphPad Prism 5.0软件绘图,以Design-Expert 8.0.6进行Placket-Burman与Box-Behnken的试验设计、分析测试结果,以优化因素的最佳添加量。
2 结果与分析
2.1 单因素试验
2.1.1 不同碳源与氮源的蛹虫草菌丝生物量
在发酵液中添加不同碳源与氮源对蛹虫草菌丝生物量的影响不同(图1~图3)。碳源以葡萄糖的菌丝体生物量显著高于其他碳源,菌丝球密集,木糖的菌丝体生物量最低,菌丝球最少。氮源则以牛肉膏培养基蛹虫草菌丝体生物量最高,菌丝球数量多而密集,以尿素为氮源的菌丝体生物量最低,几乎不生长。
2.1.2 不同pH与培养温度的蛹虫草生物量
随着发酵液pH与培养温度的升高,蛹虫草菌丝体的生物量均呈先增加后下降的变化趋势(图4~图6)。发酵液pH为6.5时,菌丝体生物量最高,为0.67 g/100 mL,pH 4和8的菌丝体生物量显著低于其他处理。发酵液pH在5.5~7时,菌丝球大小基本一致,而pH偏低或偏高时,发酵液呈淡黄色,菌丝球小而数量少。

表1 Plackett-Burman分析因素及水平

表2 Box-Behnken分析因素及水平
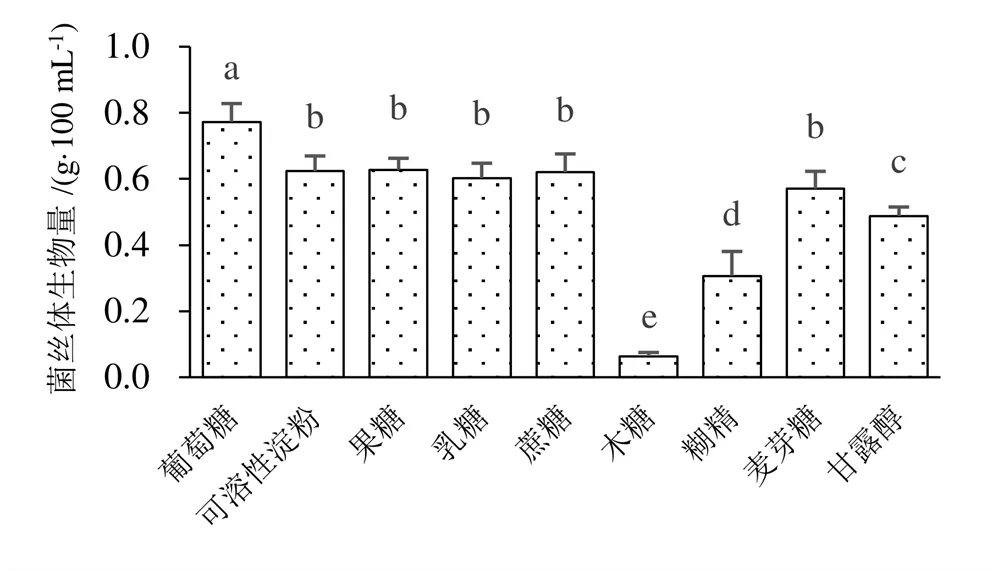
注:小写字母不同表示在P < 0.05水平差异显著,下同。
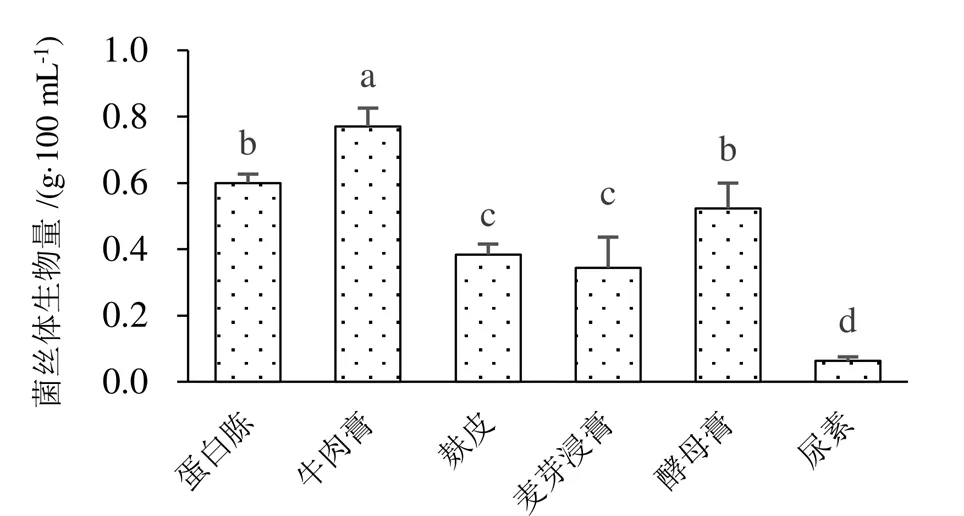
图2 不同氮源对蛹虫草菌丝体生物量的影响

图3 不同碳源与氮源蛹虫草液体发酵情况

图4 不同pH与培养温度蛹虫草液体发酵情况
培养温度以27 ℃时,菌丝体生物量显著高于其他处理,为0.6 g/100 mL,且菌丝生长茁壮,几乎覆盖整个液面。当培养温度为19 ℃时,菌丝体生物量最低,为0.05 g/100 mL。
2.1.3 不同装液量与培养转速的蛹虫草生物量
不同装液量与培养转速对蛹虫草菌丝体的生物量有显著影响,随着装液量与培养转速的增加,菌丝生物量均呈现先增加后下降的单峰曲线变化(图7~图9)。装液量以105 mL菌丝体生物量显著高于其他处理,菌丝球整体长势较好,均匀一致,培养液呈清亮的淡黄色。培养转速以150 r/min菌丝生物量最高,为0.89 g/100 mL,显著高于其他处理,当转速为110 r/min时,菌丝体生物量最低,仅为0.04 g/100 mL。
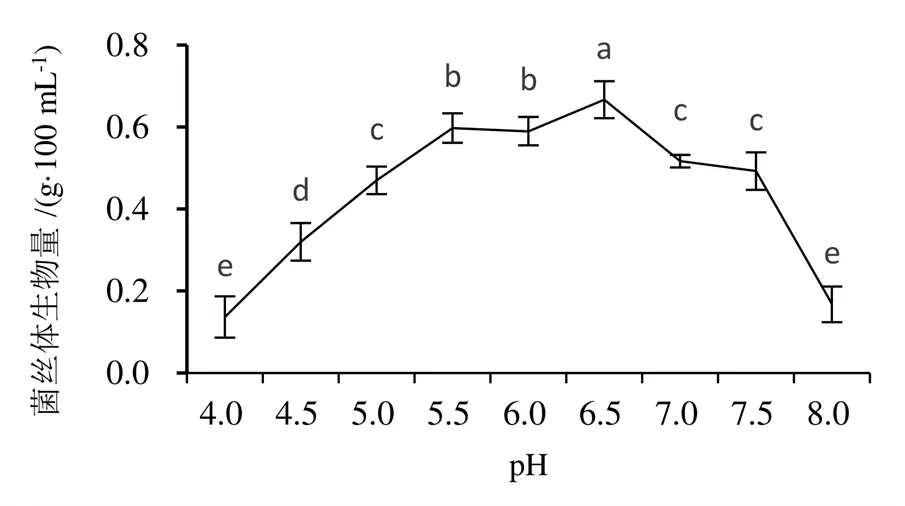
图5 不同pH对蛹虫草菌丝体生物量的影响
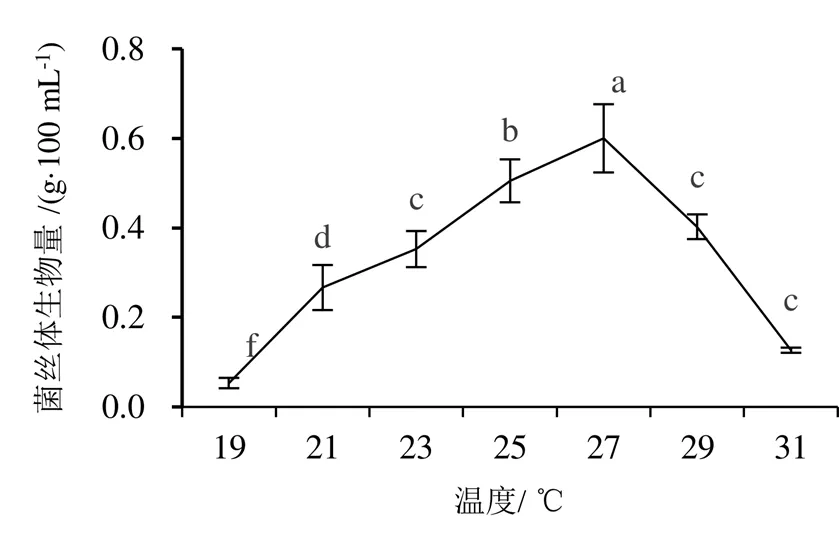
图6 不同温度对蛹虫草菌丝体生物量的影响
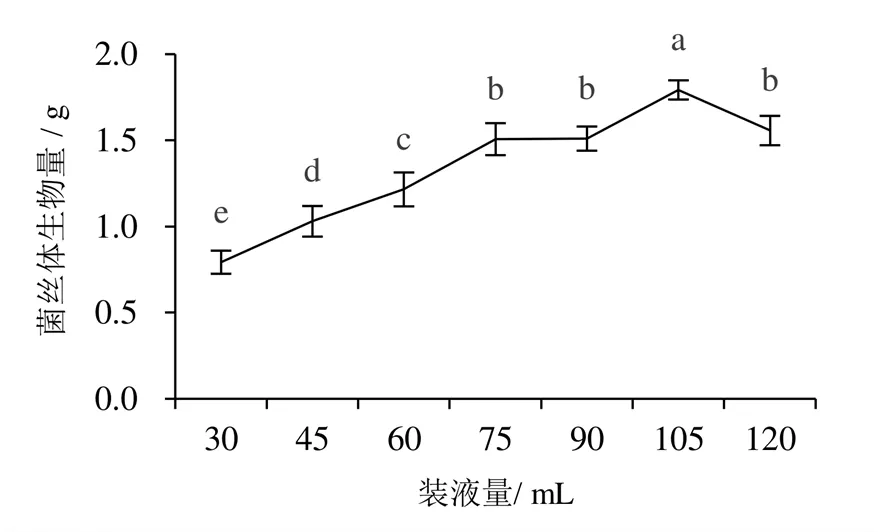
图7 不同装液量对蛹虫草菌丝体生物量的影响
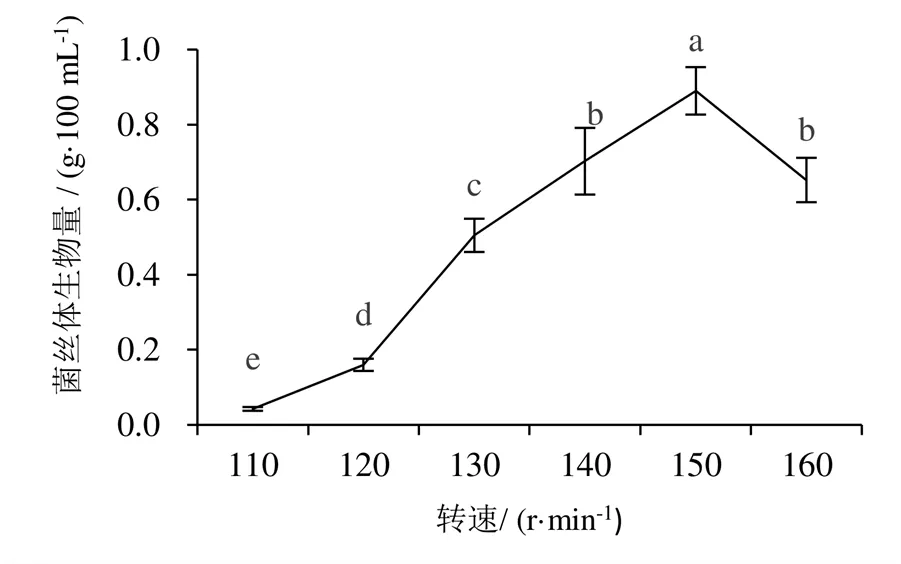
图8 不同培养转速对蛹虫草菌丝体生物量的影响
2.2 Plackett-Burman试验结果
在单因素试验结果的基础上,以菌丝体生物量为响应值,以影响菌丝体生物量的葡萄糖、牛肉膏、温度、pH、转速、装液量6个因素为考察因素,Plackett-Burman试验设计及结果见表3,可知不同发酵液配方与发酵条件的组合对蛹虫草菌丝体生物量的影响不同,菌丝体生物量从0.22 g到1.16 g不等。进一步方差分析表明,葡萄糖(A)、牛肉膏(B)、温度(C)3个因素对蛹虫草菌丝体生物量具有显著性影响(表4)。

图9 不同装液量与培养转速对蛹虫草液体发酵的影响
2.3 Box-Behnken 试验结果
在单因素试验和Plackett-Burman试验的基础上,确定葡萄糖、牛肉膏、温度是影响蛹虫草液体发酵菌丝体生物量的关键因素,以这3个因素为自变量,以生物量为响应值,运用Box-Behnken方法设计三因素三水平试验进一步优化发酵参数,结果见表5,菌丝体生物量在0.891~1.587 g/105 mL之间。用Design Expert 8.0.6 软件对试验数据进行回归分析,得到如下方程描述蛹虫草菌丝体生物量的响应面特征:
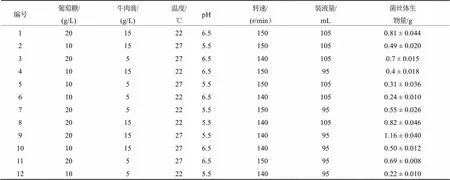
表3 Plackett-Burman试验设计及结果
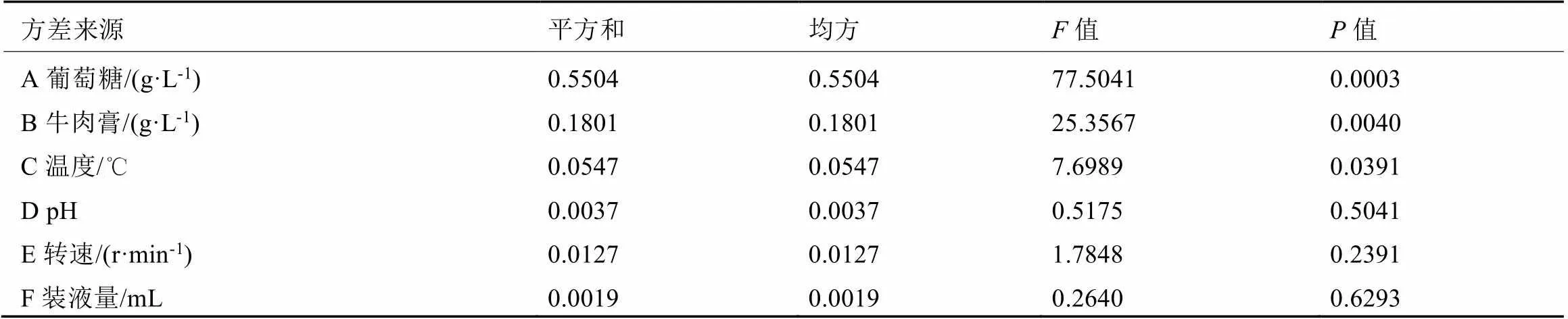
表4 Plackett-Burman方差分析结果
=1.56+0.14+0.14-0.061-0.086+0.009-0.062-0.1182-0.2092-0.1412
其中,是预测的菌丝体生物量,、、分别为葡萄糖、牛肉膏与培养温度的编码值。
回归方程的方差分析表明,所建回归方程的模型差异显著(< 0.05),而失拟项差异不显著(> 0.05),表明模型具有较高可靠性,建模成功。此外,葡萄糖、牛肉膏与培养温度3个因素,以及、、2、2与2均显著,模型的拟合度2为0.9841,表明该二次方程模型可以解释和预测98.41%的变量响应(表6)。
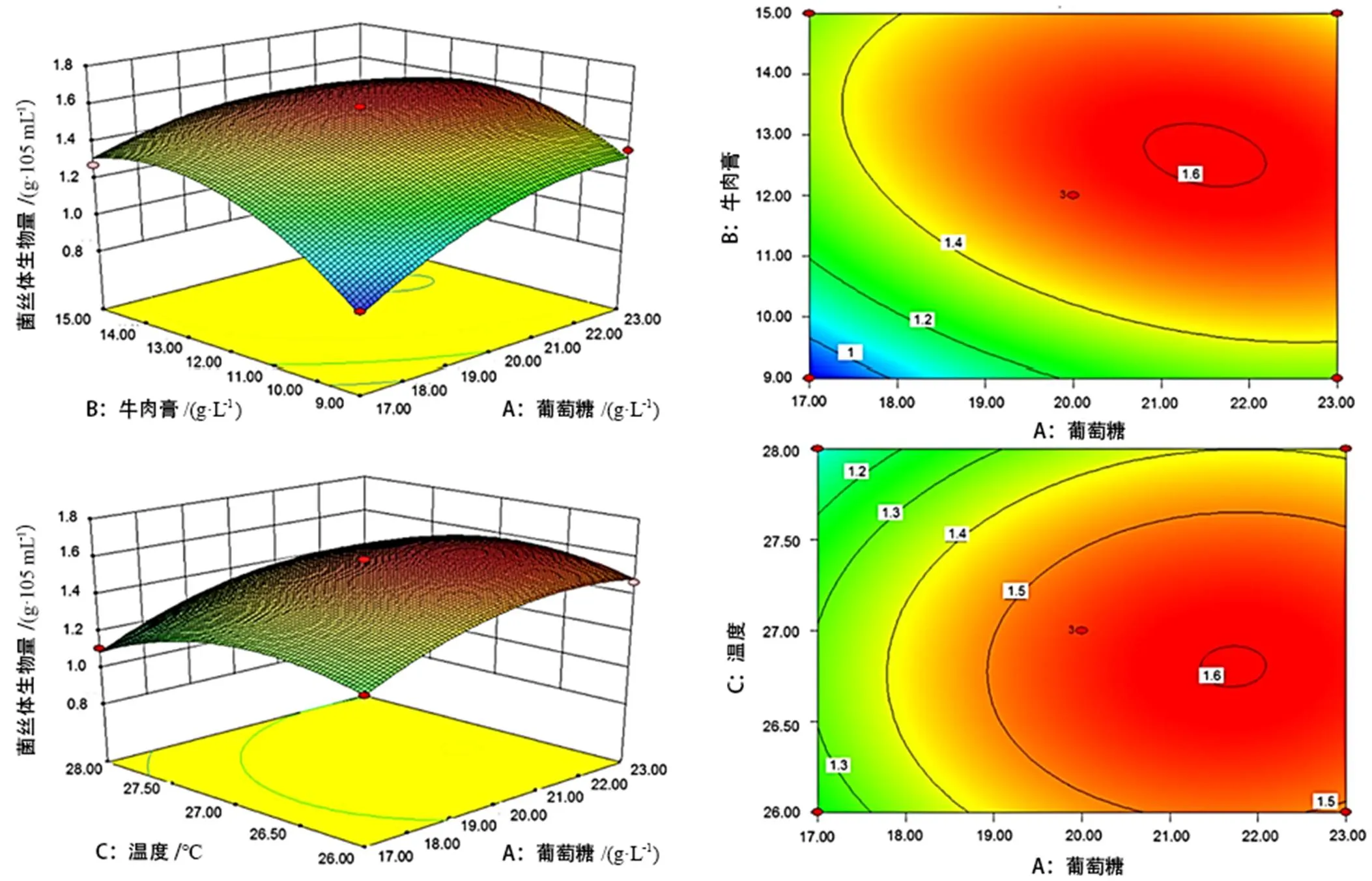
2.4 响应曲面分析
葡萄糖、牛肉膏与培养温度3个因素两两交互作用对菌丝体生物量的响应面曲面图见图10。响应曲面图越陡,因素之间的交互作用越显著,反之不显著;等高线越密集且形状越近似于椭圆形,因素之间交互效应越强,反之越弱[11]。由图10可知,葡萄糖与牛肉膏、牛肉膏与培养温度的交互作用显著,而葡萄糖与培养温度的交互作用不显著。在等高线图中,蓝色区域为响应最低值,红色区域为响应最高值。当温度为27 ℃时,葡萄糖浓度为20~23 g/L,牛肉膏浓度为12~14 g/L时蛹虫草菌丝体生物量最高。牛肉膏浓度为12 g/L,当葡萄糖浓度为20~23 g/L,温度为26~27.5 ℃时蛹虫草菌丝体生物量最高,其余区间干重较低不适合取值。当葡萄糖浓度为20 g/L时,牛肉膏浓度为12~14 g/L,温度为26~27.5 ℃为最佳取值区间,得到的蛹虫草菌丝干重最高。
2.5 验证试验
综合单因素试验结果和响应面模型数据分析得出愿望函数优化,得到蛹虫草最佳液体发酵培养基的配方为:牛肉膏为13.34 g/L、葡萄糖20.0 g/L、MgSO41.5 g/L、KH2PO41.5 g/L,pH 6.5。最适培养条件为:温度27 ℃,转速150 r/min,装液量105 mL,发酵周期7 d。利用该参数再次进行液体发酵培养,以检验该模型的准确性,4个平行试验结果得到菌丝体干重1.489 g,与预测值基本一致。

表5 Box-Behnken试验设计及结果
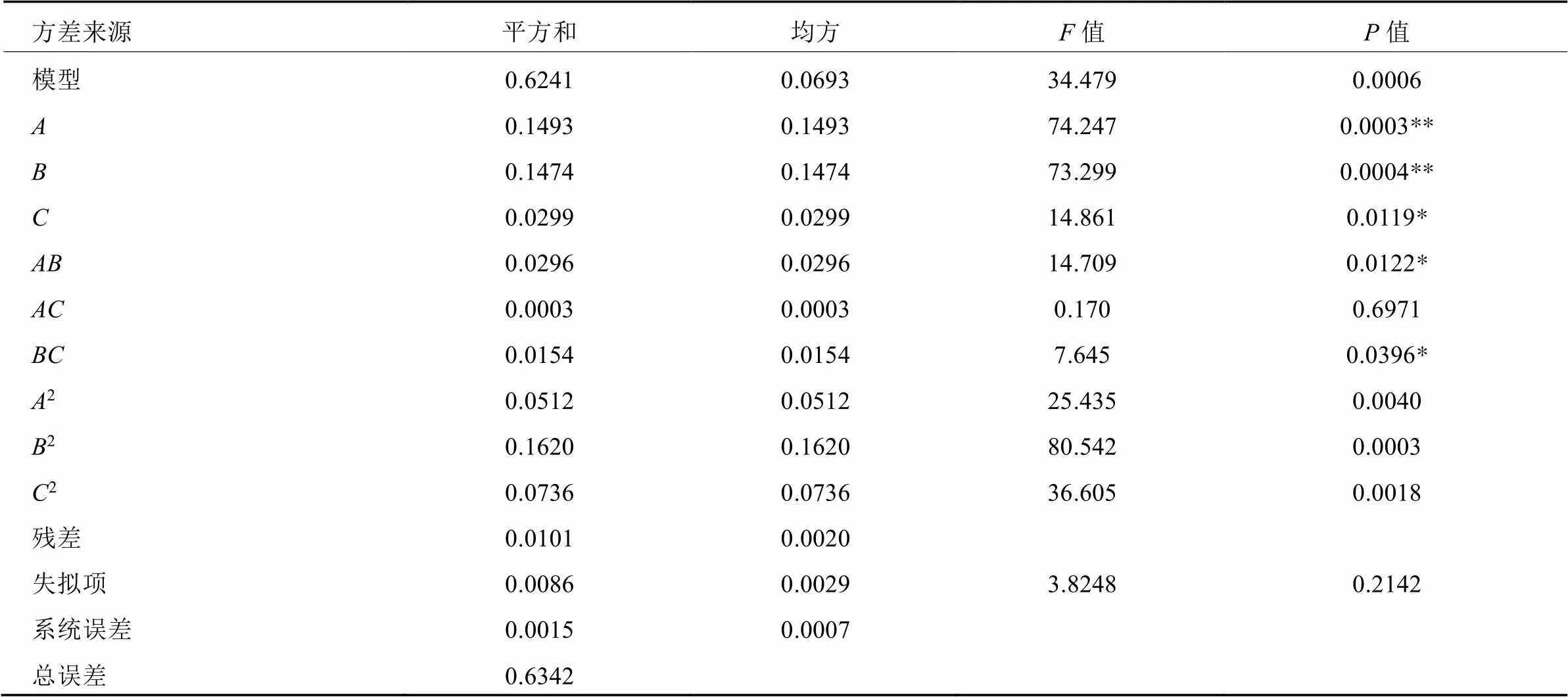
表6 响应面法优化发酵条件试验模型
注:2= 0.9841,2Adj= 0.9556;*与**分别表示差异显著(<0.05)与极显著(<0.01)。
3 讨论与结论
蛹虫草含有虫草多糖、虫草素、甾醇等生物活性物质,具有降血糖、抗炎、抗肿瘤、抗转移、降血脂、免疫调节和抗氧化等作用,食药用价值高。优化发酵配方与发酵条件是提高蛹虫草液体发酵效率的重要途径。本研究通过单因素试验明确了发酵液中的碳源、氮源、培养温度、pH、装液量与培养转速对蛹虫草菌丝体发酵的影响,并在此基础上利用Plackett-Burman与Box-Behnken设计进行响应面优化试验,分析了因素间的交互作用。结果显示葡萄糖与牛肉膏分别是发酵液的最优碳源与氮源。此前,也有研究表明葡萄糖是蛹虫草菌丝体生长与虫草素合成的重要前体,这与本研究的结果一致[12]。本研究氮源试验表明牛肉膏、蛋白胨与酵母膏等有机氮源均利于蛹虫草菌丝体的生长,而无机氮的尿素则不利于菌丝的生长,这与Mao等[13]的研究结果相近。响应面分析表明葡萄糖与牛肉膏2个因素之间存在显著的交互作用,因此在考虑碳源与氮源用量时应该综合考虑。
本研究显示蛹虫草菌丝体在弱酸性环境中(pH 5.5~6.5)生长良好,这与Sung等[14]以及Park等[15]的研究结果相近。培养转速与装液量均关系到发酵液中的溶氧量,而适宜的溶氧量有利于菌丝体的生长和代谢平衡。本研究蛹虫草菌丝体液体培养最佳装液量为105 mL,最佳转速为150 r/min,这与刘然等的研究结果接近[16]。
综上所述,本研究获得的蛹虫草菌丝体液体发酵的最佳配方及条件为:牛肉膏13.34 g/L、葡萄糖20.00 g/L、MgSO41.5 g/L、KH2PO41.5 g/L,pH为6.5,摇床转速150 r/min,温度27.08 ℃(为便于操作,使用27 ℃)。验证试验表明,优化后的菌丝生物量可达1.489 g/105 mL,是优化前的2倍,与模型预测值基本一致,优化效果较好,为蛹虫草液体深层发酵培养及后续工厂化生产提供了技术参考和理论依据。
[1] 黄年来, 林志彬, 陈国良, 等.中国食药用菌学[M]. 上海: 上海科技文献出版社, 2010: 1763.
[2] LIAN T T, YANG T, YANG T, et al. Variations of SSU rDNA group I introns in different isolates ofand the loss of an intron during cross-mating[J]. Journal of Microbiology, 2014, 52(8): 659-666.
[3] WU F, ZHOU L W, YANG Z L, et al. Resource diversity of Chinese macrofungi: edible, medicinal and poisonous species[J]. Fungal Diversity, 2019, 98(1): 1-76.
[4] WONG K L, WONG R N S, ZHANG L, et al. Bioactive proteins and peptides isolated from Chinese medicines with pharmaceutical potential[J]. Chinese Medicine, 2014, 9(19): 1-14.
[5] 周苏, 邢增涛, 饶钦雄. 高效液相色谱法测定虫草中核苷类和麦角甾醇[J]. 上海农业学报, 2014, 30(2): 60-64.
[6] 江琦, 娄在祥, 王正齐, 等. 蛹虫草虫草多糖的分离纯化、分子构象分析及抗氧化活性研究[J]. 食品与发酵工业, 2019, 45(1): 22-28.
[7] 樊慧婷, 林洪生. 蛹虫草化学成分及药理作用研究进展[J]. 中国中药杂志, 2013, 38(15): 2549-2552.
[8] 杨涛, 董彩虹. 虫草素的研究开发现状与思考[J]. 菌物学报, 2011, 30(2): 180-190.
[9] 李虎臣, 孙平, 冯成强. 蛹虫草中活性成分虫草素的研究进展[J]. 井冈山大学学报(自然科学版), 2010, 31(2): 93-96.
[10] 曾宏彬, 宋斌, 李泰辉. 蛹虫草研究进展及其产业化前景[J]. 食用菌学报, 2011, 18(2): 70-74.
[11] DERRIEN M, BADR A, GOSSELINO A, et al. Optimization of a green process for the extraction of lutein and chlorophyll from spinach by-products using response surface methodology (RSM) [J]. LWT - Food Science and Technology, 2017, 79: 170-177.
[12] KREDICH M N, GUARINO J A. Studies on the biosynthesis of cordycepin[J]. Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism, 1961, 47(3): 529-534.
[13] MAO X B, ZHONG J J. Significant effect of NH4+on cordycepin production by submerged cultivation of medicinal mushroom[J]. Enzyme and Microbial Technology, 2006, 38(3-4): 343-350.
[14] SUNG J M, CHOI Y S, SHRESTHA B, et al. Investigation on artificial fruiting of[J]. The Korean Journal of Mycology, 2002, 30(1): 6-10.
[15] PARK J P, KIM S W, HWANG H J, et al. Optimization of submerged culture conditions for the mycelial growth and exo-biopolymer production by[J]. Letters in applied microbiology, 2001, 33(1): 76-81.
[16] 刘然, 曲亮璠, 王祥河, 等. 蛹虫草菌丝体液体发酵条件的优化研究[J]. 食品工程, 2019, 152(3): 31-34, 42.
Optimization of formula and conditions for liquid fermentation ofby response surface method
TONG Qiwei1ZHOU Jiliang2LUO Shanshan2CAO Tianxu2JIANG Jiaying2DU Ping2*
(1. College of Biology and Food Enginerring, Chongqing Three Gorges University, Wanzhou 404100, China;2. College of Modern Agriculture and Bioengineering, Yangtze Normal University, Fuling 408100, China)
is a kind of rare medicinal and edible mushroom. In order to improve the liquid fermentation efficiency of its mycelia, the optimum carbon source, nitrogen source, pH, temperature, volume of culture media and rotation speed for liquid fermentation were optimized by single factor test. Then Plackett-Burman method was used to further optimize the single factors that were screened to affect mycelia biomass to screen the key influencing factors. The optimal formula and conditions of liquid fermentation ofmycelia were obtained as follows: beef extract 13.34 g/L, glucose 20.00 g/L, MgSO41.5 g/L, KH2PO41.5 g/L, pH 6.5, shaking speed 150 r/min, temperature 27 ℃. Verification tests showed that the biomass of mycelia under optimized conditionscould reach 1.489 g/105 mL, which was twice that before optimization, basically consistent with the predicted value of the model, and the optimization effect was good, which provided a theoretical basis for liquid deep fermentation culture and subsequent factory production of.
; liquid fermentation; response surface method; mycelial biomass
S646
A
2095-0934(2024)01-052-08
全国大学生创新创业训练计划项目(X202310647090);长江师范学院大学生创新创业训练计划项目(X202310647090)
童奇伟(1998—),男,硕士研究生,研究方向为食药用菌资源及驯化栽培研究。E-mail:1694180435@qq.com
杜萍(1982—),女,博士,教授,主要从事食药用菌资源、驯化栽培及分子系统学研究。E-mail:duping7374@163.com。

