不同术式治疗基底节区高血压脑出血的近期疗效观察
叶亮亮 周立田 焦磊 丁俊宏 余前 刘维军 杨平来
高血压脑出血(hypertensive intracerebral hem⁃orrhage,HICH)起病急骤,病情进展快,不仅影响患者神经功能,且复发率、致残率高,预后极差[1]。临床对于符合手术指征的中重度HICH 患者多采取外科治疗,以清除颅内血肿,避免因出血而引发的一系列继发性损害,从而改善患者预后。目前HICH 的外科治疗术式较多,但疗效、预后各异,至今尚无统一标准。近几年随着显微外科技术的发展,神经内镜手术在神经外科获得了较高的认可度。神经特异性烯醇化酶(neurospecific enolase,NSE)为血清神经标志物,可反映神经元损伤。研究表明,脑损伤后,NSE 可通过血⁃脑屏障,迅速升高血清NSE 水平[2]。前白蛋白(prealbumin,PA)是反映肝脏合成及分泌蛋白功能的急性负时相蛋白,研究发现,HICH 患者在应激状态下,可激活机体炎症反应,产生急性负时相蛋白,使PA 血清水平降低[3]。基底节区是HICH 的常见病变部位,目前临床针对基底节区HICH 的手术治疗方法尚存争议,故本研究通过对比导航辅助神经内镜硬通道微创与小骨窗开颅血肿清除术两种术式治疗基底节区HICH患者的近期疗效,进一步分析比较各自的优缺点,以期为基底节区HICH 患者的治疗提供参考。
1 资料与方法
1.1 一般资料
收集2021 年1 月至2023 年1 月于南京市溧水区人民医院就诊住院的HICH 患者资料。纳入标准:①符合HICH 诊断标准[4];②经影像学检查证实为基底节区脑出血;③患者均在发病后48 h 内接受手术治疗;④临床资料齐全。排除标准:①创伤、颅内肿瘤、梗死等其他原因引起的脑出血;②凝血功能障碍;③多发性颅内出血;④心肺肝肾严重障碍;⑤合并其他感染性疾病;⑥颅内出血量>60 mL;⑦临床资料缺失。严格按照以上标准共收集83 例患者资料,根据手术方法不同分为内镜组(n=43)和开颅组(n=40)。两组一般资料比较差异无统计学意义(P>0.05)。见表1。本研究经医院伦理委员会批准。所有患者家属均在术前签字,确认知情并签署同意书后进行手术治疗。
表1 两组患者一般资料对比[(),n(%)]Table 1 Comparison of general information between two groups of patients[(),n(%)]

表1 两组患者一般资料对比[(),n(%)]Table 1 Comparison of general information between two groups of patients[(),n(%)]
1.2 方法
所有患者均完善术前实验室、生化检查,行头颅CT 检查,明确出血位置及出血量,采用全身麻醉,气管插管,全头皮备皮,术中严密监测生命体征。术野皮肤常规消毒铺单。参考文献[5],内镜组和开颅组分别予导航辅助神经内镜硬通道微创治疗和小骨窗开颅血肿清除术治疗。
1.3 观察指标
1.3.1 围术期指标
记录手术时间、出血量、血肿清除率及ICU入住时间。血肿清除率=(手术前后血肿量差值/术前血肿量)×100%,血肿量根据患者CT信息,采用多田公式计算[6]。
1.3.2 NSE、PA 水平
分别于术前、术后7 d 取患者空腹静脉血5 mL,离心后以酶联免疫吸附法测定血清NSE(试剂盒购自R&D Systems,Inc.),以用全自动生化分析仪检测血清PA 水平(日立7600 型)。
1.3.3 神经功能
分别于术前、术后7 d 对患者进行美国国立卫生院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分,评分范围0~42 分,评分越低,神经功能越好[7]。
1.3.4 术后并发症
主要包括术后再出血、颅内感染、肺部感染、水电解质紊乱、消化道出血。
1.4 统计学处理
采用SPSS 25.0 软件进行数据分析,计量资料通过()表示,两组间比较行独立t检验,组内比较行配对t检验;计数资料通过n(%)表示,比较行χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组围术期指标比较
与开颅组相比,内镜组手术时间较长,出血量较少,血肿清除率较高,ICU 入住时间较短,差异有统计学意义(P<0.05)。见表2。
表2 两组围术期指标对比()Table 2 Comparison of perioperative indicators between two groups()

表2 两组围术期指标对比()Table 2 Comparison of perioperative indicators between two groups()
2.2 两组血清NSE、PA 水平比较
术前,两组血清NSE、PA 比较,差异无统计学意义(P>0.05);术后7 d,两组血清NSE 较术前明显降低,PA 较术前明显升高,差异有统计学意义(P<0.05),且与开颅组相比,内镜组血清NSE 更低,PA 更高,差异有统计学意义(P<0.05)。见表3。
表3 两组术前、术后7 d 的血清NSE、PA 水平对比()Table 3 Comparison of serum NSE and PA levels between the two groups before surgery and 7 days after surgery()

表3 两组术前、术后7 d 的血清NSE、PA 水平对比()Table 3 Comparison of serum NSE and PA levels between the two groups before surgery and 7 days after surgery()
注:与同组术前比较,aP<0.05。
2.3 两组术后神经功能比较
术前,两组NIHSS 评分比较,差异无统计学意义(P>0.05);术后7 d,两组NIHSS评分较术前均明显降低,差异有统计学意义(P<0.05),且内镜组NIHSS 评分低于开颅组,差异有统计学意义(P<0.05)。见表4。
表4 两组术前、术后7 d 的NIHSS 评分对比[(),分]Table 4 Comparison of NIHSS scores between two groups before surgery and 7 days after surgery[(),points]

表4 两组术前、术后7 d 的NIHSS 评分对比[(),分]Table 4 Comparison of NIHSS scores between two groups before surgery and 7 days after surgery[(),points]
注:与同组术前比较,aP<0.05。
2.4 两组术后并发症比较
内镜组术后并发症总发生率明显低于开颅组,差异有统计学意义(P<0.05)。见表5。
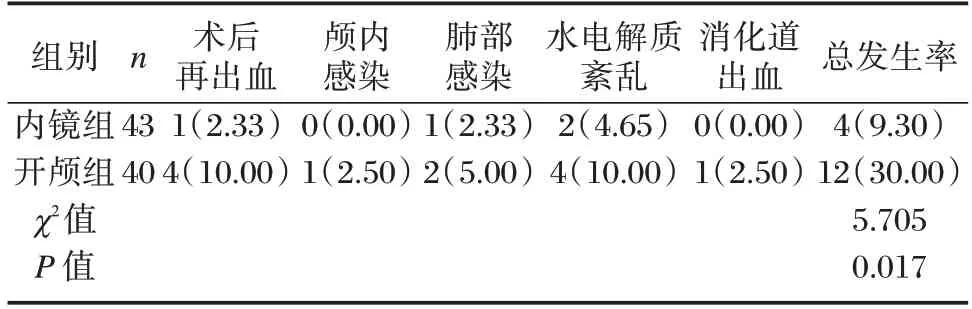
表5 两组术后并发症对比[n(%)]Table 5 Comparison of postoperative complications between two groups[n(%)]
3 讨论
基底节区HICH 为临床常见的HICH 类型,尤其以壳核最为多发,由于其部位特殊,患者发病后可瞬间破坏皮质脊髓束,导致患者产生肢体功能障碍,出现典型的“三偏”综合征表现[8]。为减轻或阻止脑组织损伤导致的继发性损害,应早清除血肿,打破血肿占位效应。
既往临床针对基底节区HICH 多采用开颅血肿清除术,其中小骨窗开颅血肿清除术创伤较小、操作简便,是众多血肿部位相对较浅患者的首选。导航辅助神经内镜硬通道微创手术是近几年新兴的HICH 手术治疗方法,其利用导航系统辅助定位穿刺血肿,辅助内镜手术,不仅定位准确、微创,而且能在保证血肿清除的同时保护正常的脑组织功能[9]。本研究显示,与开颅组相比,内镜组手术时间虽较长,但出血量更少,血肿清除率更高,ICU 入住时间更短。姚瀚勋等[10]对82 例基底节区HICH 患者资料进行分析,发现相比小骨窗开颅血肿清除术,导航辅助神经内镜硬通道技术可减少术中出血量,提高血肿清除率,本研究结果与之相似。造成内镜组和开颅组结果差异的原因可能是:开颅手术一旦定位、穿刺不准,不仅会导致血肿清除不干净,还可能会损坏正常脑组织,延长患者的IUC 入住时间,另外,开颅手术无法显露深部的血肿,也可能会一定程度影响血肿清除率。而内镜组利用手术导航系统将患者术前的影像学资料进行整合重建,可在术中实时为手术医师指引方向,以创伤最小的方式清除深部血肿。
研究发现,HICH 可引起脑组织血肿和代谢紊乱,患者可伴随不同程度的脑神经功能损伤[11]。NSE 是神经损伤的敏感指标,过去常被用于预测重症颅脑损伤患者病情进展和预后。PA 参与机体应激反应、免疫调节和神经元修复等过程,有关其与脑血管疾病的研究结果表明,低血清PA 水平患者往往预后欠佳[12]。HICH 患者,其脑神经元在出血时发生变性坏死,血⁃脑屏障通透性增加,导致大量NSE 释放进入血液及脑脊液中,使血清NSE表达升高;同时,脑出血后释放的大量炎性因子可加重周围组织的炎症反应,使血清PA 表达降低[13⁃14]。本研究中,相比开颅组,内镜组患者神经功能、机体炎症反应的改善作用更明显,这可能与神经内镜下血肿清除术能有效清除血肿,以及与导航辅助神经内镜硬通道微创手术定位准确且微创有关。另外,本研究发现,内镜组术后并发症总发生率明显低于开颅组,可见导航辅助神经内镜硬通道微创手术治疗基底节区HICH 相对更安全。综上,导航辅助神经内镜硬通道微创血肿清除术治疗基底节区HICH 疗效显著,不仅能提高手术效率,促进患者术后神经功能恢复,还能减少术后并发症发生,对改善患者预后有积极作用,值得临床优先选择。由于本研究为单中心回顾性研究,样本量较少,且缺乏术后长期随访资料,可能导致所得结论与临床实际存在偏倚,需今后进一步进行多中心、大样本研究验证。

