创伤弧菌核酸检测试剂国家参考品的建立
赵兰青 刘红 邓明镜 麻婷婷 许四宏★
创伤弧菌是一种嗜盐的革兰氏阴性菌,属于弧菌属、弧菌科,是人类三大致病弧菌之一[1],于1964 年由美国疾病控制和预防中心首次分离并在1979 年正式命名[2]。创伤弧菌是全球沿海海洋环境中自然菌群的一部分,常寄生在各种海鲜上,广泛存在于温暖的海水及河口环境中,通过食用污染水产品和皮肤伤口传播致病。感染创伤弧菌可导致严重的、致命的感染,如胃肠炎,皮肤和软组织感染,以及原发性败血症,后者可能发展为坏死性筋膜炎或导致死亡[3⁃5]。
创伤弧菌的检测方法主要有传统的形态学方法、免疫学方法和基因检测方法。传统的形态学方法及免疫学方法存在灵敏度低、不能定量检测等问题;而基因检测方法速度更快,特异性和敏感度更高[6]。国内已有数家科研用途的荧光PCR 法试剂盒,但评价标准不同,给诊断及溯源带来了困难。为规范和提高试剂盒的质量,本研究收集培养不同型别的创伤弧菌及对照弧菌,经过筛选、复核、确认和协作标定等,建立了创伤弧菌核酸检测试剂国家参考品,协助企业进行质量控制及评价,提供了统一评价尺度,对试剂盒注册和上市后监管提供科学有力的保证。
1 材料和方法
1.1 实验材料
1.1.1 参考品原料
主要原材料包含10 份不同的创伤弧菌毒株、10 份不同的其他弧菌毒株(3 份霍乱弧菌、2 份拟态弧菌、2 份溶藻弧菌、1 份副溶血弧菌、1 份河流弧菌和1 份弗尼斯弧菌)由中国疾病预防控制中心传染病所提供,从我国浙江的海水和上海的河水中分离培养,所有病毒株均经56℃水浴温育30 min 灭活,在-70℃及以下保存。
1.1.2 试剂
检测试剂使用广州达安基因股份有限公司、江苏硕世生物科技股份有限公司、苏州天隆生物科技有限公司和北京金豪制药股份有限公司的实时荧光PCR 法的创伤弧菌核酸检测试剂盒。
1.2 实验方法
1.2.1 原料的筛选及参考盘制备
将-80℃甘油保存管中的候选菌株取出后放置37℃水浴中快速复苏1.5 min,然后划线至普通琼脂培养基平板,36℃培养18 h,在平板上挑单菌落至Luria⁃Bertani 培养基增菌液中增菌,36℃培养24 h 后取部分菌液分装成若干小支用于鉴定,剩余菌液封装保存。使用三轮实验对候选菌液原料进行鉴定,第一轮使用菌落鉴定法将菌液划线至弧菌显色培养基进行初筛;第二轮使用16S rRNA测序方法(B:正向引物5′ ⁃ GCCTACGGGC⁃CAAAGAGG ⁃3′,反向引物5′⁃CCTGCGTCTCC⁃GCTGGCT⁃3′,A:正向引物5′⁃CATGATAGCTTC⁃GGCTCAA⁃3′,反向引物5′⁃CACTACCACCTT CCTCACGAC⁃3′)进行复核;第三轮实验使用江苏硕世生物科技股份有限公司的创伤弧菌核酸检测试剂盒确认,并按照说明书规定的方法进行阴阳性判定。完成三轮实验后,随机抽取部分共同阳性样本、共同阴性样本送至广州微远基因科技有限公司进行高通量测序分析。
候选菌落浓度测定使用麦氏浊度分析法进行初测,然后取无菌生理盐水对其10 倍系列稀释至平板计数琼脂培养,36℃培养48 h,然后观察并记录各平板菌落数量,选择30~300 CFU 的平板根据其对应稀释倍数计算菌落总数。
将三轮实验共同阳性、共同阴性的原料作为参考品的组盘样本,取其对应的封装菌液在56℃水浴温育30 min 灭活,混匀后分装成0.5 mL/支并贴签,组成参考盘。
1.2.2 协作标定
将参考盘以发盲样的形式送至广州达安基因股份有限公司、江苏硕世生物科技股份有限公司、苏州天隆生物科技有限公司和北京金豪制药股份有限公司4 家企业,使用各自的试剂盒进行检测并按照产品说明书判定阴阳性;汇总结果确定样本选择的科学性,并设立参考品的考核指标。
1.2.3 均匀性研究
参照国家计量技术规范中有关均匀性检验的要求,随机抽取5 支重复性参考品R,待其完全融化后,使用无DNA 酶的去离子水分别进行1∶10 和1∶100稀释,每份稀释后样本进行核酸提取后使用江苏硕世生物科技股份有限公司的试剂盒平行检测3次,计算组内和组间的变异系数CV。根据试剂盒说明书,Ct ≤40 判定为阳性,Ct>40 或无Ct 值判定为阴性。
1.2.4 稳定性研究
使用江苏硕世生物科技股份有限公司的试剂盒进行该参考品的稳定性分析,随机抽取6 支最低检出限参考品L 并分成2 组,将每组3 支参考品合并至1 个冻存管内。将2 管分别放置于2~8℃冰箱和室温7 d,并在1 d、3 d、5 d 和7 d 取出,使用无DNA/RNA 酶的去离子水10 倍系列稀释至10~1×107CFU/mL 进行核酸提取并检测,并与0 d 的检测结果对比。另随机抽取2 套完整参考品,分别于2~8℃冰箱和室温放置7 d 进行全部性能测试,并与0 d 对比,实验数据使用GraphPad Prism 6.0 统计结果并进行t检验分析。
2 结果
2.1 样本初筛、复核及确认
20 份样本经过初筛、复核和确认三轮实验后,确定8 份创伤弧菌原料和10 份其他弧菌毒株作为组盘样本。见表1。高通量测序结果显示,S53、S59 均鉴定为创伤弧菌,S04、S32、S47 和S43 分别为霍乱弧菌、溶藻弧菌、河流弧菌和弗尼斯弧菌。见图1。
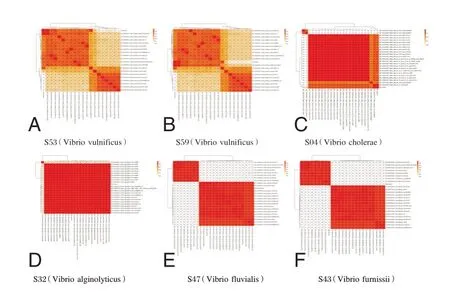
图1 创伤弧菌及对照菌株的序列聚类和ANI 值热图Figure 1 Sequence clustering and ANI heat maps of Vibrio vulnificus and control Vibrio strains
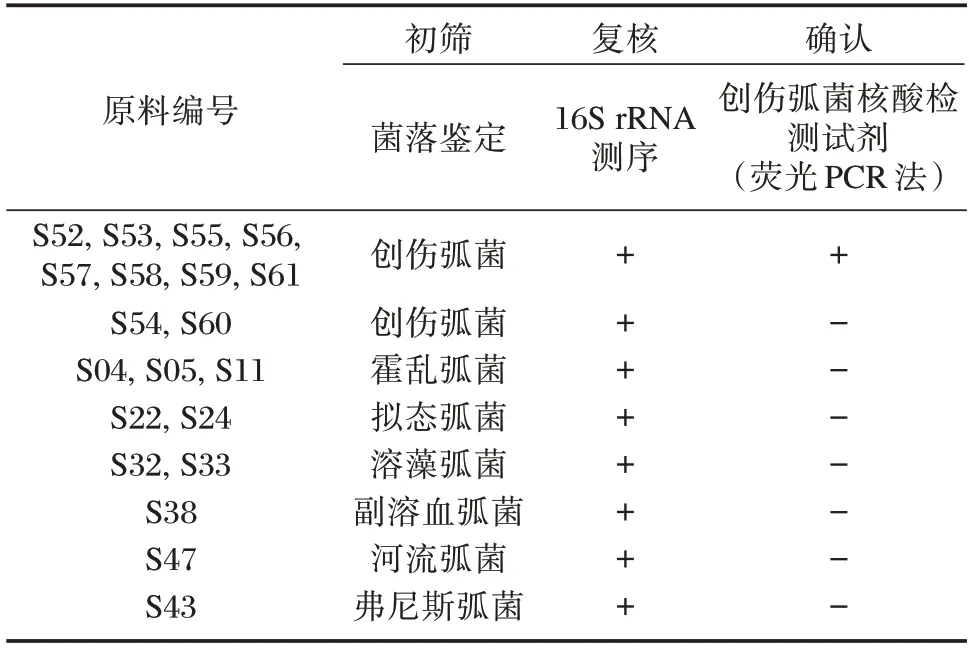
表1 20 份候选原料菌株的初筛、复核及确认Table 1 Screening,rechecking and verification of 20 candidate strains
将18 份原料混匀后分装、贴签并组套成盘,创伤弧菌核酸检测试剂国家参考盘由8 份阳性参考品P1~P8、10 份阴性参考品N1~N10、1 份重复性参考品R 和1 份最低检出限参考品L 组成,L 使用菌落计数法测定浓度为1×108CFU/mL。
2.2 协作标定及考核指标
4 家实验室协作标定的结果如下:阳性符合率(+/+)均为8/8,阴性符合率(-/-)均为10/10;最低检出限指标,厂家C 为1×103CFU/mL 及以上阳性,其余3 家均为1×102CFU/mL 及以上阳性。重复性指标,变异系数CV 均在5%以内。见表2。
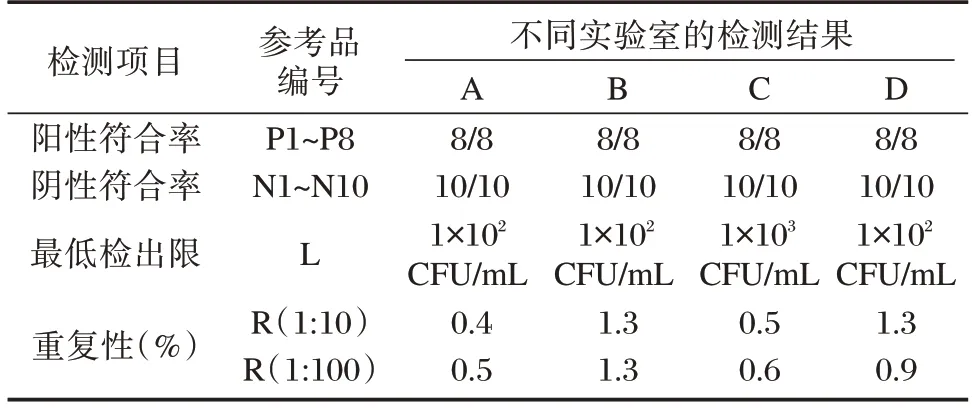
表2 4 家实验室协作标定结果Table 2 Collaborative test results of 4 laboratories
根据不同实验室的标定结果,制定参考盘的考核标准如下:检测阳性参考品P1~P8,应均为创伤弧菌阳性(8/8);检测阴性参考品N1~N10,应均为创伤弧菌阴性(10/10);检出限应至少为1×103CFU/mL 及以上阳性;重复性应为检测10 次均为阳性,且CV 不大于5.0%。
2.3 均匀性
均匀性检测结果均为阳性。见图2。参考品R 进行1∶10 和1∶100 稀释后,检测15 次Ct 值的CV 分别为1.9%和1.7%。
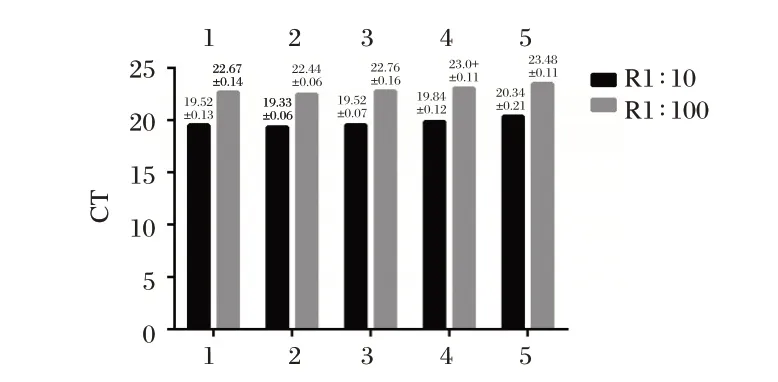
图2 5 支重复性参考品稀释1∶10 和1∶100 检测结果Figure 2 Test results by dilution of 1∶10 and 1∶100 of 5 repetitive references
2.4 稳定性
最低检出限参考品L 稀释后在2~8℃及室温放置1 d、3 d、5 d、7 d 检测结果均为阳性。见图3。经t检验分析,Ct 值与0 d 相比差异无统计学意义(P>0.05);10 CFU/mL 浓度检测均为阴性。放置于2~8℃冰箱和室温的整套国家盘,阴性参考品N1~N10和10 CFU/mL浓度的L检测均为阴性,与0 d结果相同;阳性参考品P1~P8、重复性参考品R 和1×102CFU/mL~1×107CFU/mL 浓度的L 检测均为阳性,且Ct值与0 d相比差异无统计学意义(P>0.05)。
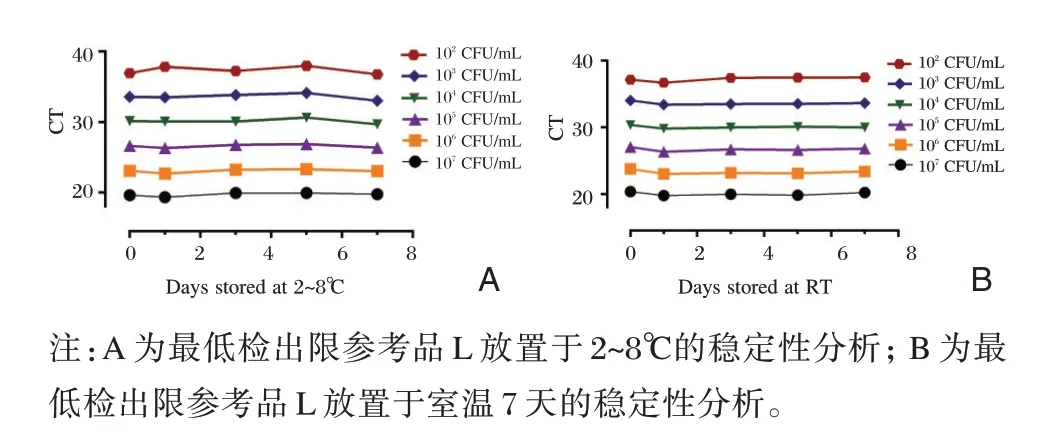
图3 最低检出限参考品L 放置于2~8℃和室温7 天的稳定性分析Figure 3 Stability analysis of the limited reference L at 2~8℃and room temperature for 7 days
3 讨论
创伤弧菌引起的感染具有高度的侵袭性,是一种死亡率很高的机会性致病菌,导致的败血症死亡率超过50%[7⁃8]。创伤弧菌可致使多种经济鱼类患病,如罗非鱼、石斑鱼和草鱼等,也会污染贝类、甲壳类等多种动物,给我国的水产养殖业带来不小的经济损失[9]。由于全球气候变暖导致的海洋温度上升,创伤弧菌的流行区域进一步扩大趋势,在广东、广西、浙江等地区贝类海产品检出率达22%~53%[10⁃12],在山东、北京等地区水产品中检出率为3%~5%[13⁃14],在成都地区水产品中检出率也有24%[15]。
近年来,PCR 方法及衍生技术在创伤弧菌核酸检测领域不断得到运用和发展,包括实时荧光PCR、多重PCR、环介导恒温扩增技术(loop⁃medi⁃ated isothermal amplification,LAMP)、重组聚合酶扩增技术(Recombinase Polymerase Amplification,PRA)以及定量目的的数字PCR 技术等[16]。检测创伤弧菌的靶基因以vvhA、Cytolysin和met等较为常见,而与菌株分型鉴定相关的基因有毒力基因(vcgC、vcgE)、16S rRNA基因(16S rRNA,B)、生物Ⅱ型基因(Bt2)和血清E 型基因(SerE)。采用PCR技术快速、灵敏地检测创伤弧菌的感染并分型鉴定,对于在创伤弧菌流行期及早发现诊断感染病例及临床感染后即时实施预防和控制措施具有重要的意义。本研究旨在为创伤弧菌的核酸检测建立统一标准和评价尺度,使用原料为我国浙江地区海水、上海地区河水中分离培养的多株创伤弧菌及对照菌株,具有良好的代表性和溯源性。通过原料初筛、复核和确认,建立了创伤弧菌核酸检测试剂国家参考品,含8 份不同的创伤弧菌菌株,及霍乱弧菌、拟态弧菌、副溶血弧菌等6 种常见的对照弧菌。随后邀请4 家实验室协作标定,制定了阳性符合率、阴性符合率、最低检出限和重复性4 项考核标准,并进行均匀性和稳定性研究,证明参考品质量符合相应规定。本参考品的不足之处是未能使用数字PCR 方法进行拷贝数定量,在检出限参考品计数时存在一定的人为误差。此外,稳定性研究仅做了短期稳定性,在后续的研究中会进行运输稳定性、长期稳定性评估。
本研究通过建立创伤弧菌核酸检测试剂国家参考品,为该类产品提供了统一标准和评价尺度,填补了该类产品在国内医疗器械监管中的空白,为创伤弧菌核酸检测建立科学、规范的质量评价方法,保证不同检测试剂的溯源和结果的可比性,有助于国内相关企业进行研发和生产,同时也为临床诊断提供了坚实有力的质量保证。

