克罗恩病患者第三腰椎骨骼肌指数在营养评估中的价值
金怡丹 吴静 郑思思 范一宏
克罗恩病(Crohndisease,CD)属于炎症性肠病(inflammatoryboweldisease,IBD),是一类由遗传因素、环境因素和肠道微生物之间共同作用而导致的慢性炎性疾病,其主要症状为反复发作的腹痛、腹泻和体质量下降[1]。研究结果表明,IBD 患者经常出现营养不良[2],不仅对疾病缓解有较大影响,且降低患者的生活质量,是IBD 患者临床预后不良的重要因素[3]。由于CD 累及消化道范围更广,因此,除常规对CD 患者进行营养风险筛查外,应同时对CD 患者的营养状况进行系统性分析。近年来,以肌量和肌肉功能评定[4]来评估患各种慢性疾病、肿瘤等患者的营养状况越来越受到关注。评估患者骨骼肌量的方法一般采用CT 或MRI 扫描[5],选择第三腰椎(L3)水平肌肉面积总和,计算出对应的骨骼肌指数(skeletalmuscleindex,SMI)。本研究探讨CD 患者L3-SMI与临床指标和营养状况的相关性。
1 资料与方法
1.1 临床资料 选取2018 年6 月至2022 年10 月本院CD 患者156 例,纳入标准:①符合2018 年《炎症性肠病诊断与治疗的共识意见》关于CD 的诊断标准[6];②年龄≥18 周岁,男女不限;③住院期间有腹部 CT、小肠CT 等影像学检查结果(需扫描到患者L3 完整水平面)。排除标准:①存在严重心脑、肝肾等器官的严重病变,合并有甲亢、代谢综合征、糖尿病等代谢疾病和其他恶性肿瘤等消耗性疾病;②临床资料或实验室检查数据缺失的患者。
1.2 方法(1)收集资料:包括性别、年龄、身高、体质量、BMI;实验室结果,包括血常规、超敏C 反应蛋白、总蛋白、白蛋白、25-羟基维生素D、粪钙卫蛋白、红细胞沉降率等;营养风险筛查表NRS2002 评分;L3-SMI。(2)营养评估:①骨骼肌指数:选择CD 患者腰椎CT,由同一位影像科高年资主治医师采用3DSlicer软件评估其对应的L3 骨骼肌总面积(cm2),再除以身高的平方(m2)得到L3-SMI。②体质量指数(BMI):18.5~24.0 kg/m2为正常,17.0~<18.5 kg/m2轻度营养不良,16.0~<17.0 kg/m2中度营养不良,<16.0 kg/m2重度不良。③营养风险筛查NRS2002,当评分≥3 分提示存在营养风险,该量表主要由同一位营养科医师进行评估并打分。将所有CD 患者按中位数分为高L3-SMI 和低L3-SMI 组,比较高低两组患者各指标的差异。
1.3 统计学方法 采用SPSS 25.0 统计学软件。符合正态分布计量资料以()表示,采用t检验;偏态分布计量资料用M(Q1,Q3)表示,用Mann-WhitneyU检验;计数资料以n(%)表示,用χ2检验。采用Spearman法进行相关性分析。绘制受试者工作特征(ROC)曲线,计算曲线下面积、灵敏度、特异度、约登指数。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 156 例住院患者中男102 例,女54 例,其中低L3-SMI 组78 例,男58 例,女20 例;BMI:17.06(15.42,17.83)kg/m2,高L3-SMI 组78 例,男44 例,女34 例;BMI 22.88(19.95,24.60)kg/m2。CD患者中存在营养风险NRS2002 ≥3 分有124 例,<3 分32 例,其中低L3-SMI 中存在营养风险的74 例,高L3-SMI 存在营养风险50 例。
2.2 两组基本临床资料比较 低L3-SMI 组年龄、身高、NRS2002 ≥3 分、血小板计数、红细胞沉降率、超敏C 反应蛋白、粪钙卫蛋白明显高于高L3-SMI 组,低L3-SMI 组BMI、25-羟基维生素D、总蛋白、白蛋白、血红蛋白、淋巴细胞计数明显低于高L3-SMI 组,差异有统计学意义(P<0.01 或P<0.05)。见表1。
2.3 相关性分析 L3-SMI 与BMI(r=0.996)、血红蛋白(r=0.552)、淋巴细胞绝对数(r=0.244)、白蛋白(r=0.999)、25-羟基维生素D(r=0.978)呈正相关;与NRS2002 ≥3 分(r=-0.387)、血小板计数(r=-0.271)、红细胞沉降率(r=-0.988)、超敏C 反应蛋白(r=-0.984)、粪钙卫蛋白(r=-0.906)呈负相关。见表2。

表2 Spearman相关分析
2.4 L3-SMI 预测营养风险的ROC 曲线将NRS2002≥3分和NRS2002<3分作为状态变量,L3-SMI作为检验变量绘制ROC 曲线,得出曲线下面积为0.777(95%CI:0.699~0.854),约登指数最大为0.527。以此诊断的营养风险的灵敏度为93.8%,特异度为58.9%。
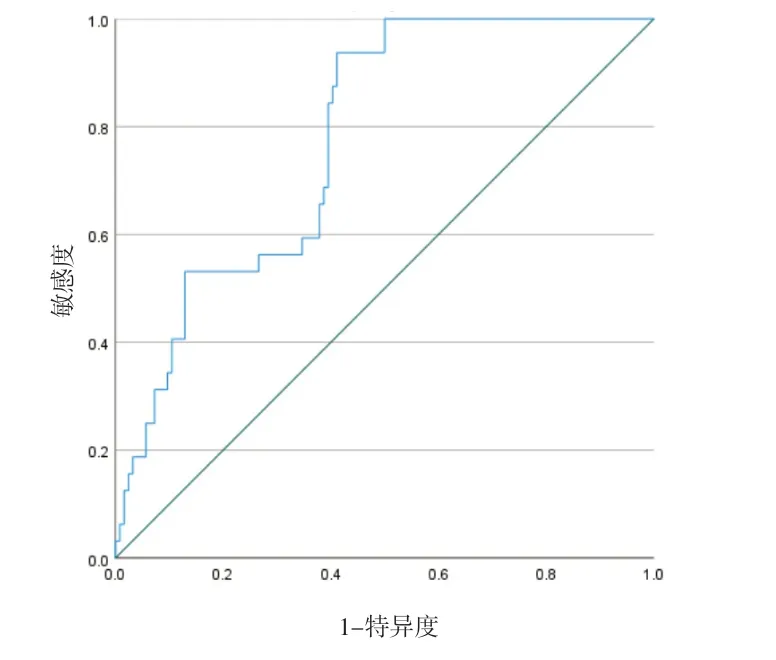
图1 L3-SMI预测营养风险的ROC曲线
3 讨论
近年来随着环境、饮食的变化、医学的进步,我国IBD 患病率及检出率呈上升趋势,IBD 已经逐渐成为消化科的常见病[7]。由于IBD 病变在消化道,可导致各种营养物质的消化吸收发生改变,合并感染、手术、药物等其他因素,营养不良已成为IBD 常见的并发症之一。IBD 患者营养不良的患病率在20%~85%[8],而CD 作为IBD 的主要类型之一,其病变范围更广、症状更重,营养不良问题也更为突出。多数情况下,临床工作中常用NRS2002 评分对CD 患者进行营养风险筛查,用BMI、白蛋白等评估CD 患者的营养状况,优点是直观方便,缺点是与部分患者的实际营养状况存在出入。
本研究结果显示,NRS2002 ≥3 分存在营养风险124 例,<3 分32 例。低L3-SMI 组CD 患者营养风险发生率(94.9%)明显高于高L3-SMI 组(64.1%),这些低L3-SMI 的患者更多是CDAI 评分为中或重度活动期的CD 患者。在低L3-SMI 组中,NRS2002 ≥3 分比例为94.9%,表明仍有5.1%的患者未被筛出营养风险,可能原因:①患者实际存在营养风险,但其BMI ≥18.5 kg/m2、近3 个月体质量几乎未改变、近1周摄食未减少、也未严重到接受ICU 治疗,因此无法进行NRS2002 评分,或者部分患者,即便进入了NRS2002的全面评估,因其主观上体质量丢失不明显,或者疾病评分未达到量表中疾病的严重程度未被筛出;②患者未患病时的基础L3-SMI 较正常人低,其临床表现和实验室指标均不提示营养不良。鉴于以上情况,绘制L3-SMI 预测营养风险的ROC 曲线,发现以L3-SMI 诊断营养风险的灵敏度为93.8%,特异度为58.9%。即当CD 患者存在低L3-SMI 时,其有营养风险的可能性就大,L3-SMI 适合作为营养不良的参考指标;而当高L3-SMI 时,需要进一步了解患者未患病时的基础肌肉情况以及患病的时间等。
也有研究表明,约有65.5%的白蛋白正常患者存在肌肉质量减少,存在营养风险[9],且白蛋白半衰期较长,但受多种因素影响,其作为疾病急性期机体营养状况的评价指标不够敏感。有报道表明血红蛋白、白蛋白、BMI 等营养指标及血小板计数、超敏C 反应蛋白、红细胞沉降率等指标在CD 患者与正常人中存在差异[10],将L3-SMI 与这些指标进行相关性分析,发现其与BMI、25-羟基维生素D、白蛋白、血红蛋白、淋巴细胞绝对数呈正相关,L3-SMI 与NRS2002 评分≥3分、血小板计数、红细胞沉降率、超敏超敏C 反应蛋白、粪钙卫蛋白呈负相关。表明L3-SMI 与现有的体现CD 患者营养状况和病情严重程度的指标有一定联系,可作为CD 患者营养不良的评估方法,且有较好的应用前景。
有研究显示,IBD 患者入院时低L3-SMI 与延长住院时间(LOS)有关,L3-SMI 高低与其是否后期进行肠切除术相关[11]。一项关于L3-SMI 与CD 术后并发症的报道显示,低L3-SMI 是CD 术后发生并发症的独立危险因素,应用L3-SMI 可有效提高CD 患者术后发生并发症的预测效能[12]。关于L3-SMI 的标准:国外以男性L3-SMI ≤52.4 cm2/m2,女性L3-SMI ≤38.5 cm2/m2,作为肌肉减少症的诊断标准[13]。国内对于L3-SMI 的研究较少,有研究表明中国北方健康成年人的L3-SMI 标准为男性37.9~40.2 cm2/m2,女性28.6~31.6 cm2/m2[14]。本研究测量的L3-SMI 普遍偏高,高L3-SMI 组为99.07 cm2/m2,低L3-SMI 组为86.18 cm2/m2,但该结果尚需进一步大规模的临床研究验证。
综上所述,L3-SMI 与以往评估CD 患者营养状况的实验室指标具有相关性,可以反映CD 患者的营养状况,对CD 患者的营养状况评估有一定的价值,对于NRS2002、BMI 以及白蛋白水平等评估营养正常的患者,可以进行L3-SMI 计算,及时发现和改善CD 患者的营养不良。

