LRP1在消化系统恶性肿瘤侵袭和预后中的调节作用
朱萌瑛 沈浩 汪碧丽 何蓥飞 陈瑾 任军 章浙忠 许健
消化系统恶性肿瘤是常见的恶性肿瘤之一,包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌[1]。消化系统癌症占全球癌症发病率的26%,占所有癌症相关死亡的35%[2]。因此,探寻能够调控消化系统恶性肿瘤进展和预后的生物标志物是临床提高治疗效果的关键。目前,手术切除是消化系统恶性肿瘤早期治疗的主要方法[3]。低密度脂蛋白受体相关蛋白1(Low-density lipoprotein receptor-related Protein-1,LRP1)作为膜上的内吞受体,在肿瘤侵袭中起重要作用[4],有研究证明,LRP1 高表达可能促进肿瘤细胞的生长[5-8]。而表皮生长因子受体(epidermal growth factor receptor,EGFR)则与多种肿瘤的发生发展有关,激活的Akt 则促进肿瘤细胞的增殖和侵袭能力。本研究探讨LRP1 敲低对消化系统恶性肿瘤细胞增殖、迁移和侵袭的影响。
1 材料与方法
1.1 生物信息学分析 从GTEx 数据库下载正常胃、胰腺和肝脏的RNA-seq 数据,从TCGA 的Xena 门户网站下载胃、胰腺和肝脏肿瘤的RNA-seq 数据。采用R(3.6.3 版)软件中ggplot2(3.3.3 版)、survival(3.2.10版)、survminer(0.4.9 版)和pROC(1.17.0.1 版)软件包进行分析。
1.2 细胞系和细胞培养 HGC-27 细胞、HepG2 细胞、BxPC-3 细胞、PANC-1 细胞、CaCO2细胞、HUVEC 细胞来源于中国科学院细胞库(上海)。细胞在添加了10%胎牛血清(FBS,Hyclone,Thermo Fisher Scientific,Inc,UT,USA)的Dulbecco 改良Eagle 培养基(DMEM,Gibco,Grand Island,NY,USA)或RPMI-1640(Gibco,Grand Island,NY,USA)中培养。所有细胞系在37℃5% CO2培养。
1.3 蛋白免疫印迹分析 采用一抗LRP1(1 ∶10,000,Abcam)、ERK1/2(1 ∶10,000,Abcam)、phospho-ERK1/2(1 ∶10,000,Abcam)、AKT(1 ∶10,000,Abcam)、phospho-AKT(1 ∶10,000,Abcam)、EFGR(1 ∶10,000,Abcam)、MMP2(1 ∶10,000,Abcam)、MMP9(1 ∶10,000,Abcam)、GAPDH(1 ∶10,000,Abcam)、PI3K(1 ∶5,000,Abcam)、P-PI3K(1 ∶10,000,Abcam)进行Western blot 检测。采用辣根过氧化物酶(HRP)标记的抗小鼠免疫球蛋白G(IgG)或抗兔IgG抗体作为二抗(1:500,Multi Sciences Biotech Co.Ltd),采用化学发光(ECL)蛋白印迹法(western blot)底物(Multi Sciences Biotech Co.Ltd)进行检测。
1.4 细胞毒性和增殖实验 采用Alexa Fluor 594(碧云天,Cat.594)试剂盒进行EdU-594 染色(碧云天,Cat.No:C0078S)。在荧光显微镜(IX71,Olympus Corporation)下观察结果,比较LRP1 敲低前后细胞增殖的变化。
1.5 克隆形成实验 克隆形成实验中,选择LV-LRP1-RNAi 和LV-siNC 感染的细胞,以每孔1,000 个细胞的密度转移至6 孔板。将shNC 和shLRP1 慢病毒接种于6孔板,培养15 d。菌落用戊二醛(6.0% v/v)固定,结晶紫(0.5% w/v)染色后观察并拍照。
1.6 Transwell 实验和划痕实验 采用Matrigel 基质胶进行Transwell 实验,并按照Transwell 试剂盒(Corning,NY,USA)的说明书进行。将细胞重悬于含BSA 的无血清培养基中,Transwell 上室中心加入200 μL(5,000个细胞),下室加入含20% FBS 的培养基500 μL,置于37 ℃,5% CO2的细胞培养箱中12~48 h。将Transwell板培养液弃去,用4%多聚甲醛固定15 min,最后加入1 mL 结晶紫染色10 min,显微镜下观察结果。在划痕实验中,细胞在6 孔板中培养至融合(80%),然后用微管尖端划痕。更换1 次/12 h,含10% FBS 的新鲜无血清培养基。于0 h、48 h 用显微镜连续监测划痕愈合面积。
1.7 HE 染色和免疫组织化学分析 石蜡切片来自浙江大学医学院附属第二医院。免疫组化分析按照厂家提供的Histostain-SP 试剂盒方案进行(SP-0023,Bioss,北京,中国)。采用以下一抗进行免疫组化:抗LRP1 抗体(1 ∶100,Abcam)。采用辣根过氧化物酶标记的山羊抗小鼠二抗作为二抗(1 ∶100 dilution,Multi Sciences Biotech,杭州,中国),结果在Olympus BX41 显微镜下观察。
1.8 慢病毒转染敲降LRP1 重组慢病毒LV-LRP1-RNAi(60326-2)和阴性对照病毒LV-CON077 购于吉凯基因(GENE,上海,中国)。慢病毒敲降BxPC-3、HepG2 和HGC-27 细胞中的LRP1 基因按照吉凯基因公司提供的重组慢病毒载体使用手册进行。细胞与慢病毒孵育24 h,经嘌呤霉素(ST551-10,Beyotime,中国)筛选后进行Western blot 检测验证敲降水平。
2 结果
2.1 LRP1 在消化系统恶性肿瘤的表达及预后分析 对LRP1 进行泛癌分析(见图1A),结果显示LRP1在胃腺癌(STAD)和胰腺癌(PAAD)中高表达(见图1B)。Cox 回归分析显示,在STAD 中LRP1 高表达提示患者预后不良,P<0.01(见图1C)。在预测肿瘤结局方面,LRP1 在PAAD 中具有更高的准确性(AUC:0.964,95%CI:0.942~0.986)(见图1D)。
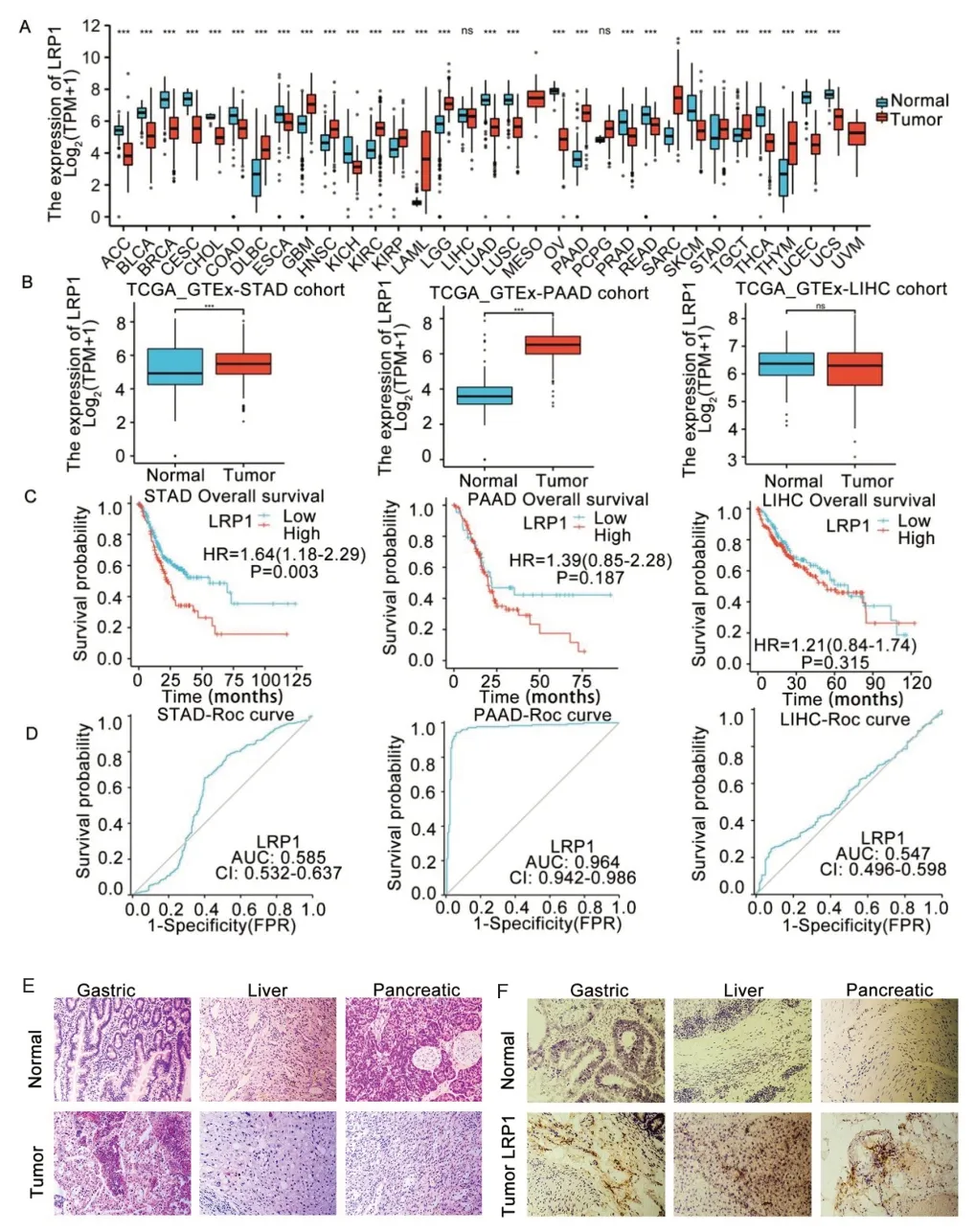
图1 生物信息学分析。A.各种癌症和正常标本中LRP1表达谱的条形图。B.TCGA和GTEx数据库中胃、胰腺、肝脏肿瘤组织和正常组织中LRP1的表达水平。C.LRP1与STAD、PAAD和LIHC预后的相关性。D.LRP1在STAD、PAAD和LIHC中的ROC曲线。E.HE染色(×200)的胃癌组织、肝癌组织、胰腺癌组织。F.应用LRP1抗体对胃癌组织、肝癌组织和胰腺癌组织进行免疫化学染色,棕色为LRP1蛋白
2.2 LRP1 在消化系统恶性肿瘤中高表达 在组织水平对LRP1 在肿瘤组织高表达进行初步验证,与正常胃肠道组织相比,LRP1 在胃癌、肝癌、胰腺癌组织中表达上调(见图1E-F)。
2.3 LRP1 在HGC-27、HepG2 和BxPC-3 细胞中高表达 选用5 株消化系统恶性肿瘤细胞系(CaCO2、BxPC-3、Panc-1、HGC-27、HepG2)并以人脐静脉内皮细胞HUVEC 为对照,通过Western blot 实验检测LRP1 在不同消化系统恶性肿瘤细胞中的表达,结果显示,与HUVEC 细胞相比,LRP1 在胃癌HGC-27 细胞、肝癌HepG2 细胞和胰腺癌BxPC-3 细胞中的表达明显升高。通过Image J 和SPSS 19.0 软件分析,BxPC-3 细胞与HUVEC 细胞相比差异有统计学意义(P<0.05),HGC-27 细胞和HepG2 细胞与HUVEC 细胞相比差异有统计学意义(P<0.001)(见图2A-B)。通过LV-LRP1-RNAi技术在HGC-27 细胞、HepG2 细胞和BxPC-3 细胞中敲低LRP1,shNC 作为对照,Western blot 结果显示,与shNC 细胞相比,shLRP1 细胞中的LRP1 表达水平降低(见图2C-D)。
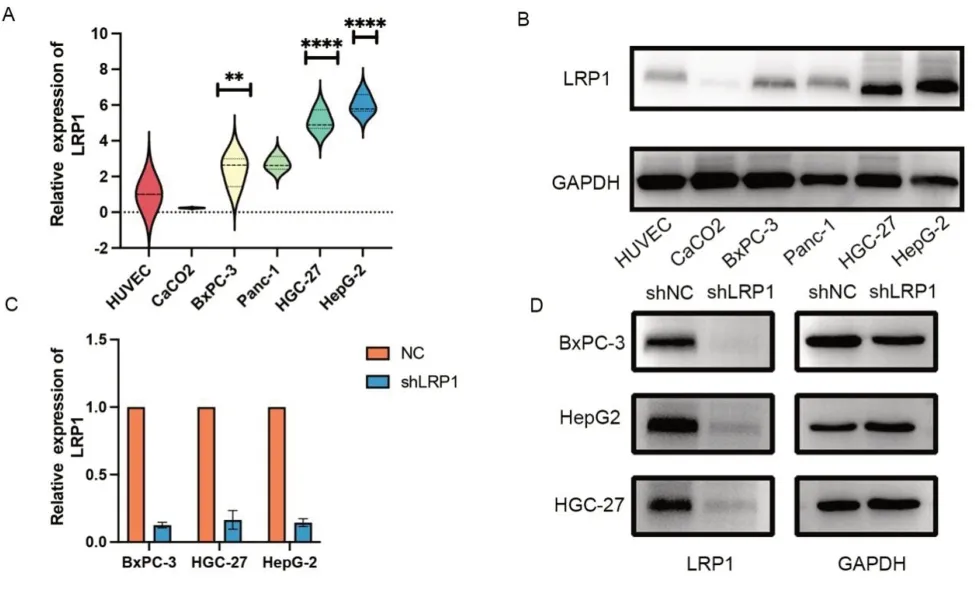
图2 LRP1在BxPC-3、HepG2和HGC-27细胞中高表达。A-B.Western blot检测HUVEC、CaCO2、BxPC-3、PANC-1、HGC-27和HepG2细胞中LRP1蛋白与对照GAPDH的表达量,LRP1蛋白相对表达量的统计图。*P<0.05,**P<0.01,****P<0.0001。C-D.Western blot检测慢病毒转染前后HGC-27、HepG2和BxPC-3细胞中LRP1蛋白的表达量
2.4 降低LRP1 表达可抑制消化系统恶性肿瘤细胞的增殖 通过克隆形成实验和Edu 细胞增殖实验研究LRP1 敲降后对消化系统恶性肿瘤BxPC-3 细胞、HepG2细胞和HGC-27 细胞增殖的影响。克隆形成实验结果显示,与shNC 组相比,LRP1 敲低有效抑制三株消化系统恶性肿瘤细胞的生长和增殖(见图3A-B)。在Edu-594 细胞增殖实验中,三株敲低了LRP1 的肿瘤细胞增殖明显抑制(见图3C)。Western Blot 实验结果显示,HGC-27 细胞、HepG2 细胞和BxPC-3 细胞中P-AKT、P-PI3K、EGFR 蛋白表达受到抑制(见图3D-E)。
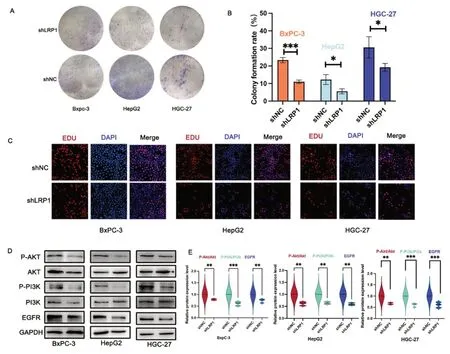
图3 降低LRP1表达可抑制消化系统恶性肿瘤细胞的增殖。A-B.慢病毒转染BxPC-3细胞、HepG2细胞和HGC-27细胞前后克隆形成实验结果及统计图。C.EdU-594细胞增殖实验结果。图中荧光显微镜的放大倍数为200倍。D-E.Western blot法检测慢病毒转染前后BxPC-3、HepG2和HGC-27细胞中p-AKT、AKT、P-PI3K、PI3K和EGFR蛋白的表达及小提琴图。*P<0.05,**P<0.01,***P<0.001
2.5 降低LRP1 表达可抑制消化系统恶性肿瘤细胞的侵袭和迁移 划痕实验和Tanswell实验结果显示,LRP1敲低后BxPC-3 细胞、HepG2 细胞和HGC-27 细胞的侵袭和迁移能力下降。与shNC 组相比,敲低LRP1 后BxPC-3、HepG2 和HGC-27 细胞在48 h 后划痕面积愈合速度明显减慢(见图4A-B)。在Transwell 实验中,shLRP1 组的三株消化系统恶性肿瘤细胞的侵袭能力表现出显著降低(见图4C-D)。Western Blot 结果显示,LRP1 敲低后,BxPC-3 细胞、HepG2 细胞和HGC-27 细胞中P-ERK 和MMP-9 蛋白表达均显著下调。BxPC-3 细胞中ERK 和MMP-2 蛋白表达明显下降(见图4E)。
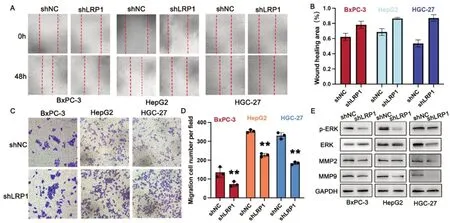
图4 降低LRP1表达可抑制消化系统恶性肿瘤细胞的侵袭和迁移。A-B.慢病毒转染前后BxPC-3细胞、HepG2细胞和HGC-27细胞划痕实验结果,显微镜放大倍数为100倍。C-D.慢病毒转染前后BxPC-3细胞、HepG2细胞和HGC-27细胞的Transwell结果,图中显微镜放大倍数为200倍。Transwell实验结果的直方图。**P<0.01
3 讨论
近年来,消化系统恶性肿瘤的发病率在全球呈上升趋势。消化系统恶性肿瘤的生存率与肿瘤发展阶段密切相关。在消化系统恶性肿瘤早期诊断并介入治疗,患者生存率和预后显著提高。然而,目前临床上对消化系统恶性肿瘤的诊断存在滞后性,这是由于消化系统恶性肿瘤缺乏早期症状导致早期诊断困难。CA199[9]、CA125[10]等是现有的诊断消化系统恶性肿瘤的标志物,但这些标志物与肿瘤转移、侵袭和预后的关系尚不明确。因此,寻找有效的治疗靶点和新的生物标志物显得尤为重要。基于生物信息学方法,消化系统恶性肿瘤中LRP1 高表达与不良预后相关。LRP1 在消化系统恶性肿瘤细胞株(BxPC-3、HepG2 和HGC-27 细胞)中高表达,下调LRP1 的表达改变消化系统恶性肿瘤细胞的生物学特性。EdU-594 细胞增殖实验结果显示,与对照组相比,敲低LRP1 后胃癌HGC-27 细胞、肝癌HepG2细胞和胰腺癌BxPC-3 细胞的增殖受到抑制。此外,敲低LRP1 后,细胞群体依赖性增加,抑制细胞克隆的形成。为进一步明确降低LRP1 表达抑制消化系统恶性肿瘤细胞生长的机制,采用Western blot 检测AKT、PI3K和EGFR 蛋白的表达。LRP1 的低表达抑制AKT 和PI3K的磷酸化和EGFR 蛋白的表达。AKT 是主要的生存信号转导蛋白,是EGFR 的下游靶点。基质金属蛋白酶(MMP2 和MMP9)被认为是与肿瘤侵袭和迁移相关的蛋白酶[11]。LRP1 介导的MMP 表达调控促进癌细胞的迁移和侵袭[12]。LRP1 作为MMP2 和MMP9 的内吞受体,从而调节肿瘤的侵袭和迁移。有研究发现,LRP1 能诱导MMP2 和MMP9 表达,从而促进人胶质母细胞瘤U87细胞迁移和侵袭。敲降LRP1 细胞中MMP2 和MMP9 的表达被选择性降低[13]。本研究中,敲降LRP1 后胃癌HGC-27 细胞、肝癌HepG2 细胞和胰腺癌BxPC-3 细胞中ERK、MMP2 和MMP9 的表达减少。Transwell 和划痕实验显示,与对照组相比,HGC-27 细胞、HepG2 细胞和BxPC-3 细胞的侵袭和迁移能力均降低。ERK 信号通路可向细胞核传递细胞外刺激,调控肿瘤的发生、增殖、凋亡和耐药[14-15]。
综上所述,LRP1 在BxPC-3、HGC-27、HepG2 细胞中高表达,LRP1 高表达与消化系统恶性肿瘤的不良预后相关,并促进消化系统恶性肿瘤细胞的增殖。敲低LRP1 表达可能干扰肿瘤细胞脂质代谢过程,导致EGFR、p-AKT 和p-ERK 蛋白降低,抑制膜分子MMP2和MMP9 蛋白表达,从而抑制消化系统恶性肿瘤的转移和侵袭。降低LRP1 表达可抑制消化系统恶性肿瘤细胞的增殖、侵袭和迁移,提示LRP1 可能成为治疗消化系统恶性肿瘤的新靶点。

