一株中华稻蝗内生真菌Fusarium lateritium ZMT01的代谢产物*
房豪东, 黄子辉, 李苏柠, 黎杨倩, 佘志刚, 熊亚红, 李春远
1.华南农业大学材料与能源学院 / 生物基材料与能源教育部重点实验室,广东 广州 510642
2.中山大学化学学院,广东 广州 510275
据估计,昆虫种类达3 000 多万种,昆虫共生菌种类更为丰富。昆虫共生菌生长环境复杂多样,已从其代谢产物中发现大量结构新颖的化合物,其中约50%具有显著的抗肿瘤、抗菌、除草和抗氧化等生物活性(徐晓等,2018)。镰刀属Fusariumsp.真菌在自然界分布广泛,其次生代谢产物种类丰富且生物活性多样(Li et al.,2020)。据统计,截至2022 年底,已在镰刀属真菌代谢产物中发现大约180 多种抗菌活性物质(Xu et al.,2023)。镰刀属真菌是昆虫共生菌(含内生菌)的常见类型(郑林宇等,2022),但有关昆虫共生(含内生)镰刀菌代谢产物的研究很少,有研究曾从一株中华螽斯肠道内生镰刀属真菌Fusarium proliferatumZS07代谢产物中得到了1个具有抗枯草芽孢杆菌活性的新聚酮类化合物O-methylated SMA93 和5 个已知物(Li et al.,2014);从一株中华稻蝗内生真菌砖红镰刀菌Fusarium lateritiumZMT01 发酵物内得到3 个具有抗菌活性的新倍半萜和2 个已知类似物(Zhu et al.,2022)等。鉴于Fusarium lateritiumZMT01 提取物在200 μg/mL 质量浓度下对O6 血清型大肠杆菌Escherichia coliO6 及尖孢镰孢菌Fusarium oxyspo‐rum具有抗菌活性,本文继续研究其代谢产物,从中分离鉴定了10个化合物(图1),并测试了抗菌活性,期望发掘具有相应价值的先导化合物。

图1 化合物1~10的结构Fig.1 The structure of compounds 1-10
1 实验部分
1.1 仪器、试剂及材料
Bruker/AⅤⅤANCE NEO 600 超导核磁共振谱仪、APⅠ3200 LC-MS、Horiba SEPA-300 旋光仪、G254 薄层硅胶和色谱纯甲醇、乙腈,其余试剂为分析纯。
Fusarium lateritiumZMT01 从中华稻蝗OxyachinensisThunberg 体内分离得到,通过PCR 技术扩增该真菌核糖体ⅠTS 基因区段(GenBank 号MT875260.1)与NCBⅠ数据库MK646016.1 菌株对比(相似度99%)鉴定。
O6 血清型大肠杆菌、O78 血清型大肠杆菌、金黄色葡萄球菌Staphylococcus aureus、禾谷镰孢菌Fusarium graminearum和尖孢镰孢菌Fusarium oxysporum,引自华南农业大学材料与能源学院天然资源再生与利用研究室。
1.2 菌株发酵与提取分离
采用与陈晓晴等(2020)相同的大米培养基将菌株Fusarium lateritiumZMT01 进行发酵培养,用无水乙醇萃取发酵物,再用乙酸乙酯萃取3次,取上清液减压浓缩得到粗提物(25.3 g)。使用微生物代谢产物常规的分离手段(陈敏等,2016),依次分离纯化出化合物1(139.2 mg)、2(72.6 mg)、3(41.8 mg)、4(6.5 mg)、5(6.2 mg)、6(33.3 mg)、7(1.1 mg)、8(1.7 mg)、9(0.9 mg)和10(35.1 mg)。详细分离流程见图2。
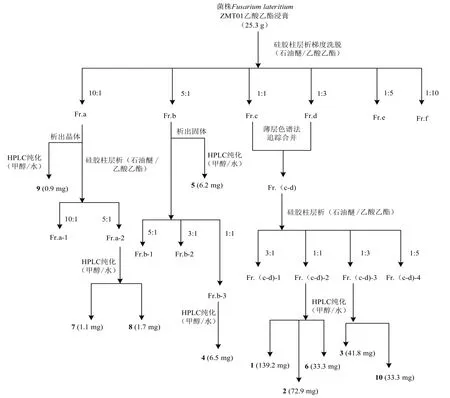
图2 菌株Fusarium lateritium ZMT01次级代谢产物1~10分离流程图Fig.2 The separation process of the secondary metabolites 1-10 from Fusarium lateritium ZMT01
1.3 体外抗菌活性测试
采用二倍稀释法(Bhat et al.,2011)体外测试化合物1~6,10 对血清型大肠杆菌(O6,O78)、金黄色葡萄球菌、禾谷镰孢菌和尖孢镰孢菌的抗菌活性,用最小抑菌质量浓度MⅠC 表示活性强弱,致病细菌以头孢拉定为阳性对照,植物病原真菌以三唑酮为阳性对照。
1.4 化合物波谱数据
化合物1:C13H16O5,无色晶体,ESⅠ-MS:m/z253.1[M+H]+,= +209(c0.61, MeOH), CD(MeOH)λmax(Δε), 207 (+ 2.93), 246 (+0.22), 291(+1.14),1H NMR (600 MHz, MeOD)δ4.86 (d,J=8.9 Hz, 1H, H-3), 4.51 (m, 1H, H-9), 4.25 (d,J=6.5 Hz, 1H, H-10), 3.64 (brt,J=8.0 Hz, 1H, H-6′),3.52 (d,J=3.9 Hz, 3H, H-12), 3.22 (m, 1H, H-3′),2.31(m, 1H, H-5), 2.19(m, 1H, H-5), 2.09(m,1H, H-6), 2.03 (m, 1H, H-6), 1.39 (d,J=6.5 Hz,3H, H-11),13C NMR (150 MHz, CDCl3)δ214.4 (C-4,C), 162.3 (C-7, C), 154.4 (C-2, C), 131.5 (C-1, C),87.9 (C-3, CH), 80.5 (C-9, CH), 68.8 (C-10, CH),60.2 (C-12, CH3), 50.9 (C-3′, CH), 43.9 (C-6′,CH), 37.7 (C-5, CH2), 23.6 (C-6, CH2), 17.5 (C-11,CH3)。
化合物2:C13H16O5,黄色油状物,ESⅠ-MS:m/z253.1[M+H]+,= +281 (c0.15, MeOH), CD(MeOH)λmax(Δε), 234 (+ 10.77), 264 (- 0.84), 296(+ 3.38),1H NMR (600 MHz, CDCl3)δ4.80 (t,J=9.0 Hz, 1H, H-6), 4.49 (dq,J=6.6, 13.1 Hz, 1H, H-3),4.27 (t,J=6.0 Hz, 1H, H-4), 3.60 (q,J=8.8 Hz, 1H,H-11), 3.47 (s, 3H, H-14), 3.10 (q,J=8.1 Hz, 1H,H-7), 2.18 (m, 1H, H-9), 2.14 (m, 1H, H-9), 2.12(m, 1H, H-10), 2.01 (m, 1H, H-10), 1.36 (dd,J=6.5,10.9 Hz, 3H, H-13),13C NMR (150 MHz, CDCl3)δ215.3 (C-8, C), 162.6 (C-1, C), 156.8 (C-5, C),131.3 (C-12, C), 84.8 (C-6, CH), 81.1 (C-3, CH),65.4 (C-4, CH), 60.2 (C-14, CH3), 51.6 (C-7, CH),45.0 (C-11, CH), 38.4 (C-9, CH2), 24.3 (C-10,CH2), 18.5 (C-13, CH3)。
化合物3:C13H16O5,黄色油状物,ESⅠ-MS:m/z253.1[M+H]+,= +272(c0.1, MeOH),1H NMR (600 MHz, CDCl3)δ4.93 (d,J=4.8 Hz,1H, H-4), 4.84 (d,J=8.4 Hz, 1H, H-6), 4.10 (m,1H, H-3), 3.60 (m, 1H, H-11), 3.49 (m, 1H, H-7),3.47 (s, 3H, H-14), 2.26 (m, 1H, H-10), 2.24(m, 1H ,H-10), 2.15 ( m, 1H, H-9), 1.95 ( m, 1H, H-9),1.26(m, 3H, H-13),13C NMR (150 MHz, CDCl3)δ214.4 (C-8, C), 171.8 (C-5, C), 168.3 (C-1,C), 140.3 (C-12, C), 83.2 (C-4, CH), 82.5 (C-6,CH), 67.0 (C-3, CH), 59.9 (C-14, CH3), 58.1 (C-7,CH), 40.0 (C-11, CH), 38.2 (C-9, CH2), 23.1 (C-10,CH2), 18.6 (C-13, CH3)。
化合物4:C15H16O6,红色针状晶体,ESⅠ-MS:m/z293.1 [M+H]+,= +250 (c0.1, MeOH),1H NMR (600 MHz, CDCl3)δ13.31 (s, 1H, OH-5),13.02 (s, 1H, OH-8), 6.17 (s, 1H, H-3), 4.16 (p,J=6.3 Hz, 1H, H-10), 3.92 (s, 3H, H-13), 2.94 (d,J=6.4 Hz, 2H, H-9), 2.35 (s, 3H, H-12), 1.33 (d,J=6.2 Hz, 3H, H-11),13C NMR (150 MHz, CDCl3)δ184.2 (C-4, C), 177.7 (C-1, C), 162.6 (C-8, C),160.9 (C-5, C), 160.6 (C-2, C), 142.5 (C-6, C), 138.6(C-7, C), 109.7 (C-8′, C), 109.6 (C-3, CH), 108.0(C-4′, C), 67.9 (C-10, CH), 56.9 (C-13, CH3), 36.3(C-9, CH2), 24.1 (C-11, CH3), 13.2 (C-12, CH3)。
化合物5:C15H14O6,红色针状晶体,ESⅠ-MS:m/z291.0 [M+H]+,1H NMR (600 MHz, CDCl3)δ13.24 (s, 1H, OH-9), 12.85 (s, 1H, OH-8), 6.20(s, 1H, H-7), 3.93 (s, 3H, H-15), 3.90 (s, 2H, H-11),2.29 (s, 3H, H-14), 2.23 (s, 3H, H-13),13C NMR(150 MHz, CDCl3)δ203.9 (C-12, C), 184.5 (C-4,C), 177.9(C-1, C), 161.5 (C-6, C), 160.7 (C-8,C), 160.5(C-9, C), 142.6 (C-2, C), 134.3 (C-3,C), 109.8 (C-10, C), 109.7 (C-7, CH), 108.5 (C-5,C), 56.9 (C-15, CH3), 41.3 (C-11, CH2), 30.1 (C-13,CH3), 13.0 (C-14, CH3)。
化合物6:C15H16O6,棕色固体,ESⅠ-MS:m/z293.1 [M+H]+,= -39.9 (c0.12, acetone),1H NMR(600 MHz, CDCl3)δ11.63 (s, 1H, OH-6), 6.34(s, 1H, H-7), 5.38 (s, 1H, H-10), 4.17 (dd,J=5.6, 9.3 Hz, 1H, H-4), 3.88(s, 3H, H-12), 3.76(d,J=9.3 Hz, 1H, H-4), 2.98 (d,J=5.5 Hz, 1H,H-3), 2.85 (dd,J=5.8, 7.9 Hz, 1H, H-2), 2.75(dd,J=7.9, 18.0 Hz, 1H, H-1), 2.48(dd,J=5.8,18.0 Hz, 1H, H-1), 2.18 (s, 3H, H-13),13C NMR (150 MHz, CDCl3)δ206.1 (C-11, C), 203.6(C-5, C),158.9(C-6, C), 154.5 (C-8, C), 134.6(C-9, C),127.6 (C-9′, C), 107.3 (C-5′, C), 99.0 (C-7, CH),74.7 (C-10, CH), 66.5 (C-4, CH2), 56.4 (C-12,CH3), 54.1 (C-3, CH), 44.1 (C-2, CH), 44.0 (C-1,CH2), 30.4 (C-13, CH3)。
化合物7:C23H32O2,白黄色粉末,ESⅠ-MS:m/z341.2 [M+H]+,1H NMR (600 MHz, acetone-d6)δ7.09 (s, 4H, H-5, H-5′, H-3, H-3′), 5.89 (s, 2H,H-1, H-1′), 3.94 (s, 2H, H-12), 2.32 (s, 6H, H-4,H-4′), 1.47 (s, 18H, H-9, H-9′, H-10, H-10′, H-11,H-11′),13C NMR (150 MHz, acetone-d6)δ150.1 (C-1,C-1′, C), 141.4 (C-6, C-6′, C), 138.3 (C-4, C-4′,C), 130.4 (C-5, C-5′, CH), 129.1 (C-3, C-3′, CH),126.4 (C-2, C-2′, C), 34.0 (C-12, CH2), 32.1 (C-7,C-7′, CH3), 30.2 (C-8, C-8′, C), 21.1 (C-9, C-9′, C-10,C-10′,C-11,C-11′, CH3)。
化合物8:C15H18O3,无色晶体,ESⅠ-MS:m/z247.1[M+H]+,1H NMR (600 MHz, CDCl3)δ7.31(m, 1H, H-8), 7.24 (m, 1H, H-7), 7.12 (s, 1H, H-1),6.84 (m, 1H, H-6), 6.60 (d,J=6.0 Hz, 1H, H-3),4.61 (s, 2H, H-9), 4.43 (sept,J=6.0 Hz, 1H, H-11),3.79 (s, 3H, H-10), 1.37 (d,J=6.0 Hz, 6H, H-12, H-13),13C NMR(150 MHz, CDCl3)δ157.0 (C-4, C), 153.9(C-5, C), 139.1 (C-2, C), 137.1 (C-7, CH), 125.9(C-1′, C), 121.6 (C-8, CH), 118.7 (C-1, CH), 118.0(C-4′, C), 113.1 (C-3, CH), 105.0 (C-6, CH), 72.9(C-11, CH), 64.6(C-9, CH2), 55.9(C-10, CH3),21.7 (C-12, CH3), 21.6 (C-13, CH3)。
化合物9:C29H50O,白色粉末,ESⅠ-MS:m/z415.3 [M+H]+,= -27 (c0.1, CHCl3),1H NMR(600 MHz, CDCl3)δ5.35 (t,J=6.4 Hz, 1H, H-6),3.50 (tdd,J=3.8, 4.2, 4.5 Hz, 1H, H-3), 2.27~1.08(m, 29H, H-1~2, H-4, H-7, H-8~9, H-11~12, H-14,H-15~16, H-17~18, H-20~21, H-22, H-23, H-25),1.02 (s, 3H, H-29), 0.94 (d,J=6.5 Hz, 3H, H-19),0.85 (t,J=7.2 Hz, 3H, H-24), 0.82 (d,J=6.4 Hz,3H, H-26), 0.80 (d,J=6.4 Hz, 3H, H-27), 0.66 (s,3H, H-28),13C NMR (150 MHz, CDCl3)δ141.1 (C-5,C), 122.0 (C-6, CH), 72.1 (C-3, CH), 57.0 (C-14,CH), 56.1 (C-17, CH), 50.4 (C-9, CH), 46.1 (C-22,CH), 43.0 (C-4, CH2), 42.5 (C-13, C), 40.0 (C-12,CH2), 37.6 (C-1, CH2), 36.7 (C-18, CH), 36.5 (C-10,C), 34.0 (C-20, CH2), 32.3 (C-7, CH2), 32.1 (C-8,CH), 32.0 (C-2, CH2), 29.3 (C-25, CH), 28.4 (C-16,CH2), 26.3 (C-21, CH2), 26.3 (C-15, CH2), 23.2 (C-23,CH2), 21.2 (C-11, CH2), 20.0 (C-26, CH3), 19.5 (C-27,CH3), 19.3 (C-19, CH3), 18.9 (C-28, CH3), 12.1 (C-24,CH3), 12.0 (C-29, CH3)。
化合物10:C6H8O3,淡黄色油状物,ESⅠ-MS:m/z129.0 [M+H]+,= -31.5 (c0.45, CHCl3),1H NMR (600 MHz, MeOD)δ5.81 (d,J=1.6 Hz,1H, H-2), 4.41 (dd,J=3.9, 11.9 Hz, 1H, H-5), 4.28(dd,J=4.5, 11.9 Hz, 1H, H-5), 4.16 (t,J=4.2 Hz,1H, H-4), 2.07 (s, 3H, H-6),13C NMR (150 MHz,MeOD)δ166.1 (C-1, C), 161.1 (C-3, C), 117.3 (C-2,CH), 72.6 (C-5, CH2), 64.8 (C-4, CH), 19.9 (C-6,CH3)。
2 结果与讨论
化合物1:ESⅠ-MS 显示准分子离子峰为m/z253.1[M+H]+,结合1H和13C NMR推测其分子式为C13H16O5,不饱和度为6。1H NMR 谱图中,δH1.39为甲基质子信号,δH2.31~2.03为亚甲基质子信号,δH3.52 为甲氧基信号。13C NMR 谱图中,存在2 个羰基碳(δC214.4, 162.3),2 个烯碳(δC154.4,131.5),1 个甲氧基碳δC60.2,其中双键,2 个羰基占3个不饱和度,故推测化合物具有三环体系。结合分子式,可知还含有1 个-OH。据此与Chen et al.(2018)波谱、比旋光度及CD 数据对比基本一致,鉴定为fusopoltide A。
化合物2:比较化合物2 和1 的13C NMR 数据,仅δC84.8处与化合物1的δC87.9相比差异明显,推测连接甲氧基处的手性碳相对于1有不同构型。与Ariefta et al.(2019)的波谱、比旋光度及CD 数据对比基本一致,鉴定为fusopoltide B。
化合物3:波谱数据与1、2 类似,表明具有与1、2 相似的三环结构,但3 的13C NMR 谱δC171.8(C-5)的信号与1 的δC156.8(C-5)有显著不同,推测原六元内酯环转变成为五元内酯环,据此与Ari‐efta et al.(2019)的波谱及比旋光度数据对比基本一致,鉴定为fusopoltide D。
化合物4:ESⅠ-MS 显示准分子离子峰为m/z293.1[M+H]+,相对分子质量为292,结合化合物的1H 和13C NMR 数据推测分子式为C15H16O6,不饱和度为8。1H NMR 谱在高场区有2 个甲基信号(δH2.35, 1.33),1 个亚甲基信号δH2.94,1 个甲氧基信号δH3.92;在低场区有2 个酚羟基信号(δH13.31, 13.02),1 个共轭烯氢信号δH6.17。13C NMR 谱显示2 个羰基碳(δC184.2, 177.7),8 个sp2杂化的碳,用去了6 个不饱和度,因此化合物4还具有双环体系,结合13C NMR 谱中2 个典型的与双键共轭的羰基碳化学位移值δC184.2和177.7,推测该化合物具有萘醌骨架。据此与Kimura et al.(1988)的波谱及比旋光度数据对比基本一致,鉴定为solaniol。
化合物5:化合物5 和4 的1H 和13C NMR 谱十分类似,表明具有相同萘醌骨架,13C NMR 谱中,前者比后者多出1 个δC203.9 的脂肪酮羰基碳,少了1个连氧的δC67.9的次甲基碳信号,推测前者是后者支链上的羟基氧化成羰基的衍生物,进一步与Chowdhury et al.(2017)的波谱数据对比一致,鉴定为javanicin。
化合物6:通过ESⅠ-MS,13C NMR 谱和元素分析确定分子式为C15H16O6,不饱和度为8。1H NMR 谱δH6.34 表明存在1 个五取代苯环,δH11.63 (s, 1H) 是和羰基形成分子内氢键的羟基信号。13C NMR 谱显示2 个羰基碳(δC206.1,203.6),6 个sp2杂化的碳,剩余2 个不饱和度,表明除苯环外,分子中还存在另外2 个环;δC74.7,66.5 的2 个处于较低场的连氧脂肪碳,结合其余的碳信号,推测其中一个环是环己酮,另一个是与之桥接的五元氧杂环。由此判断化合物6属于苯并环己酮类型且环己酮桥接了1 个五元氧杂环。1H NMR 谱δH3.88 (s, 3H) 和2.18 (s, 3H) 表明存在1 个甲基和1 个甲氧基,2.75 (dd,J=7.9,18.0 Hz, 1H),2.48 (dd,J=5.8, 18.0 Hz, 1H) 是与手性碳相连的亚甲基,δH5.38 (s,1H) 推测是同时和氧及双键相连的次甲基信号,3.76 (d,J=9.3 Hz,1H),4.17 (dd,J=5.6, 9.3 Hz, 1H) 是连氧的亚甲基信号,2.98 (d,J=5.5 Hz, 1H),2.85 (dd,J=5.8,7.9 Hz, 1H) 是2 个次甲基信号。据此与Korn‐sakulkarn et al.(2011)的波谱和比旋光度数据对比基本一致,鉴定为(1S, 4S, 10S)-3,4-dihydro-6,9-dihydroxy-8-methoxy-10-(2-oxopropyl)-1,4-methano-2-benzoxepin-5 (1H)-one。
化合物7: ESⅠ-MS 谱m/z341.2 [M+H]+,1H NMR 谱δH7.09 (s, 4H) 表明存在2 个对称的1,2,4,6-四取代苯环,δH1.47 (s, 18H) 表明含有2 个叔丁基,δH2.32(s, 6H) 表明存在2 个甲基,δH5.89 (s, 2H) 滴加重水交换后信号消失,表明是2个羟基,因此δH3.94 (s, 2H) 是连接2 个苯环的亚甲基。以上分析与13C NMR 谱信号显示的结构信息吻合。据此与Ai Zoubi et al.(2017)的波谱数据对比基本一致,鉴定为2,2′‐methylenebis (4‐methyl‐6‐tert‐butylphenol)。
化合物8:分子式C15H18O3通过ESⅠ-MS,1H和13C NMR 谱确定,不饱和度为7。13C NMR 谱中δC105.0~157.0是10个sp2杂化的碳,推测化合物具有萘环。1H NMR 谱δH4.61 (s, 2H) 表明存在羟甲基,δH3.79 (s, 3H) 是甲氧基信号,δH4.43 (sept,J=6.0 Hz, 1H),1.37 (d,J=6.0 Hz, 6H) 推测是与氧相连的异丙基。进一步与Bringmann et al.(1998)的数据对比基本一致,鉴定为2-hydroxymethyl-5-iso‐propoxy-4-methoxynaphthalen。
化合物9:1H NMR 谱δHδH2.27~1.08(29 H)的连续多重峰信号及积分情况表明具有多个亚甲基和次甲基且相互重叠,同时δH0.66~1.02 高场区显示了6 组甲基信号,它们与13C NMR 谱中δC12.0~57.0 中大量的甲基、亚甲基次甲基碳信号相吻合,符合甾醇类物质的核磁波谱特征(Gao et al.,2022)。此外,13C NMR 谱中还观察到1 组双键碳δc 141.1(s, C-5), 122.0 (s, C-6)和环上连羟基的碳δc 72.1(s, C-3)信号。据此与Chaturvedula et al.(2012)的数据对比基本一致,鉴定为β-sitosterol。
化合物10:ESⅠ-MS 显示准分子离子峰为m/z129.0 [M+H]+,结合1H 和13C NMR 谱推测分子式为C6H8O3,不饱和度为3。13C NMR 谱中δC166.1,161.1,117.3 表明存在1 个酯羰基碳和1 个双键,且互相共轭,剩余不饱和度表明还具有1个环状结构单元,推测为六元内酯环。1H NMR 谱图中,δH4.41,4.28,4.19 是连氧的质子信号,δH2.07 (s,3H) 是甲基信号,结合分子式,表明还有1 个羟基,据此与Kim et al.(2011)的波谱及比旋光度数据对比基本一致,鉴定为walterolactone A。
从内生真菌Fusarium lateritiumZMT01 分离到上述10 个次生代谢产物,化合物1~6 属于聚酮类,化合物7、8 属于酚类,化合物9 属于甾醇,化合物10属于内酯类。化合物1~3的可能的生源合成途径及关系已有报道:6 个乙酰辅酶A 经聚合得到六酮(Hexaketide),再经环化、重排、氧化、甲基化得到共同前体,接着通过两种不同的环氧化得到(3S,4S)和(3R,4R)两种中间体,前者经1,3 环化和1,4 环化分别得到化合物2 和3,后者经1,3 环化得到化合物1(Ariefta et al.,2019)。根据化合物10的结构特点结合化合物1~3的生源合成途径,推测其可能的生源合成途径为2个乙酰辅酶A 先聚合为乙酰乙酰辅酶A,再和1 个乙酰辅酶A 聚合为甲戊二羟酸,接着经过氧化、环化、脱水形成产物。化合物8、10 为首次从Fusarium属中分离得到,丰富了镰刀菌属的代谢产物库。除化合物9外,其他化合物均为首次从Fusarium lateritium中得到,丰富了砖红镰刀菌的次生代谢产物库。
化合物2 曾被报道对环氧合酶-2(COX-2)具有显著的抑制作用(Chen et al.,2018),化合物4 能显著下调HMG-CoA 合成酶基因表达,同时还具有抗结核分枝杆菌H37Rv 株的活性,MⅠC 为32 µg/mL(Niu et al.,2019;Shah et al.,2017),化合物6 具有抗结核分枝杆菌的活性,MⅠC 为25 µg/mL(Korn‐sakulkarn et al.,2011),化合物7是一种抗氧化剂,在1 mmol/L 下清除DPPH 活性与没食子酸相当(Ai Zoubi et al.,2017)。本文进一步测试了所分离化合物对大肠杆菌(O6、O78 血清型)等病原菌的抑菌活性,化合物4、5 对人致病性O6 血清型大肠杆菌的MⅠC均为6.25 µg/mL,与阳性对照头孢拉定活性接近(MⅠC 3.13 µg/mL),化合物4 对引起番茄枯萎病的尖孢镰孢菌的MⅠC 为200 µg/mL,显示中等抗菌活性(阳性对照三唑酮MⅠC 100 µg/mL),其余化合物对所测病原菌的MⅠC 均高于200 µg/mL。本文筛选出化合物4、5 对O6 血清型大肠杆菌有强抑菌作用,为抗O6 血清型大肠杆菌药物的研究提供了先导化合物。化合物4 具有中等抗尖孢镰孢菌活性,可进一步开展活性优化或温室作物防病研究,为防治番茄枯萎病农药的研制提供相应的理论基础。

