萌育与冻融处理对芝麻γ-氨基丁酸含量的影响
王洪震,郝征红,李圆圆,马梦瑶,张 悦,王明辉
(1 山东农业工程学院食品科学与工程学院 济南250100 2 中国海洋大学海洋生命学院 山东青岛266003 3 济南大学生物科学与技术学院 济南 250022)
γ-氨基丁酸(γ-Amino butyric acid,GABA)是一种以自由态存在的四碳非蛋白质天然氨基酸,是哺乳动物脑、脊髓中重要的神经递质,具有抗抑郁,改善睡眠,缓解精神压力,降血压,防止动脉硬化等功能[1-6]。我国早在2009 年就将GABA 列入新资源食品管理。由于人体自身合成γ-氨基丁酸的能力随年龄的增长而减弱,通常食物中GABA 含量仅为0.03~2.00 μmol/g dw,因此正常饮食无法满足机体需求[7]。芝麻(Sesamum indicum L.)是脂麻科脂麻属植物脂麻的干燥成熟种子,在全球种植范围广,芝麻含有丰富的油脂、蛋白质及多种生物活性物质,有研究分析了芝麻的氨基酸组成,发现其谷氨酸含量最高,占种子的4%左右,占总氨基酸的20%以上[8-10],而谷氨酸是合成GABA 的重要前体物质,因此芝麻具有较高的GABA转化富集潜力。
萌育处理被认为是一种成本低廉、方便有效的改善谷物、豆类食用品质和营养价值的方法,可以有效提高谷物、豆类的营养价值和生物活性成分含量[11-14],如提高GABA 的含量、多酚类物质以及新产生维生素C 等[6-7]。近年来,有研究利用糙米、小米、大豆、鹰嘴豆、蚕豆等通过发芽、发酵等方式进行GABA 富集[15-20]。目前国内外对芝麻中GABA 的研究尚处于起步阶段,对于芝麻中GABA含量的影响因素研究尚属空白。本研究探讨萌育与冻融处理条件对芝麻中GABA 含量的影响,利用响应面试验得到芝麻转化γ-氨基丁酸的最佳处理条件,为利用芝麻开发富含γ-氨基丁酸的食品提供一定的理论依据。
1 材料与方法
1.1 试验材料与设备
芝麻:中芝34 号,山东省十里香芝麻制品有限公司提供,山东省无棣县种植。
γ-氨基丁酸(GABA)标准品,上海源叶生物科技有限公司;苯酚,西陇科学股份有限公司;无水乙醇,天津市富宇精细化工化学有限公司;无水氯化钙,天津博迪化工股份有限公司;L-谷氨酸钠,上海蓝季科技发展有限公司;硼砂,天津市恒兴化学试剂制造有限公司;硼酸,西陇科学股份有限公司;次氯酸钠,天津市富宇精细化工化学有限公司。
RXZ-500D 型智能恒温恒湿培养箱,江南仪器有限公司;THZ-98AB 型恒温振荡器,上海一恒科技仪器有限公司;TGM-20L 型高速冷冻台式离心机,湘仪离心机仪器制造有限公司;GZX-9240MBE 型电热鼓风干燥箱,上海博讯实业有限公司;PHS-2F 型酸度计,上海雷磁仪器有限公司;V-5600 型分光光度计,上海元析仪器有限公司。
1.2 试验方法
1.2.1 萌育条件的单因素实验设计 将芝麻籽粒用5 倍体积的去离子水或相应培养液在室温下浸泡0.5 h,浸泡处理的芝麻置于铺有湿润纱布的培养皿中,在培养箱中培养,选取萌育温度、萌育时间、氯化钙溶液浓度及谷氨酸钠溶液浓度4 个因素进行单因素实验。萌育芝麻从培养箱中取出后,沥干,匀浆,待测。蒸馏水浸泡芝麻0.5 h 作为对照组。
1)萌育时间的变化 将挑选过的芝麻浸泡0.5 h,在30 ℃下萌育0.5,1.0,1.5,2.0,2.5,3.0 d,每12 h 补充一次蒸馏水,按时取样,沥干,匀浆,测定GABA 含量。
2)萌育温度的变化 芝麻浸泡0.5 h,分别在20,25,30,35,40,45 ℃下萌育2.0 d,每12 h 补充一次蒸馏水,取样,沥干,匀浆,测定GABA 含量。
3)氯化钙溶液浓度的变化 配制浓度为0.0,1.0,2.0,3.0,4.0 mmol/L 的氯化钙溶液,将芝麻分别置于不同浓度氯化钙溶液中浸泡0.5 h,然后30 ℃培养2.0 d,每隔12 h 补充相应浓度氯化钙溶液,取样,沥干,匀浆,测定GABA 含量。
4)谷氨酸钠溶液质量浓度的变化 配制质量浓度为0.0,0.5,1.5,2.5,3.5,4.5,5.5 mg/mL 的谷氨酸钠溶液,将芝麻分别置于不同质量浓度谷氨酸纳溶液中浸泡0.5 h,然后30 ℃培养2.0 d,每隔12 h 补充相应浓度谷氨酸钠溶液,取样后,反复冲洗后沥干,匀浆,测定GABA 含量。
1.2.2 冻融处理(冷冻-解冻)的单因素及响应面试验设计 萌育芝麻冷冻处理:选取一定量的芝麻用5 倍体积蒸馏水在室温下浸泡0.5 h 后,30℃培养箱内培养1.0 d,随后选取冷冻时间、解冻温度、解冻时间3 个影响因素进行试验。
1)冷冻时间的单因素实验 将培养1.0 d 的芝麻在-18 ℃下分别冷冻12,15,18,21,24 h,之后在30 ℃下解冻12 h,沥干,匀浆后测定GABA 含量。
2)解冻温度的单因素实验 将培养1.0 d 的芝麻在-18 ℃下冷冻18 h,之后分别在20,25,30,35,40 ℃下解冻12 h,沥干,匀浆后测定GABA 含量。
3)解冻时间的单因素实验 将培养1.0 d 的芝麻在-18 ℃下冷冻18 h,30 ℃培养箱解冻6,9,12,15,18,21 h,沥干,匀浆后测定GABA 含量。
4)冷冻-解冻处理响应面试验设计 在单因素实验基础上,基于Box-Behnken 模型,以冷冻时间、解冻温度、解冻时间作为自变量,GABA 含量为响应值,设计方法见表1。
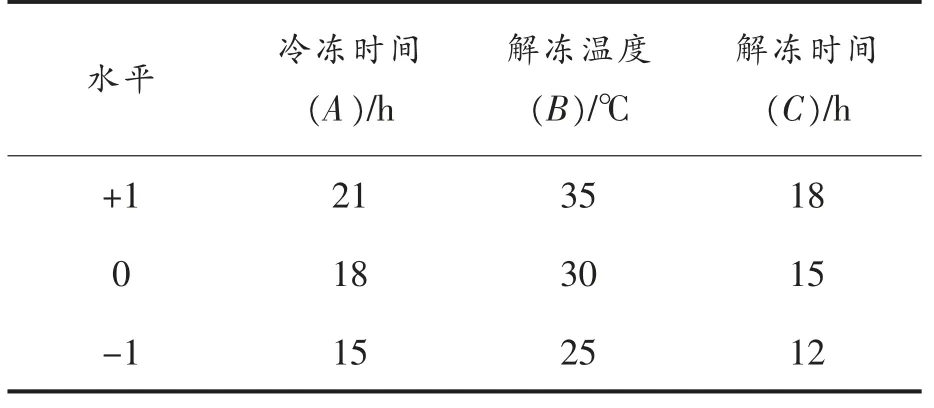
表1 响应面试验因素水平表Table 1 Response surface test factor level table
1.2.3 γ-氨基丁酸含量的测定 采用Berthelot 比色法测定GABA 含量[21]。样品用滤纸吸干表面水分,准确称取2.00 g,研磨至均匀浆状,定容至50 mL,40 ℃,300 r/min 于恒温振荡器中振荡浸提1 h,13 000 r/min 离心15 min,取出上清液,滤纸过滤,过0.22 μm 滤膜,取0.5 mL 上清液测定。GABA 质量浓度C(μg/mL)与吸光值(OD)之间线性回归方程为y=1.5877x+0.0045(R2=0.9977)。
样品中水分含量的测定参照GB 5009.3-2016。
1.2.4 数据处理与分析 各影响因素试验指标重复测定3 次,结果以“x¯ ±s”表示,测定指标以干重表示,用Design Expert 10.0 及DPS 软件处理试验数据,采用Origin 2018 及Microsoft Excel 作图。
2 结果与分析
2.1 萌育条件对γ-氨基丁酸含量的影响
2.1.1 萌育时间对GABA 含量的影响 由图1 可知,对照组GABA 含量为(1.98±0.08)mg/g,随着萌育时间的延长,GABA 含量逐渐增加,至2.5 d 时,GABA 含量突增至(6.60±0.09)mg/g,与对照组相比增加4.62 mg/g;在萌育0 d(对照组)和3 d 时,芝麻中GABA 含量存在显著差异(P<0.05),提高了2.63 倍。这可能是由于萌育初期,芝麻吸收环境水分,只是物理吸涨过程,因此对GABA 含量影响不大;萌育中期,芝麻中大分子储能物质,如蛋白质、糖等,通过细胞组织内源酶的作用,转化为可溶性小分子物质,供给芝麻呼吸、萌育所需营养物质,为GABA 的大量转化奠定基础,故萌育芝麻中的GABA 含量迅速上升;随着芝麻萌育时间继续延长,从2.5 d 至3.0 d,GABA 含量增幅变小,可能是因为GABA 分解速率加快,底物含量降低,GABA 的增幅减缓[22]。控制萌育时间是一种有效增加GABA 含量的处理方法,可以通过此方法转化芝麻中GABA。
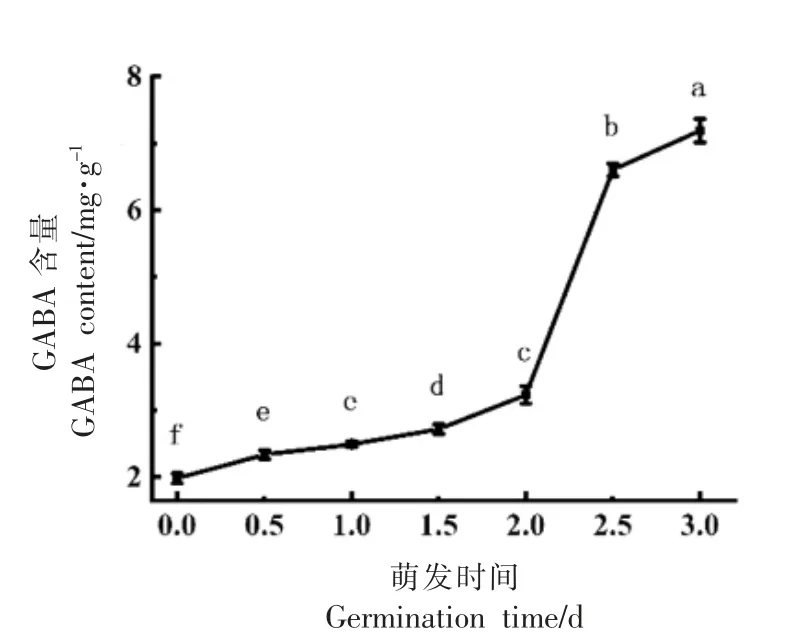
图1 不同萌育时间对GABA 含量的影响Fig.1 Effects of different germination time on GABA content
2.1.2 萌育温度对GABA 含量的影响 根据图2可知,萌育温度在20~30 ℃范围内,GABA 含量快速增加,30 ℃增加至最大值(3.36±0.09)mg/g,相较对照组提高了1.38 mg/g,随后开始下降。谷氨酸脱羧酶是GABA 转化过程中最重要的酶,芝麻萌育过程中,由于反应底物谷氨酸的作用,谷氨酸脱羧酶逐渐被激活,萌育温度过低会抑制谷氨酸脱羧酶的活性,萌育温度过高会直接破坏酶蛋白空间结构,温度过高或过低均会抑制谷氨酸脱羧酶催化生成GABA[23]。
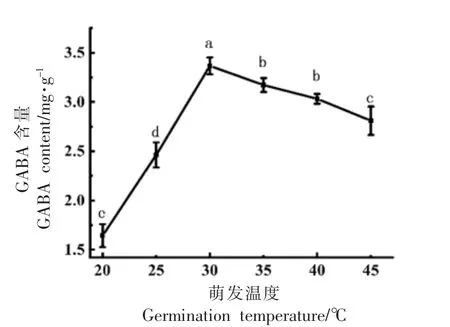
图2 不同萌育温度对GABA 含量的影响Fig.2 Effects of different germination temperatures on GABA content
2.1.3 氯化钙溶液浓度对GABA 含量的影响 由图3 可知,当氯化钙浓度为0 mmol/L 和1 mmol/L时,萌育芝麻中GABA 含量并没有显著性差异(P>0.05),含量较低,当浓度增加至2 mmol/L 时,芝麻萌育转化GABA 含量达到最大值(4.12±0.11)mg/g,相较于对照组提高了2.14 mg/g,随着氯化钙浓度继续增加,芝麻萌育GABA 含量开始下降,含量仍略高于去离子水萌育时的含量。这可能是因为作为第二信使,钙离子通过信号传递的方式调节谷氨酸脱羧酶活力,增加酶促反应速率,合成代谢速率高于分解代谢速率,达到GABA 含量增加的目的[24];氯化钙浓度进一步增加,培养液中离子浓度升高,芝麻细胞外的渗透压升高,堵塞物质运输通路,不利于GABA 的转化。

图3 不同浓度氯化钙溶液对GABA 含量的影响Fig.3 Effect of calcium chloride solution with different concentration on GABA content
2.1.4 谷氨酸钠对GABA 含量的影响 由图4 可知,当谷氨酸钠溶液质量浓度增加至4.5 mg/mL时,芝麻萌育转化GABA 达到最大值(6.24±0.06)mg/g,相较于对照组提高了4.26 mg/g,随着谷氨酸钠溶液质量浓度进一步增加,GABA 含量反而降低。这可能是由于溶液浓度过高使得萌育环境中离子浓度升高,芝麻细胞外渗透压增加,堵塞物质运输及电子传递的通道[25],不利于物质代谢,GABA 的生成受阻。而在较适合的浓度时,作为底物的谷氨酸钠质量浓度升高,谷氨酸钠脱羧酶合成GABA 时,可利用的底物相应增多。

图4 不同质量浓度谷氨酸钠溶液对GABA 含量的影响Fig.4 Effects of different mass concentrations of sodium glutamate solution on GABA content
2.2 冻融处理对芝麻中γ-氨基丁酸含量的影响
2.2.1 冷冻时间对萌育芝麻GABA 含量的影响由图5 可知,冷冻时间在12~18 h 时,GABA 含量增加,18 h 增加至最大值,之后随着冷冻时间的延长,GABA 含量降低。这可能是由于低温冷冻促使诸如蛋白质等大分子物质变性且合成量减少[26-27],促使小分子物质生成,因此谷氨酸向GABA 的转化量增加,当芝麻受到外界逆境胁迫如冷冻-解冻损伤等,植物会合成包括GABA 在内的小分子功能物质,适应外界逆环境;此外,植物在逆境环境中会通过调节胞质钙离子浓度或胞内氢离子浓度来调节胞内谷氨酸脱羧酶活性[28],进而调节GABA 含量,冷冻初期,钙离子释放有利于激活谷氨酸脱羧酶,而长时间冷冻,酶活性降低的同时,也会促使GABA 分解以满足芝麻能量供求[29],造成GABA 含量降低。

图5 不同冷冻时间对GABA 含量的影响Fig.5 Effect of different freezing time on GABA content
2.2.2 解冻温度对萌育芝麻GABA 含量的影响由图6 可知,解冻温度在20~25 ℃范围内,GABA含量没有显著性差异(P>0.05),随着解冻温度的升高,GABA 含量增加,在30 ℃达到最大值。这是由于低温下芝麻的细胞形成冰晶体,融化后其体积发生变化,对细胞造成机械损伤,植物在遭受应激性时会刺激GABA 的合成,抵御逆环境,芝麻由冷冻处理转入解冻条件,芝麻为适应环境开始积累包括GABA 在内的小分子营养物质,随着温度进一步升高,芝麻组织产生不可抑制的损伤[30-32],导致GABA 含量降低。

图6 不同解冻温度对GABA 含量的影响Fig.6 Effect of different thawing temperatures on GABA content
2.2.3 解冻时间对萌育芝麻GABA 含量的影响由图7 可知,在6~15 h,随着解冻时间的延长,GABA 含量相应增加,在15 h 增加至最大值,随后含量开始降低。这是因为低温解除冰晶融化后,氢离子等渗入细胞质,激活谷氨酸脱羧酶,故随着解冻时间的延长,GABA 含量在萌育芝麻组织内积累,此外,回温过程中芝麻组织细胞膜被破坏,细胞内外传质作用增大,谷氨酸脱羧酶与底物充分作用,合成的GABA 得以积累;解冻时间过长,就会出现诸如组织损伤、微生物繁殖等不可控影响,导致GABA 含量下降[33-35]。
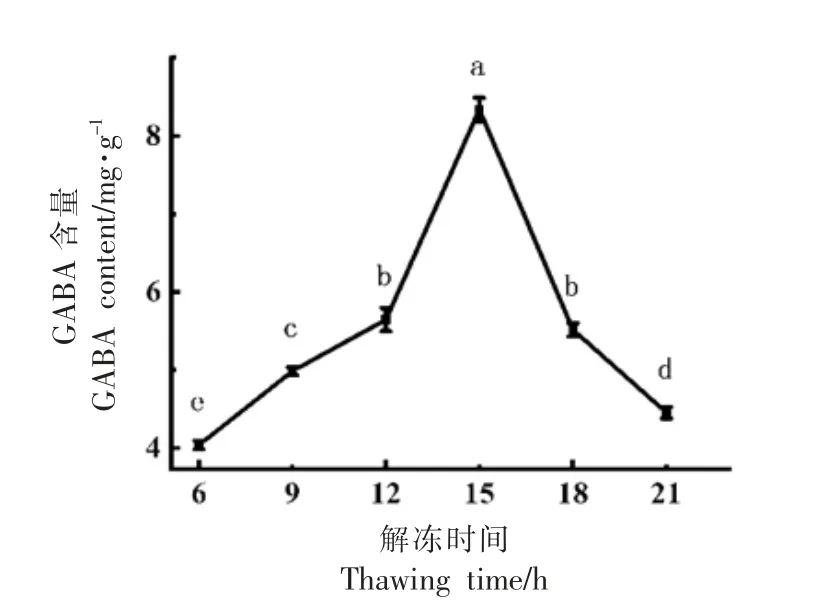
图7 不同解冻时间对GABA 含量的影响Fig.7 Effect of different thawing time on GABA content
2.3 不同处理条件对γ-氨基丁酸含量影响的比较
由图8 可知,冻融处理与其它处理条件相比,芝麻中GABA 含量存在显著性差异(P>0.05),冻融处理显著提升GABA 含量,本研究选用响应面试验完成冷冻-解冻处理的优化。

图8 不同处理条件对GABA 含量的影响Fig.8 Effects of different treatment conditions on GABA content
2.4 冷冻-解冻(冻融)处理条件的优化
在冻融处理单因素实验的基础上,根据Box-Behnken 的中心组合设计原理,以冷冻时间、解冻温度、解冻时间为考察因素,以GABA 量为响应值,确定冷冻-解冻的最佳条件,具体结果见表2。
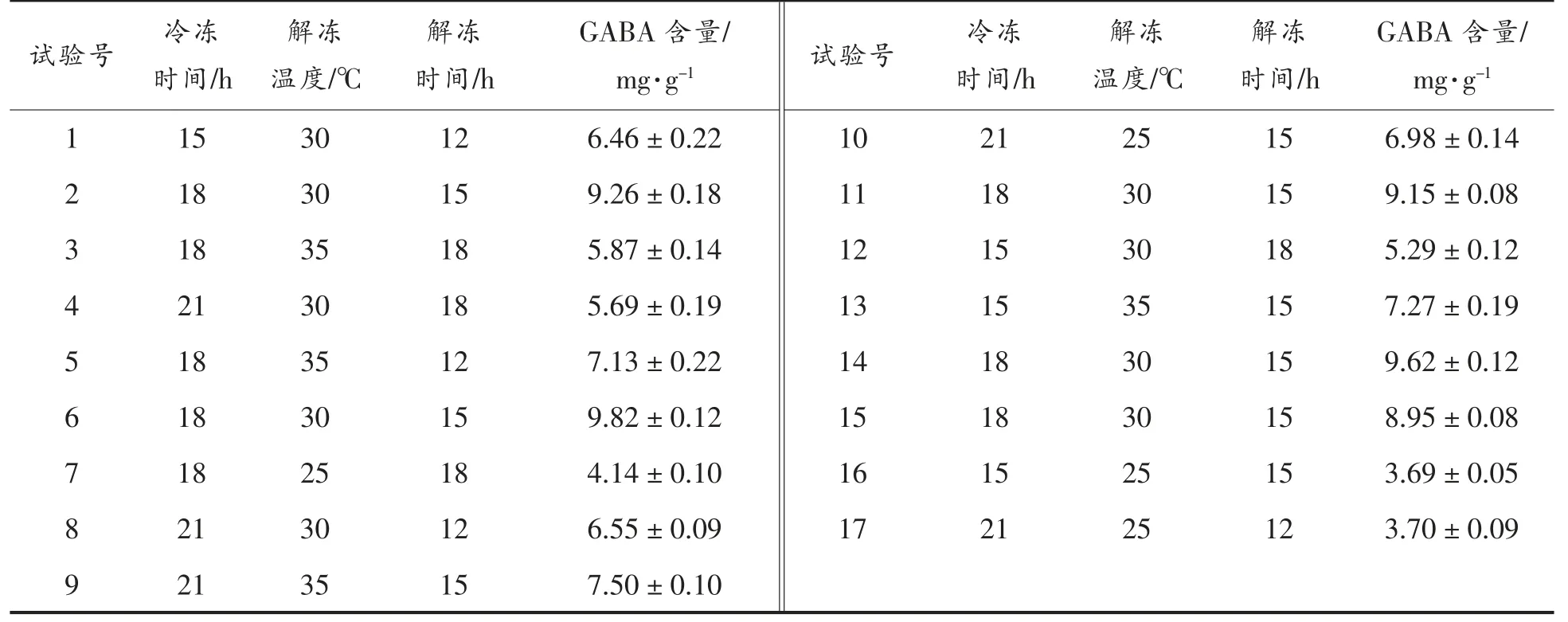
表2 Box-Behnken 试验设计及结果Table 2 Experiment design and results table of Box-Behnken
2.4.1 二次多项式回归模型的建立 回归模型的方差分析见表3。

表3 GABA 回归模型方差分析Table 3 GABA regression model analysis of variance
结合表2、表3 可知,GABA 含量与冻融处理间的二次多项式模型为:Y=9.30+0.47A+1.16B-0.39C-0.76AB+0.045AC-0.48BC-1.10A2-1.85B2-2.29C2。式中,Y 指GABA 含量的预测值,A、B、C分别指冷冻时间、解冻温度、解冻时间的编码值。
其中二次多项式模型的有效性主要由失拟项检验与回归方程显著性检验决定,这两项都可以通过F 检验反映。由表4 可知,模型P=0.0003达到极显著水平(P<0.01),失拟项P=0.1177 不显著(P>0.05),这说明所选模型合理。R2Adj为0.9171,说明该模型可以解释芝麻冻融过程中91.71%响应值的变化规律。综上,芝麻在冻融处理中GABA 含量的变化可以通过该二次多项式模型预测。
结合表3 可知,因素B 对冻融处理过程中GABA 含量的影响极显著(P<0.01),因素AB 对冻融处理过程中GABA 含量的影响显著(P<0.05),因素A、C、AC、BC 对冻融处理过程中GABA 含量影响不显著(P>0.05),因素A2、B2、C2对冻融处理过程中GABA 含量影响极显著(P<0.01)。
2.4.2 因素交互作用分析 冷冻时间、解冻温度、解冻时间的交互作用对GABA 含量的影响可以通过响应面3D 图及等高线直观观察。在等高线图中,椭圆形表示交互作用显著,圆形表示交互作用不显著。
1)冷冻时间与解冻温度的交互作用 结合图9 可知,冷冻时间与解冻温度交互作用显著,随着冷冻时间延长及解冻温度升高,响应值相应增加,随后出现下降的趋势,解冻温度在29~33 ℃,冷冻时间在17~19 h,对应GABA 含量达到最大值,与单因素实验分析结果相吻合。
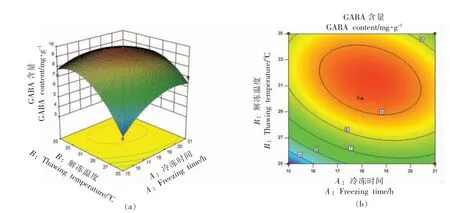
图9 冷冻时间和解冻温度响应面图和等高线图Fig.9 Response surface and contour map of freezing time and thawing temperature
2)冷冻时间与解冻时间的交互作用 由图10 可知,随着冷冻时间、解冻时间的延长,响应值相应增加,随后又开始出现下降趋势,解冻时间在14~16 h,冷冻时间在17~19 h,对应GABA 含量达到最大值,这与单因素实验时分析结果相吻合。
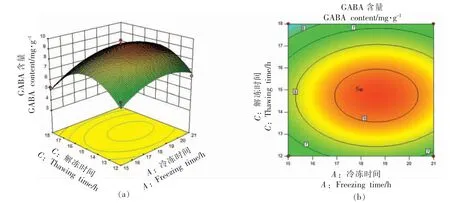
图10 冷冻时间和解冻时间响应面图和等高线图Fig.10 Response surface and contour map of freezing time and thawing time
3)解冻温度与解冻时间的交互作用 由图11 可知,随解冻时间的延长及解冻温度的升高,响应值(GABA 含量)相应增加,而随后开始出现下降的趋势,解冻温度在29~33 ℃,解冻时间在14~16 h,对应GABA 含量达到最大值,这与单因素实验分析结果吻合。

图11 解冻温度和解冻时间响应面图和等高线图Fig.11 Response surface and contour map of thawing temperature and thawing time
2.4.3 冻融处理提高γ-氨基丁酸含量的最优条件 经过软件分析可以得出冻融处理转化GABA的最佳条件是:冷冻时间18.3 h,解冻温度31.5℃,解冻时间14.6 h,芝麻中GABA 含量可达9.92 mg/g。
2.4.4 验证性试验 结合最优条件,选定冷冻时间18 h,解冻温度32 ℃,解冻时间15 h,测定GABA 转化值为(10.02±0.35)mg/g,与模型预测值接近,证实了模型的可靠性,响应面优化试验结果也得到验证。
3 结论
1)萌育时间、温度对于芝麻GABA 的含量均有明显作用。随着芝麻萌育时间的延长,GABA 含量显著增加,萌育2.5 d,GABA 含量突增至(6.60±0.09)mg/g,与对照组相比增加4.62 mg/g;萌育3 d,GABA 含量增加至(7.19±0.18)mg/g,相较于对照组提高2.63 倍。随着萌育温度的提高,芝麻GABA 含量先升高再降低,萌育温度30 ℃时,GABA 含量增加至最大值(3.36±0.09)mg/g,是对照组的1.7 倍。
2)在萌育过程中添加氯化钙、谷氨酸钠有利于GABA 的转化。添加2.0 mmol/L 氯化钙溶液时,GABA 含量增加至最大值(4.12±0.11)mg/g,相较于对照组提高了2.14 mg/g,是对照组的2 倍;添加4.5 mg/mL 氯化钙溶液时,GABA 含量增加至最大值(6.24±0.06)mg/g,是对照组的3.15 倍。
3)冷冻-解冻胁迫(冻融)处理对提高萌育芝麻GABA 含量效果明显。使用浸泡0.5 h,30 ℃萌育1.0 d 的芝麻进行冷冻-解冻处理,根据Box-Behnken 的中心组合设计原理,确认最优的芝麻GABA 转化条件是冷冻胁迫18 h,解冻温度32℃,解冻时间15 h,该条件下芝麻中GABA 含量可达(10.02±0.35)mg/g,比未经冷冻-解冻处理的芝麻GABA 含量提高3.02 倍,比未经萌育处理的芝麻GABA 含量提高4.06 倍。

