旋毛虫免疫逃避机制的研究进展
钱艳红,宋 帅,温肖会,贾春玲,吕殿红,袁子国,罗胜军
旋毛虫(Trichinellaspiralis)是一种专性胞内寄生线虫,呈世界性分布,宿主范围超过150种动物,包括哺乳动物、鸟类和爬行动物等[1]。旋毛虫感染宿主后可引发旋毛虫病,旋毛虫病属于人兽共患病,被列为世界第七大食源性寄生虫病,也被我国列为二类动物疫病[2]。旋毛虫可以感染多种动物,并主要通过猪肉及猪肉制品传播给人类,旋毛虫感染人以后,可引起人类腹痛腹泻、发烧、肌肉绞痛,严重时引起脑炎导致人死亡[3]。2005-2008年,中国5个省份屠宰场屠宰的猪中旋毛虫感染率高达5.75%[4]。2009-2020年,中国报告了8次人旋毛虫病暴发事件,共479例,其中2例死亡[5]。因此,旋毛虫感染不仅是一个严重的公共卫生问题,而且对养殖业和肉类食品安全构成威胁。
旋毛虫生活史复杂,主要分为肌肉幼虫(muscle larva,ML)、成虫(adult Worm,AW)和新生幼虫(newborn larva,NBL)3个时期[6]。如图1所示,宿主通过摄入含ML包囊的生肉或未煮熟的肉感染旋毛虫,含有ML的包囊在宿主胃蛋白酶的消化下释放ML,ML进入宿主肠道,那里它们穿透肠粘膜并经历4次蜕皮,发育成为AW(雄性或雌性),AW经交配产生NBL,NBL穿透肠壁,进入淋巴系统,并通过血流迁移到横纹肌,最后NBL侵入横纹肌细胞成熟为ML[7-8]。
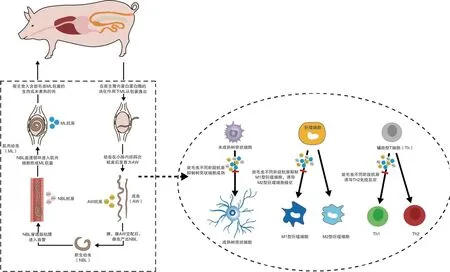
图1 旋毛虫生活史及调节宿主免疫反应示意图Fig.1 Schematic diagram of the life history and regulation of the host immune response of Trichinella spiralis
旋毛虫感染宿主后可与其长期共存,根据宿主的寿命不同,旋毛虫可在啮齿类动物体内持续存在直至宿主死亡,在高等动物或人体内存在数月至数年[9]。旋毛虫之所以能够在宿主体内长期存活和持续感染,不被宿主清除,是因为它可以通过各种逃避机制成功躲避宿主免疫系统的攻击[10]。因此,对旋毛虫逃避宿主免疫机制的深入认识和了解,将为开发有效防治旋毛虫的药物和疫苗提供重要帮助和理论基础。
1 抗原变异
抗原变异是指病原体不断改变自身抗原,产生新的变异体,使宿主已产生的抗体不再起作用。按照来源部位的不同,旋毛虫的抗原主要分为表面抗原、虫体抗原和代谢分泌抗原[11]。旋毛虫表面抗原分子是构成虫体表面角质层的主要成分,可直接暴露于宿主的免疫系统,并在旋毛虫的蜕皮和生长过程中发生变化。旋毛虫虫体抗原是虫体死亡后的可溶性部分,主要来自于虫体内部,不易被宿主识别[12]。旋毛虫代谢分泌(excretory-secretory, ES)抗原是虫体分泌到体外与宿主机体直接作用的抗原,参与生命周期中的多种功能[13]。旋毛虫发育史复杂,为了逃避宿主免疫系统的识别,旋毛虫AW、NBL和ML的表面抗原、虫体抗原和代谢分泌抗原发生了不同程度的变异,这种抗原变异体现在相同抗原占比的改变以及不同新抗原的产生。如Liu JY等[14]将旋毛虫AW、NBL和ML裂解物中的蛋白质通过同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)技术进行鉴定,在所有发育阶段共鉴定出4 691种蛋白质,在成对(NBL与AW、AW与ML及NBL与ML)比较中,共发现146种蛋白质差异表达,阶段特异性蛋白质的数量在ML与NBL中最高(352种蛋白质),是NBL与AW(93种蛋白质)的3倍。旋毛虫抗原的变异延缓了宿主清除免疫的进程,有利于虫体逃避宿主的免疫攻击。
2 调节宿主的免疫反应
旋毛虫从感染到形成包囊前的整个过程是其能够在宿主体内建立长期感染的关键。在此期间,旋毛虫暴露于宿主免疫系统中,宿主将启动各种免疫反应阻止旋毛虫侵入机体并将其清除。为了逃避宿主免疫系统的攻击,旋毛虫通过ES抗原诱导T细胞极化、抑制树突状细胞成熟以及调节巨噬细胞表型以抑制宿主的抗寄生虫免疫反应(图1)。
2.1 诱导T细胞极化 在健康宿主免疫系统中,Th1/Th2免疫反应处于平衡状态,调控机体免疫状态和免疫水平,有利于宿主抵抗外来病原体入侵。旋毛虫感染宿主后,能通过ES抗原调控宿主免疫系统,引发Th2反应为主的Th1/Th2混合免疫反应,使宿主免疫反应失衡,导致宿主免疫功能受到抑制,以逃避宿主的免疫攻击,保护自身不被清除[15]。
旋毛虫在肠感染阶段,宿主以γ-干扰素(IFN-γ)、白细胞介素-2(IL-2)和白细胞介素-12(IL-12)增加为特征的Th1免疫应答反应为主,在此期间抑制Th1型免疫将为旋毛虫AW的入侵、发育和幼虫的产生提供充足的时间[16]。在NBL移行阶段和ML包囊形成阶段,宿主免疫反应转变为Th2型免疫应答反应,并占主导地位,其特征是产生高水平的细胞因子IL-4、IL-5、IL-9、IL-10和IL-13,以协调杯状细胞增生、粘蛋白产生增加、平滑肌收缩力增强和上皮细胞周转延长等上皮细胞反应,有助于减轻虫体给宿主造成的组织损伤并加强组织修复,维持旋毛虫在宿主体内的慢性感染[17-18]。Song Y等[19]采用MSD电化学发光检测技术和流式细胞术检测旋毛虫感染小鼠的免疫细胞和细胞因子谱。脾脏MSD结果显示,感染后6 h至6 d时Th1免疫受到抑制,6 d时Th2免疫应答水平显著升高;肠系膜淋巴结在3 d至 6 d时表现出 Th1/Th2 混合免疫应答,Th1在6 d时呈下降趋势;流式细胞术分析显示,感染后6 h,Th1细胞比例显著降低,Th2细胞比例明显升高,这些结果表明旋毛虫诱导宿主产生Th2型主导的免疫反应。Gao X等[20]对旋毛虫ML衍生的细胞外囊泡蛋白(Ts-ML-EVs)进行蛋白组学鉴定,并用纯化的TS-ML-EVs皮下注射免疫BALB/c小鼠,在用旋毛虫感染后,检测TS-ML-EV诱导的细胞和体液免疫应答,结果表明,TS-ML-EVs能诱导以Th2为主的Th1/Th2混合免疫应答。
2.2 抑制树突状细胞成熟 树突状细胞(dendritic cells,DC)属于专职抗原递呈细胞,主要功能是识别、捕获、处理和向T细胞呈递抗原[21]。根据分化状态的不同,DC分为前体树突状细胞、 未成熟树突状细胞、 迁移期树突状细胞和成熟树突状细胞,只有成熟树突状细胞才能刺激初始T细胞活化,诱导宿主产生T细胞反应。在宿主免疫反应过程中,DC既是始动者也是协调者,它可以通过多种模式识别受体激活途径引导免疫应答,这是适应性免疫应答产生和极化的基础。DC上广泛表达的模式识别受体(如Toll样受体、NOD样受体以及C型凝集素受体等)是寄生虫与宿主相互作用的重要靶点。旋毛虫感染宿主后,宿主DC细胞受到抗原的刺激分化为成熟树突状细胞,诱导宿主产生免疫反应将其清除。为了逃避宿主的免疫清除,旋毛虫通过ES抗原与DC上的多种模式识别受体相互作用,影响DC表面共刺激分子或相关蛋白的表达,抑制部分DC成熟或完全成熟,阻止宿主初始T淋巴细胞正常增殖分化及诱导辅助性T淋巴细胞(Th)极化,为自己能够长期感染宿主创造有利条件[22]。Jin X等[23]为了研究NOD样受体蛋白3(NLRP3)在旋毛虫感染触发的免疫反应中的作用,用旋毛虫肌幼虫代谢分泌抗原(ML-ES)处理野生型(WT)小鼠和NLRP3基因敲除小鼠,检测、评估相关实验指标,研究结果证明ML-ES可以通过NLRP3调节DC表型,使表面CD40表达水平增加,并增强宿主Th2和Treg 反应。Gruden-Movsesijan A等[24]用旋毛虫ML-ES处理大鼠骨髓来源的 DC(BMDC)和DA大鼠,并用ELISA和流式细胞术技术检测DC表面共刺激分子及相关细胞因子的表达水平,结果表明ML-ES刺激的大鼠骨髓来源的树突状细胞(DC)不完全成熟,并在体外和体内诱导Th2反应。
2.3 调节巨噬细胞表型 巨噬细胞(Macrophages,Mφ)是组织中单核吞噬细胞的主要群体,属于先天性细胞,它可以破坏病原体、清除凋亡细胞体并调节宿主免疫应答反应[25]。根据活化状态不同通常将Mφ分为两类:经典活化巨噬细胞(M1)和交替活化巨噬细胞(M2)[26]。其中M1型巨噬细胞具有促炎作用,能够分泌高水平的TNF-α、IL-6及IL-1β等促炎细胞因子,参与抗原呈递,介导Th1免疫应答,在抗病毒、抗菌和抗寄生虫反应中非常重要[27]。相反,M2型巨噬细胞具有抑炎作用,可以被IL-4、IL-13、IL-10以及TGF-β诱导并表达丰富的甘露糖受体(CD206)、IL-1受体拮抗剂(IL1Ra)和精氨酸酶-1(arginase 1,Arg1),能限制过度炎症,抑制Th1反应,有利于伤口愈合和组织修复[28]。
旋毛虫感染宿主后在其体内发育并移行,从消化道进入淋巴系统,最后随血液迁移至肌肉组织,整个移行过程造成了机体严重的炎症反应和组织损伤,此时宿主巨噬细胞分化为M1型,M1型巨噬细胞分泌大量促炎因子,介导机体产生Th1免疫反应,以达到清除旋毛虫的目的。旋毛虫为了保护自身不被宿主清除,各阶段幼虫通过ES抗原作用于Mφ,控制Mφ分化。在肠道感染阶段,AW进入肠道上皮产生NBL,此时M1型巨噬细胞能促进AW幼虫从肠道上皮组织排出,有利于旋毛虫感染;在移行阶段和形成包囊阶段,旋毛虫NBL和ML则抑制M1型巨噬细胞细胞因子的产生,促进M2型巨噬细胞相关标志物的表达,调节Mφ表型向M2型极化,以抑制抗炎症反应和Th1型免疫应答,促进损伤组织的愈合,从而逃避宿主免疫系统的清除。Sun Q等[29]用流式细胞术和免疫荧光技术检测旋毛虫感染小鼠在不同感染阶段的不同组织中巨噬细胞激活的动态变化。结果显示,旋毛虫感染在肠内阶段,巨噬细胞向M1表型极化,M1型巨噬细胞在这一时期的成虫排出中发挥重要作用;但在NBL迁移和包囊形成阶段,组织和免疫器官中的巨噬细胞以M2型被激活,其主要功能可能倾向于促进组织修复和协助旋毛虫免疫逃逸。Wu J等[30]用旋毛虫幼虫衍生的细胞外小泡(EV)与宿主相互作用,结果发现旋毛虫幼虫衍生的EVs表达的miR-1-3p和let-7-5p,可以促进骨髓巨噬细胞向M2b型的极化。Kang SA等[31]用旋毛虫ES抗原预处理骨髓源性巨噬细胞,并将其转移到小鼠体内,以制备小鼠疾病模型,结果发现,旋毛虫ES蛋白抑制M1型巨噬细胞(M1)中iNOS的表达,诱导M2型巨噬细胞极化。
3 免疫隔离
当寄生虫寄生于宿主免疫系统相对隔离部位(如脑、眼、淋巴结)或侵入宿主细胞内(如红细胞、巨噬细胞),使宿主不对寄生虫产生免疫反应的现象叫做免疫隔离。在包囊形成阶段,旋毛虫NBL迁移到宿主肌肉组织中,并侵入肌肉细胞内,NBL在肌肉细胞内迅速生长发育,整个过程导致宿主肌肉细胞严重损伤,从而激活宿主卫星细胞(成肌细胞)。宿主成肌细胞在正常生理状态下会增殖和再分化为新的肌肉细胞,修复肌肉组织损伤和凋亡。而旋毛虫感染能够抑制这一过程,使成肌细胞增殖、分化相互融合或与虫体侵入的肌肉细胞融合形成另一种细胞—保姆细胞(nurse cell,NC)[32]。幼虫“隐藏”在NC内,成为肌期幼虫,以逃避宿主的免疫清除[33]。此外,由于旋毛虫入侵肌肉细胞会诱导宿主肌肉细胞自噬,宿主细胞可以通过自噬清除寄生虫[34]。自噬是一种基本的代谢过程,通过溶酶体系统降解非必需或功能失调的细胞成分或外源微生物,以实现细胞稳态和保护[35]。因此,在旋毛虫ML期间,虫体没有完全处于静息状态,而是不断向包囊周围释放ES抗原。ES抗原不断刺激宿主的免疫系统与免疫活性以及细胞间的相互作用,上调或下调自噬相关因子,以逃避宿主的自噬清除,并为其在包囊内长期存活提供适宜的生存环境,实现对宿主长期的慢性感染 。郭琨等[36]以 C2C12 细胞系作为细胞模型,用不同浓度的旋毛虫肌幼虫粗提物(Trichinellaspiralismuscle larvae crude worm extract,TMCWE)刺激 C2C12 细胞,通过检测 C2C12 细胞增殖分化相关因子及信号通路,在体外评估 TMCWE 对小鼠成肌细胞增殖与分化的影响,结果显示TMCWE能直接或通过激活PI3K/AKT/NF-κB 信号通路促进成肌细胞增殖和分化以及干扰 NC 的形成。Hu X等[37]为了探究ML-ES抗原对成肌细胞自噬的影响,体外培养C2C12细胞建立成肌细胞模型,体内用不同剂量的旋毛虫感染BALB/c小鼠,电镜观察旋毛虫感染小鼠膈肌自噬体的产生,采用qPCR和Western blotting等技术检测体内和体外自噬特异性标志物表达水平的变化。结果显示,旋毛虫感染诱导宿主肌肉细胞自噬,而旋毛虫ML-ES抗原则能够抑制成肌细胞的自噬。
4 结 语
作为我国生猪屠宰必检项目之一,旋毛虫病严重危害生猪的生长和发育,且很容易通过食物链进入人类体内,严重威胁人类健康和我国生猪养殖产业,而对于旋毛虫免疫逃避机制的研究有利于阻断旋毛虫病的传播及消灭旋毛虫。因此,通过总结近年来国内外学者的相关研究,本文从抗原变异、免疫调节和免疫隔离3个方面简述了旋毛虫免疫逃避机制的研究进展,其中对旋毛虫各阶段异性抗原及免疫调节作用的研究较多,而对于免疫隔离逃避机制的相关研究则较少。目前市场上还没有针对旋毛虫病的特效药,对于旋毛虫病的治疗,一般选用阿苯达唑和甲苯咪唑,但这类药物对NC中的旋毛虫ML不起作用,因此研究影响旋毛虫形成免疫隔离的关键因子,对阻止包囊的形成,以及治疗旋毛虫病新药物的研制都起到促进作用。
利益冲突:无

