环状RNA circ-TAGLN在卵巢癌细胞中的表达及对卵巢癌细胞增殖和侵袭的影响
刘毅力,郭 冲,尹 恒,刘 洋
(1.湖北医药学院附属太和医院妇产中心,湖北 十堰 442000;2.昆明医科大学第一附属医院肿瘤科,云南 昆明 650032)
2023年全球癌症统计结果表明,卵巢癌的发病率位于女性生殖系统恶性肿瘤第3位,并且是全球病死率最高的恶性肿瘤之一[1]。早期卵巢癌患者并无明显的临床表现,因而多数卵巢癌患者出现症状时已处于中晚期[2]。目前,针对卵巢癌的治疗策略有限,患者往往疗效较差、生存期较短[3]。探究卵巢癌细胞生长和侵袭的分子机制,有助于筛选有效、安全的分子治疗靶点。环状RNA(circRNA)是一类呈封闭环状结构的非编码RNA,长度通常小于2000个碱基,由外显子序列经过反向首尾拼接而成[4]。circRNA不含游离的末端,因而其结构稳定,在人体细胞中具有较高的保守性[5]。大量研究[6-7]表明,circRNA在骨肉瘤、喉癌、胶质瘤等很多肿瘤组织中异常表达,影响肿瘤细胞的增殖、化疗敏感性、侵袭等行为。circRNA在卵巢癌中的表达和功能具有重要临床研究价值。circ-TAGLN基因组位于人染色体11q23.3区域,其由第3号和4号两个相邻的外显子反向首尾连接形成。然而,circ-TAGLN是否影响肿瘤如卵巢癌的发生、发展并不清楚。本研究主要分析circ-TAGLN在卵巢癌细胞系中表达,通过改变卵巢癌细胞中circ-TAGLN的表达,利用细胞功能实验探索circ-TAGLN在卵巢癌细胞中的功能及其作用机制。
1 材料与方法
1.1 细胞和试剂 正常卵巢上皮细胞IOSE80和卵巢癌细胞系SK-OV-3、OC3、Caov-3、A2780、HO-8910购于中国科学院上海细胞库;细胞培养基、胎牛血清购于美国Invitrogen公司;Trizol试剂、Lipofectamine 3000购于日本TaKaRa公司;RT-qPCR试剂盒购于广州锐博生物有限公司;miR-NC mimic、miR-425-5p mimic、双荧光素酶载体购于上海碧云天生物科技公司;pcDNA3.1对照质粒和pcDNA3.1-circ-TAGLN质粒购于上海吉玛制药技术有限公司;Transwell小室和细胞裂解液购自美国Corning公司;双荧光素酶活性试剂盒和基质胶购自北京索莱宝科技有限公司;p-PI3K兔单克隆抗体、p-AKT兔单克隆抗体、p-mTOR兔单克隆抗体、β-tubulin兔单克隆抗体、VEGF兔单克隆抗体、eNOS兔单克隆抗体购于英国Abcam公司。
1.2 细胞培养与转染 将IOSE80、K-OV-3、Caov-3、A2780、HO-8910细胞培养在DMEM培养基中,将OC3细胞培养在RPMI-1640培养基中,每100 ml培养基中添加12 ml胎牛血清。SK-OV-3细胞汇合度为60%时,通过Lipofectamine 3000试剂分别转染pcDNA3.1对照质粒和pcDNA3.1-circ-TAGLN质粒,分别命名为NC组和circ-TAGLN组。
1.3 RT-qPCR法检测circ-TAGLN和miR-425-5p表达 利用Trizol试剂提取细胞总RNA,经逆转录合成cDNA,分别加入相应引物,根据RT-qPCR试剂盒说明书进行扩增,引物序列见表1。通过GAPDH和U6为内参,以2-ΔΔCt法分析circ-TAGLN和miR-425-5p相对表达量。
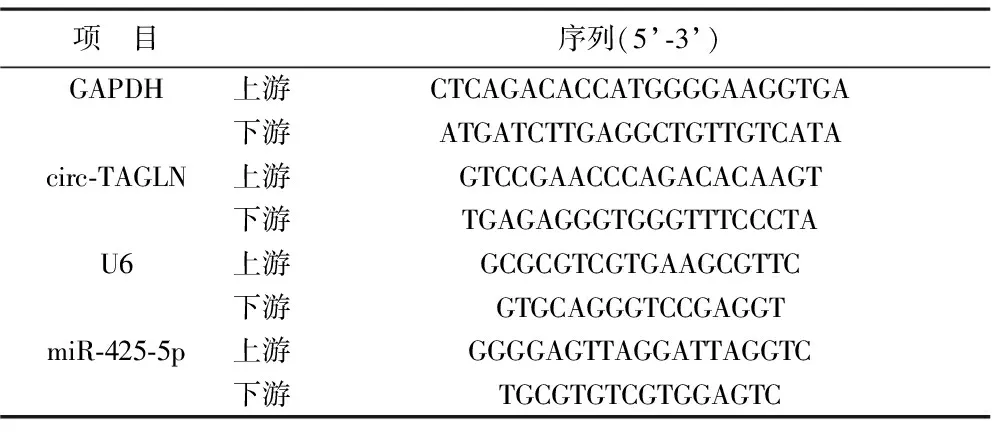
表1 RT-qPCR引物序列
1.4 平板克隆实验检测SK-OV-3细胞增殖 将NC组和circ-TAGLN组SK-OV-3细胞消化、离心、计数,均匀铺在6孔板,每孔400个细胞,在培养箱中培养13 d,直到细胞克隆成团。用低温PBS溶液清洗,加入700 μl甲醇固定35 min,加入700 μl 1.2%结晶紫染色35 min。用低温PBS溶液清洗,肉眼下记录细胞克隆形成数。
1.5 Transwell实验检测SK-OV-3细胞侵袭 在Transwell上室均匀铺满基质胶,将NC组和circ-TAGLN组SK-OV-3细胞消化、离心、计数,均匀铺在Transwell上室,每孔6×104个细胞。Transwell下层加600 μl含15%胎牛血清的培养基。培养箱培养24 h后,用低温PBS溶液清洗,加入700 μl甲醇固定35 min,加入700 μl 1.2%结晶紫染色35 min。显微镜(×100)下拍照,记录侵袭细胞数,比较各组细胞的侵袭能力。
1.6 双荧光素酶报告实验验证circ-TAGLN与miR-425-5p的靶向关系 分别采用双荧光素酶载体构建circ-TAGLN野生型报告质粒(WT-circ-TAGLN)和突变型报告质粒(MUT-circ-TAGLN),取对数生长期的SK-OV-3细胞,按照Lipofectamine 3000转染试剂盒说明书将WT-circ-TAGLN、MUT-circ-TAGLN分别与miR-NC和miR-425-5p转染到SK-OV-3细胞。常规转染45 h后,通过双荧光素酶报告基因试剂盒分析每孔SK-OV-3细胞的荧光素酶活性。
1.7 Western blot检测SK-OV-3细胞中PI3K/AKT信号通路蛋白表达 经细胞裂解液裂解NC组和circ-TAGLN组SK-OV-3细胞,高速离心提取总蛋白,经8% SDS-PAGE胶电泳、聚偏二氯乙烯膜转膜、牛血清白蛋白封闭后,TBST溶液洗涤45 min。加入一抗p-PI3K(1∶2000)、p-AKT(1∶1000)、p-mTOR(1∶3000)、β-tubulin(1∶4000)、VEGF(1∶3000)、eNOS(1∶3000),3 ℃处理13 h。TBST溶液洗涤45 min,加入羊抗兔二抗(1∶9000)处理3.5 h,TBST溶液洗涤45 min,采用化学发光法显影、拍照。
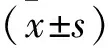
2 结 果
2.1 circ-TAGLN在卵巢癌细胞系中的表达比较 RT-qPCR结果显示(图1),卵巢癌细胞系SK-OV-3、OC3、Caov-3、A2780、HO-8910中circ-TAGLN表达低于IOSE80细胞(均P<0.05),SK-OV-3细胞中circ-TAGLN表达相对较低,因此选择SK-OV-3细胞进行过表达实验(P<0.01)。
注:与IOSE80细胞相比,*P<0.05,**P<0.01
2.2 过表达circ-TAGLN后SK-OV-3细胞的增殖情况 利用脂质体转染过表达SK-OV-3细胞中circ-TAGLN的表达,NC组与circ-TAGLN组中circ-TAGLN相对表达量分别为(1.01±0.34)和(7.56±1.07),circ-TAGLN组SK-OV-3细胞中circ-TAGLN表达高于NC组(均P<0.01)。平板克隆实验结果显示(图2),NC组和circ-TAGLN组克隆数量分别为(116.00±11.16)个和(40.29±7.65)个,与NC组相比,circ-TAGLN组SK-OV-3细胞增殖能力被抑制(均P<0.01)。
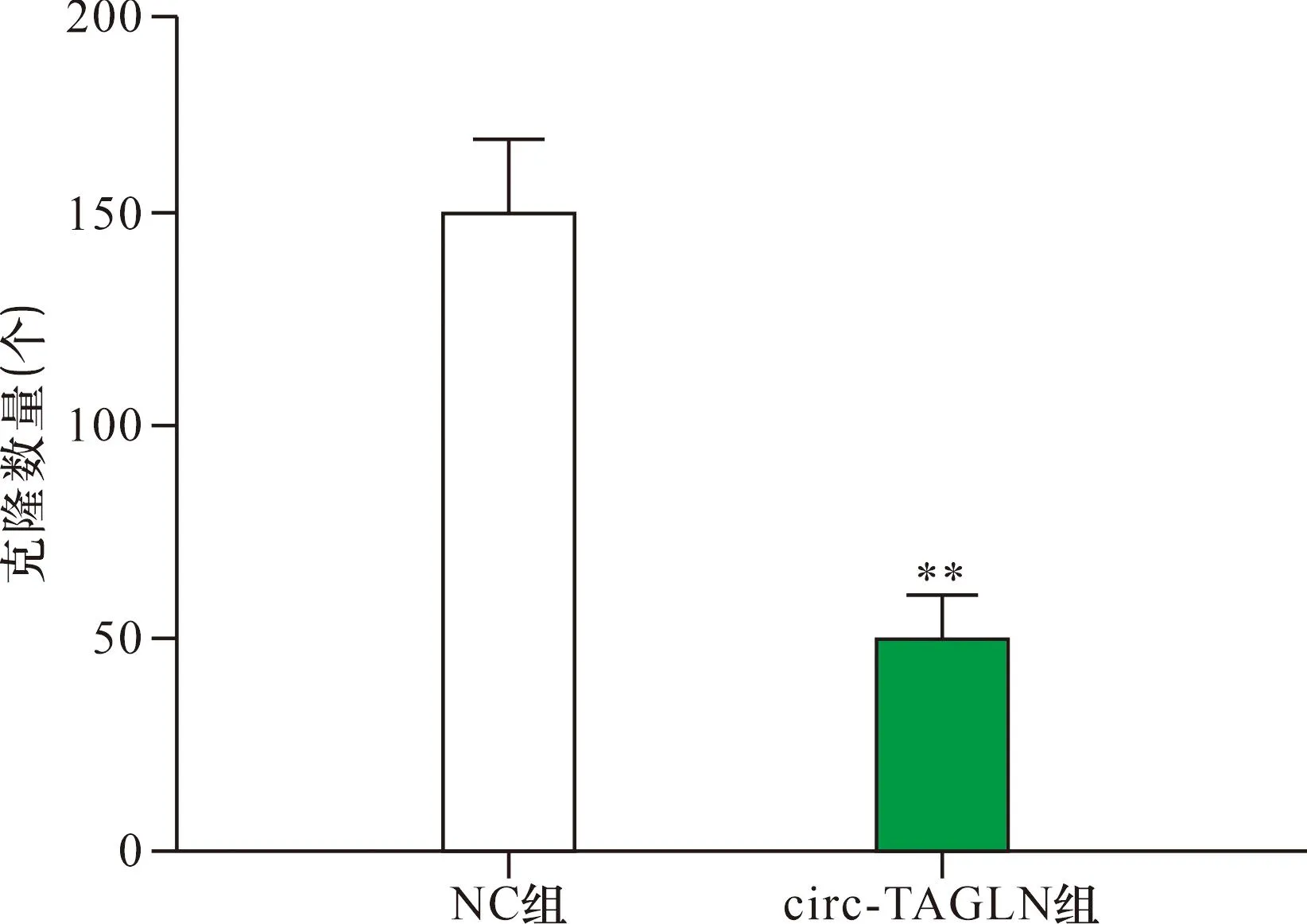
注:与NC组相比,**P<0.01
2.3 过表达circ-TAGLN后SK-OV-3细胞的侵袭情况 Transwell实验结果显示(图3),NC组和circ-TAGLN组侵袭细胞数分别为(52.13±5.75)个和(15.95±3.49)个,两组侵袭细胞数比较,差异有统计学意义(P<0.01)。表明与NC组相比,circ-TAGLN组SK-OV-3细胞侵袭能力被抑制。

注:与NC组相比,**P<0.01
2.4 circ-TAGLN与miR-425-5p之间的靶向关系 双荧光素酶报告实验结果显示(图4),在WT质粒共转染中,与miR-NC组比较,miR-425-5p组相对荧光素酶活性明显降低(P<0.01);在MUT质粒共转染中,miR-NC组和miR-425-5p组相比,相对荧光素酶活性的差异没有统计学意义(P>0.05)。

注:与miR-NC组相比,**P<0.01
2.5 过表达circ-TAGLN后SK-OV-3细胞中miR-425-5p表达 RT-qPCR检测结果显示,NC组与circ-TAGLN组SK-OV-3细胞中miR-425-5p表达分别为(5.57±0.91)和(1.01±0.17),与NC组相比,过表达circ-TAGLN后SK-OV-3细胞中miR-425-5p表达被抑制,两组表达量比较具有统计学差异(P<0.01)。
2.6 过表达circ-TAGLN后SK-OV-3细胞中PI3K/AKT信号通路蛋白表达 Western blot检测显示,与NC组相比,过表达circ-TAGLN的SK-OV-3细胞中PI3K/AKT信号通路蛋白p-PI3K、p-AKT、p-mTOR、VEGF、eNOS的表达水平明显降低,两组表达量比较具有统计学差异(均P<0.01),见表2。
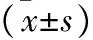
表2 Western blot检测SK-OV-3细胞中PI3K/AKT信号通路蛋白表达
3 讨 论
卵巢癌是严重影响女性生殖健康的恶性肿瘤,外科手术、放疗和化疗等传统治疗方式并不能有效改善中晚期卵巢癌患者的预后[8]。circRNA在调节染色质的结构、基因转录、蛋白修饰等方面承担重要角色,其表达异常与糖尿病、类风湿性关节炎、肿瘤等疾病的发生有关[9]。大量研究[10-12]表明,circRNA在卵巢癌中表达升高或降低,与卵巢癌细胞的上皮间质转化、衰老、凋亡等过程密切相关。例如,circ-SETDB1在紫杉醇耐药的卵巢癌中高表达,敲低circ-SETDB1可抑制紫杉醇耐药性卵巢癌细胞的增殖活力、细胞周期进展,诱导细胞凋亡以及对紫杉醇的敏感性,miR-508-3p是circ-SETDB1的靶标[13]。例如,卵巢癌组织和细胞系中circ-CERS6表达显著降低,过表达circ-CERS6能够通过作用于miR-630抑制卵巢癌细胞的增殖、迁移、侵袭和上皮间质转化[14]。
为了研究circ-TAGLN在卵巢癌进展中的功能,本研究通过RT-qPCR检测证实circ-TAGLN在多个卵巢癌细胞系中低表达。在卵巢癌SK-OV-3细胞中过表达circ-TAGLN后,SK-OV-3细胞增殖和侵袭能力均被抑制,提示circ-TAGLN表达上调可能会抑制卵巢癌的进展。随着分子生物学的发展,circRNA已被证实富含miRNA的互补位点,circRNA能够发挥miRNA的海绵作用,诱导miRNA的表达沉默,进而在肿瘤的发生、进展过程发挥关键作用[15-17]。本研究利用circAtlas数据库预测显示,circ-TAGLN与miR-425-5p之间存在结合位点。经双荧光素酶报告实验证实,circ-TAGLN能够靶向结合miR-425-5p。在卵巢癌SK-OV-3细胞中过表达circ-TAGLN后,miR-425-5p表达显著降低。miR-425-5p是miR-425成熟体的一种,已被证实在结直肠癌、乳腺癌、非小细胞肺癌等实体瘤中表达上调,miR-425-5p能够促进恶性肿瘤细胞的增殖和侵袭,抑制细胞凋亡,同时提示患者预后较差[18-20]。ZHAO等[21]研究表明,卵巢癌组织和细胞中miR-425-5p高表达,沉默miR-425-5p表达可有效抑制卵巢癌进展。以上结果表明,circ-TAGLN通过下调miR-425-5p表达抑制卵巢癌细胞的增殖和侵袭。卵巢癌细胞中PI3K/AKT信号通路存在异常激活,miR-425-5p则通过活化PI3K/AKT信号通路促进肿瘤的发生和发展[22-25]。在卵巢癌SK-OV-3细胞中过表达circ-TAGLN后,PI3K/AKT信号通路蛋白表达均显著下降,进一步表明circ-TAGLN通过miR-425-5p发挥肿瘤抑制作用。
综上所述,本研究证实circ-TAGLN在卵巢癌细胞系中低表达,过表达circ-TAGLN通过调控miR-425-5p/PI3K/AKT信号通路抑制卵巢癌细胞的增殖和侵袭,circ-TAGLN有望成为卵巢癌的潜在分子治疗靶点。

