乳腺癌术后恶性胸腔积液临床特征及预后Cox回归分析
郭倩倩,苏志勇
(1.锦州医科大学赤峰学院研究生培养基地,内蒙古 赤峰 024000;2.赤峰学院附属医院,内蒙古 赤峰 024000)
乳腺癌发病率占女性肿瘤首位,严重影响女性恶性身体健康,危及女性生命安全[1]。据国际癌症研究中心相关数据统计结果显示,全球范围内,女性乳腺癌年新发病例达170万左右,占女性恶性肿瘤的25%[2]。随着现阶段临床乳腺癌治疗手段的进展,手术、内分泌治疗、放化疗、分子靶向生物治疗等日趋成熟,患者生存率得到大幅度提升[3]。乳腺癌晚期阶段,约有10%的患者发生胸腔积液,患者胸膜受累,导致淋巴引流障碍,从而引起恶性胸腔积液,胸膜转移灶增加了胸膜渗透性,刺激胸腔积液产生[4-5]。胸腔积液的发生在一定程度上影响了机体呼吸循环系统,可导致呼吸力学、血流动力学等异常,中大量胸腔积液更是可引起患者呼吸困难,严重时甚至可导致呼吸衰竭,病死率较高,预后较差[6-7]。本研究分析乳腺癌术后恶性胸腔积液患者临床特征,通过Cox回归法分析患者预后影响的因素,旨在为临床疾病治疗和预后评估提供参考。
1 对象与方法
1.1 研究对象 回顾性分析2015年2月至2020年3月收治103例乳腺癌术后恶性胸腔积液患者的临床资料,年龄34~77岁,平均(60.08±7.93)岁;肿瘤发生部位:左侧54例,右侧49例;肿瘤位置(象限):内上15例,外上72例,内下7例,外下9例;病理类型:浸润性导管癌78例,浸润性小叶癌16例,导管内癌9例。病例纳入标准:①符合《中国抗癌协会乳腺癌诊治指南与规范》乳腺癌的诊断[8];②伴胸腔积液,胸腔穿刺胸水细胞学涂片证实为恶性积液,排除非肿瘤病因;③女性患者;④临床资料完整。排除标准:①合并其他原发恶性肿瘤;②妊娠或哺乳期;③合并免疫或血液系统疾病;④合并严重脏器功能不全。
1.2 研究方法
1.2.1 患者临床资料采集:①一般资料:性别、年龄、既往病史、卡氏功能状态(KPS)评分等;②辅助检查:生化指标、血常规、影像学检查等;③病情评估;④相关药物使用;⑤胸腔积液控制情况;⑥预后状态。通过影像学结果评估胸腔积液水平:按CT横断面上胸腔积液最大深度评估,最大深度≤2 cm为少量积液;最大深度>2 cm且<1/2胸腔为中量积液;最大深度≥1/2胸腔为大量积液。预后营养指数=血清白蛋白(g/L)+5×外周血淋巴细胞总数(×109/L)。
1.2.2 治疗方法:按常规临床路径予以干预,包括胸腔穿刺、小导管引流后药物灌注,灌注药物包括:铂类与非铂类药物、中成药制剂、生物免疫抑制剂等,胸腔积液穿刺引流及疾病基本控制后,开展全身静脉化疗。
1.3 疗效评估与预后评估 采用WHO胸腔积液疗效标准[9],完全缓解:积液完全消失,胸膜腔闭合或大部分粘连,无积液持续4周以上;部分缓解:积液减少50%,症状改善明显,胸膜腔被纤维素包裹,残留积液4周无增长;稳定:未达上述标准,但胸腔积液无增加持续4周以上;进展:积液较原来增加。预后评估:统计患者生存情况,以乳腺癌合并胸腔积液确诊后开始计算,随访终点为患者死亡或随访至12个月。
1.4 统计学方法 使用SPSS 23.0统计学软件处理数据。样本率的比较采用χ2检验;生存分析采用Kaplan-Meier法作生存曲线,采用Log-Rank检验比较差异性水平;以Cox回归分析乳腺癌胸腔积液患者预后的影响因素;P<0.05为差异有统计学意义。
2 结 果
2.1 临床特征 103例乳腺癌术后恶性胸腔积液患者,单侧积液58例,双侧积液45例;少量积液13例,中量积液41例,大量积液49例;临床表现包括:发热12例(11.65%),咳嗽91例(88.35%),咳痰66例(64.08%),胸痛74例(71.84%),气促83例(80.58%),咯血2例(1.94%);临床体征包括:胸廓饱满2例(1.94%),胸膜摩擦感1例(0.97%),两侧呼吸运动度异常31例(30.10%),语颤异常37例(35.92%),叩诊音异常84例(81.55%),胸膜摩擦音1例(0.97%),干性啰音1例(0.97%),湿性啰音32例(31.07%)。
2.2 乳腺癌恶性胸腔积液患者预后生存分析 Kaplan-Meier曲线分析生存情况,结果显示患者中位生存时间为10.0个月,6个月生存率为62.14%,1年生存率为38.83%,见图1。
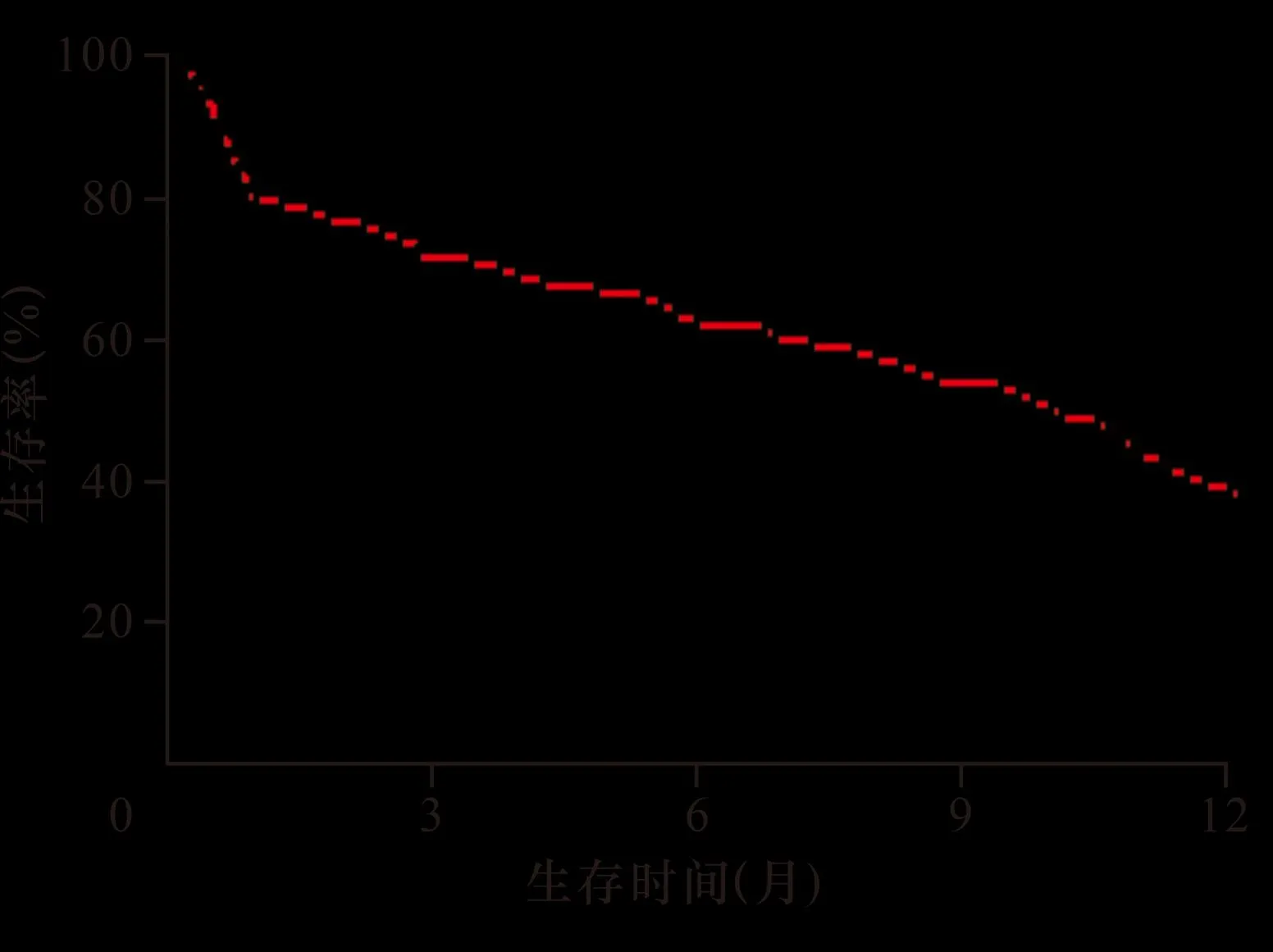
图1 随访1年Kaplan-Meier曲线生存分析
2.3 不同临床特征乳腺癌恶性胸腔积液患者预后生存分析 不同年龄、病理类型、积液部位、积液颜色乳腺癌恶性胸腔积液患者中位生存时间比较差异有统计学意义(P>0.05);KPS评分≥80分、积液量中少量、胸腔积液控制时间<4周、预后营养指数<45、血清乳酸脱氢酶(LDH)水平≤400 U/L乳腺癌恶性胸腔积液患者中位生存时间大于KPS评分<80分、积液量大量、胸腔积液控制时间≥4周、预后营养指数≥45、血清LDH水平>400 U/L患者(P<0.05)。见表1。
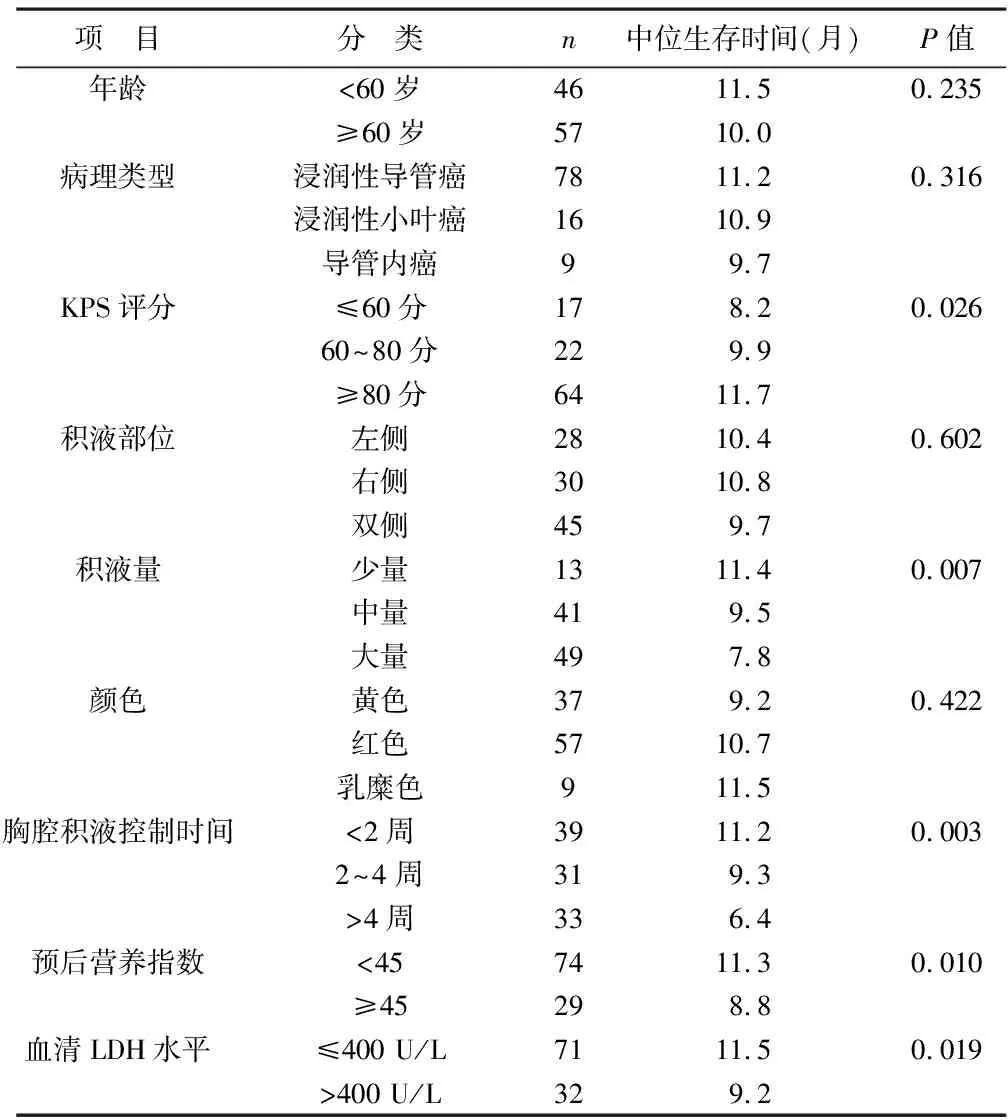
表1 不同临床特征乳腺癌恶性胸腔积液患者预后生存分析
2.4 影响乳腺癌恶性胸腔积液患者预后的多因素Cox分析 将差异有统计学意义项纳入Cox回归模型,以生存时间作为因变量,并进行赋值,KPS评分(≤60分=0,60~80分=1,≥80分=2),积液量(少量=0,中量=1,大量=2)、胸腔积液控制时间(<2周=0,2~4周=1,>4周=2)、预后营养指数(<45=0,≥45=1)、血清LDH水平(≤400 U/L=0,>400 U/L=1),带入至多元Cox回归模型中,最终得出影响乳腺癌恶性胸腔积液患者生存时间的因素包括:KPS评分、积液量、胸腔积液控制时间、预后营养指数、血清LDH水平。见表2。

表2 影响乳腺癌恶性胸腔积液患者预后的多因素Cox分析
3 讨 论
乳腺癌由多种因素综合作用导致,包括饮食、遗传、辐射、激素、良性病变等[10]。胸腔积液的发生既可作为恶性肿瘤首发症状,也可以是疾病术后复发伴发症状[11]。乳腺癌患者恶性胸腔积液发生后,可引起严重气促、胸闷症状的发生,若合并心、肺等脏器障碍,则会严重影响患者预后[12]。既往研究[13]显示,乳腺癌患者恶性胸腔积液发生后,若未得到及时有效处理,1个月病死率高达29%~50%。因此有效控制患者恶性胸腔积液体征,在乳腺癌的综合治疗中具有重要地位[14]。
本研究103例乳腺癌合并胸腔积液可表现为不同程度的发热、咳嗽、咳痰、胸痛、气促等症状,行胸腔穿刺置管术后,症状缓解。胸腔积液常发生于乳腺癌同侧,本研究中包括单侧积液58例,双侧积液45例。胸腔积液患者就诊时需进行体格检查,尤其是胸部查体,包括胸部视、触、叩、听等[15]。本研究中乳腺癌恶性胸腔积液患者主要临床特征包括两侧呼吸运动度异常31例(30.10%),语颤异常37例(35.92%),叩诊音异常84例(81.55%),湿性啰音32例(31.07%)。
本研究绘制Kaplan-Meier曲线分析,结果显示患者中位生存时间为10个月,略高于YEU等[16]研究,且6个月生存率为62.14%,1年生存率为38.83%,提示乳腺癌恶性胸腔积液患者生存率较低。进一步分析患者预后影响因素,KPS 评分为机体功能重要表现。多项研究[17]表明,无论在术前还是术后KPS评分高,对癌症患者均是预后有利因素。本研究也显示,KPS评分≥80分患者中位生存时间长于<80分患者,KPS评分是影响乳腺癌恶性胸腔积液患者预后的独立危险因素。此外,本研究中Cox分析结果显示胸腔积液量影响患者预后,患者中位生存时间随胸腔积液量增加而缩短,这可能是由于随着胸腔积液量的增加,患者发生急性呼吸窘迫综合征、休克等的风险也随之增加,预示患者不良预后[18-19]。有效的治疗可改善预后,本研究还显示,胸腔积液控制时间<2周者中位生存时间为11.2个月,2~4周者为9.3个月,>4周者为6.4个月,较4周控制患者,4周积液未被控制是患者不良预后独立危险因素,故胸腔积液快速控制可有效改善患者症状体征,避免持续呼吸困难导致病情加重,从而改善预后[20]。本研究显示,预后营养指数是乳腺癌恶性胸腔积液患者预后影响因素,营养状态较差者不良预后风险较大,究其原因可能为预后营养指数较高者,往往并发症罹患风险增加,恢复较慢,增加了死亡风险[21]。胸腔积液患者病情进展快,通常需予以积液抽吸,易引起营养物质丢失、水电解质紊乱,因此治疗过程中应注意血生化指标检测,及时予以营养补充[22]。LDH在胸腔积液良恶性鉴别中敏感度较高,LDH升高可能与肿瘤高负荷相关[23-24]。JIN等[25]将74例肺腺癌伴恶性胸腔积水患者纳入研究,结果提示LDH大于500 U/L患者生存时间相较于LDH小于500 U/L患者生存时间短。本研究也显示LDH高表达预示乳腺癌恶性胸腔积液患者不良预后,检测胸水中LDH表达可作为乳腺癌恶性胸腔积液患者预后的生物标志物之一,乳腺癌患者胸水LDH 升高可能跟糖酵解氧化磷酸化为肿瘤细胞提供能量相关。
综上所述,乳腺癌患者恶性胸腔积液经综合治疗多数能有效控制,KPS评分、积液量、胸腔积液控制时间、预后营养指数、血清LDH水平均可对患者生存时间造成影响。

