双水相法萃取平菇蛋白及性质研究
谢慧贤,王 猛,张英男,杨智涞
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏省食用菌保鲜与深加工工程研究中心,江苏南京 210023)
平菇(Pleurotus ostreatus)又称蚝菇或牡蛎菇,是我国当前栽培产量最高的四大食用菌品种之一[1]。菇中含有丰富的营养物质,尤其是蛋白质。平菇蛋白作为一种优质的蛋白质来源,具有高蛋白含量、良好的氨基酸组成和多样化生物活性等特点,在食品工业、保健品及药物研究等领域具有广泛的应用潜力。研究表明每100 g 干平菇中蛋白质含量高达19~26 g[2],必需氨基酸含量充足,符合联合国粮食组织与世界卫生组织(FAO/WHO)对于氨基酸组成的推荐[3]。与动物和植物蛋白质相比,平菇蛋白质具有较强的热稳定性、耐酸碱性及高效的降解活性,适用于投入工业化生产,作为开发功能性或特色食品的潜在来源[4-5]。
碱提酸沉法是目前常用的蛋白质提取方法之一,该方法成本低,但在工业化生产中大量使用酸碱造成环境污染,此外高浓度碱液易产生有害物质及发生不可逆变性,蛋白生物活性丧失,营养价值下降[6]。双水相体系(Aqueous two-phase system,ATPS)是一种分离和纯化生物分子的分离技术,是基于聚合物(如聚乙二醇,PEG)与无机盐(如硫酸铵,(NH4)2SO4)间不相容性造成两相分配系数差异而实现分离的[7],通常可通过调整聚合物与无机盐浓度来优化相分配系数,从而提高萃取效率。双水相萃取具有以下优点:操作条件温和,双水相萃取通常在室温下进行,不使用有机溶剂,能够有效保护蛋白质生物活性[8];能够快速分离,耗时短[9],体系具有低毒性等[10-12]。目前已有双水相体系应用于藻蓝蛋白等[13-14]天然食品的分离纯化工作。近几年来,王莹等[15]应用PEG4000-(NH4)2SO4双水相体系萃取分离香菇柄水提液中的多糖与蛋白质,蛋白萃取率达81.57%;Menegotto 等[16]通过使用柠檬酸钠和乙醇ATPS 和膜分离(MSP)萃取旋藻蛋白,旋藻蛋白的萃取率为87%。
本实验利用双水相技术提取平菇中的蛋白质成分,通过单因素实验和响应面分析,系统地优化了平菇蛋白的提取工艺条件,获得了较高提取效率和纯度,实现了高产高质的平菇蛋白提取,具有一定创新性。本实验探究了平菇蛋白的结构和性质,建立食用菌蛋白质提取和评价的新方法,希望为解决传统方法在平菇蛋白提取方面的局限性和不足之处提供参考。此外,双水相体系具有分离提纯效率高、易于放大生产和连续操作等特点,本实验充分发挥了双水相体系分离技术在平菇蛋白提取中的优势,为平菇蛋白在食品工业中的应用开辟了新的可能性。
1 材料和方法
1.1 材料与仪器
平菇粉 江苏兴化市品灿食品有限公司;大豆油 南京市区超市;聚乙二醇(PEG800、PEG2000、PEG4000、PEG8000)、硫酸铵、盐酸、氢氧化钠等其他普通试剂 分析纯,均为国药集团化学试剂有限公司;考马斯亮蓝G-250、牛血清白蛋白 北京索莱宝科技有限公司;双蒸水 生工生物工程股份有限公司;考马斯亮蓝染色液、脱色液 上海碧云天生物技术有限公司。
PHB-4-pH 计 上海精密科学仪器有限公司;FS-2 高速分散器 东方医疗器械公司;LABCONCO冷冻干燥机 北京照生仪器设备有限公司;Spectra-Max Plus 384 全波长酶标仪 美谷分子仪器有限公司;H1650-W 台式高速离心机 湖南湘仪实验室仪器开发有限公司;日立L-8900 全自动氨基酸分析仪上海林理仪器有限公司;日立TM3000 台式扫描电镜 上海思耐达精密仪器公司;PE SP 2 傅里叶红外光谱仪 天津博天胜达科技发展有限公司。
1.2 实验方法
1.2.1 平菇蛋白粗提液制备 将平菇粉以1:20 的料液比(w/v)溶于超纯水,用1 mol/L NaOH 溶液调节至pH=10,在50 ℃下热水浴2.5 h 后,3000×g 离心20 min,取上清液,放入4 ℃冰箱备用[15]。
1.2.2 双水相体系相图的绘制 采用浊点法[17]绘制PEG-(NH4)2SO4双水相体系相图。计算PEG、(NH4)2SO4在总质量中的质量分数(w/w),以PEG质量分数为纵坐标,硫酸铵质量分数为横坐标,得到一条浊点曲线。
根据式(1)、式(2)计算PEG 及(NH4)2SO4质量分数:
式中:m1表示PEG 的质量,g;m2表示超纯水的质量,g;m3表示(NH4)2SO4的质量,g;yPEG表示PEG 的质量分数,%;表示(NH4)2SO4的质量分数,%。
1.2.3 双水相萃取平菇蛋白单因素实验 本研究考察了PEG 分子量、PEG2000 质量分数、(NH4)2SO4质量分数、蛋白粗提液质量分数(即加入的蛋白粗提液占双水相萃取体系的比例)这四个因素对ATPS萃取平菇蛋白的影响。将蛋白粗提液加入PEG-(NH4)2SO4体系中,用超纯水补余至10 g,固定pH6.5,振荡混合均匀后室温下静置30 min 至完全分相。以蛋白萃取浓度及萃取率评估萃取效果。
为了确定萃取平菇蛋白的最适PEG 分子量(800、2000、4000、6000、8000 Da),依据双水相图选择质量分数为30%的不同分子量的PEG,(NH4)2SO4质量分数为20%和蛋白粗提液质量分数20%进行单因素实验;为了探究PEG2000 质量分数(15%、20%、25%、30%、35%、40%)对萃取效果的影响,固定(NH4)2SO4质量分数为20%,蛋白粗提液质量分数20%,进行单因素实验;为了探究(NH4)2SO4质量分数(17%、19%、21%、23%、25%)对萃取效果的影响,固定PEG2000 质量分数为20%,蛋白粗提液质量分数为20%,进行单因素实验;为了探究蛋白粗提液质量分数(15%、18%、21%、24%、27%)对萃取效果的影响,固定PEG2000 质量分数为20%,(NH4)2SO4质量分数为21%,进行单因素实验。
1.2.4 响应面法优化平菇蛋白的双水相萃取条件在单因素实验的基础上,运用Design-Expert8.0.6 软件,依据Box-Behnken 设计原理,以A(PEG2000 质量分数)、B((NH4)2SO4质量分数)、C(蛋白粗提液质量分数)为自变量,以平菇蛋白萃取浓度为响应值评估萃取效果,设计3 因素3 水平的响应面优化试验。具体的试验因素、水平及编码见表1。

表1 响应面试验因素水平设计Table 1 Response surface test factor level design
1.2.5 平菇蛋白含量测定及萃取率计算 在PEG 2000-(NH4)2SO4双水相体系中,体系混合均匀后静置,待分相后读取上下相体积,分别从上下相取样测定平菇蛋白的萃取率和蛋白萃取浓度。蛋白萃取浓度采用Bradford 法测定。
根据式(3)、式(4)分别计算平菇蛋白得率(Y)及在上相中的萃取率(E):
式中:C上表示体系上相平菇蛋白的浓度,mg/mL;C下表示下相平菇蛋白的浓度,mg/mL;V上表示上相的体积,mL;V下表示下相的体积,mL;m 表示经ATPS 萃取得到的平菇蛋白质量,g;M 表示平菇干粉的质量,g。
1.2.6 平菇蛋白理化性质的测定
1.2.6.1 SDS-PAGE 表征平菇蛋白 SDS-PAGE 预制胶(浓缩胶5%,分离胶12%),在5%浓缩胶中电泳(80 V,30 min),然后在12%分离胶中电泳(120 V,60 min)。电泳结束后用考马斯亮蓝染色液快速染色2 h,最后反复脱色至条带清晰可见。
1.2.6.2 氨基酸组成分析 采用全自动氨基酸分析仪测定平菇蛋白的氨基酸组成。按照GB 5009.124-2016 方法进行测定。
1.2.6.3 微观形貌及粒径分布分析 利用扫描电镜扫描平菇蛋白形貌特征;利用动态光散射仪测定平菇蛋白粒径分布。
1.2.6.4 傅里叶红外光谱分析 取干燥样品1.00 mg与100 mg KBr 混合研磨,放入仪器中扫描,区间为4000~400 cm-1波数范围测定吸收光谱,分辨率4 cm-1,扫描16 次。
1.2.7 平菇蛋白功能性质的测定
1.2.7.1 平菇蛋白等电点及溶解度的测定 参照李晓明等[18]的方法并稍作改动。配制2%(w/v)平菇蛋白溶液,加入0.1moL/L 的HCl 溶液或0.1moL/L 的NaOH 溶液调节蛋白溶液pH 至3.2、3.4、3.6、3.8、4.0、4.2、4.4、4.6、4.8,涡旋使蛋白充分溶解,以2500×g 离心10 min,取上清液用Bradford 法测定平菇蛋白含量。上清液吸光值最低的溶液,其pH 即为平菇蛋白等电点;参照Lee 等[19]的方法并稍作改动,配制2%(w/v)平菇蛋白溶液,加入0.1moL/L 的HCl 溶液或者0.1moL/L 的NaOH 溶液调节蛋白溶液pH 至2.0、4.0、6.0、8.0、10.0,磁力搅拌1 h,以2500×g 离心10 min,取上清液用Bradford 法测定上清夜蛋白含量。根据式(5)计算平菇蛋白溶解度(NSI)。
1.2.7.2 乳化特性及起泡特性的测定 参照Akharume 等[20]及薛蕾等[21]的方法测定平菇蛋白乳化性及乳化稳定性。配制2%(w/v)平菇蛋白溶液,加入0.1mol/L HCl 溶液或0.1mol/L NaOH 溶液调节溶液pH 至2.0、4.0、6.0、8.0、10.0,加入等体积大豆油,在高速分散器中以10000 r/min 高速搅打2 min,随后迅速量取一定量体积于离心管中,2500×g 离心10 min,测定乳化层的高度及离心管液体总高度,然后再将离心管放入80 ℃水浴30 min,冷却至室温后以2500×g 离心10 min,测定乳化层高度。根据式(6)、式(7)计算平菇蛋白的乳化性(EAI)和乳化稳定性(ESI):
参照张思思[22]的方法测定平菇蛋白起泡性及起泡稳定性。配制2%(w/v)平菇蛋白溶液,加入0.1 mol/L HCl 溶液或者0.1 mol/L NaOH 溶液调节平菇蛋白溶液pH 至2.0、4.0、6.0、8.0、10.0,在高速分散器中10000 r/min 高速搅打2 min,随后迅速将其倒入量筒中,记录上层泡沫的体积,静置30 min 后再次记录上层泡沫体积。根据式(8)、式(9)计算平菇蛋白的起泡性(FA)及泡沫稳定性(FS):
1.2.7.3 持水性及持油性的测定 参照Tabtabaei等[23]的方法测定。按照2%(w/v)称取定量蛋白溶于超纯水/大豆油中,充分振荡摇匀,以2500×g 离心10 min,倒去上清液,测定离心管中残留物的重量。根据式(10)、式(11)分别计算平菇蛋白的持水性(WHC)及持油性(OHC):
1.3 数据处理
结果以至少三次重复处理的“平均值±标准差”表示。使用SPSS19 软件进行统计分析,采用单因素方差分析后用Duncan 法进行差异显著性比较,P<0.05,差异显著。本实验的数据采用Origin8.0 软件作图。
2 结果与分析
2.1 双水相体系确定
利用浊点法绘制了不同PEG-(NH4)2SO4双水相相图。如图1 所示,相图呈双曲线形状,浊点组成的曲线呈双节线。PEG 分子量越大,所形成的双节线越趋向原点,成相临界点浓度越低。反之,成相临界点浓度越高;曲线上方的任意浓度比可以形成ATPS,曲线下方则表示无法成相。由图1 可选择PEG 质量分数为15%~40%,(NH4)2SO4质量分数17%~25%做单因素实验范围。

图1 PEG-(NH4)2SO4 双水相体系相图Fig.1 Phase diagram of PEG-(NH4)2SO4 aqueous two-phase system
2.2 双水相法萃取单因素实验
PEG 分子量对ATPS 萃取平菇蛋白质的影响如图2a 所示,随着PEG 分子量增加,蛋白萃取浓度和萃取率均呈先升后降的趋势。当PEG 分子量为2000 时,蛋白萃取浓度和萃取率达到最大,分别为1.27 mg/mL 和92.33%,此时萃取效果最好。这是因为PEG 分子量越大,端羟基数目减小,导致极性程度减少,疏水性程度增强,相界面张力增强,亲水性蛋白质会从上相向下相富集,萃取效果下降[24];同时,PEG 分子量越大,相分离时间明显延长,萃取效果下降,该现象与PEG 粘度增大,空间位阻增强有关[24]。因此本文确定PEG 分子量为2000。

图2 双水相法萃取平菇蛋白的单因素实验Fig.2 Single factor experiments of aqueous two-phase system of Pleurotus ostreatus protein
PEG2000 质量分数对ATPS 萃取平菇蛋白质的影响如图2b 所示,随着PEG2000 质量分数增大,平菇蛋白萃取浓度和萃取率均呈先增后降趋势。当PEG2000 质量分数在15%时蛋白质溶于无机盐中,蛋白分配在下相导致萃取效果降低[25];当PEG2000在20%时,此时浓度和萃取率分别为1.43 mg/mL和94.75%,萃取效果最好。有研究表明,PEG2000质量分数越大,体系粘度越粘,不利于两相间物质转移,导致萃取效果下降[25]。故本文确定PEG2000 质量分数为20%。
(NH4)2SO4质量分数对ATPS 萃取平菇蛋白质的影响如图2c 所示,随着(NH4)2SO4质量分数增加,平菇蛋白萃取浓度呈先增后降趋势。萃取率保持在90%以上。当(NH4)2SO4质量分数为21%时,平菇蛋白萃取浓度达到最高,为1.66 mg/mL,蛋白萃取效果最好;这是因为当(NH4)2SO4质量分数较低,盐溶作用导致蛋白部分溶解在下相,萃取效果下降;而(NH4)2SO4质量分数过高,盐析作用使得蛋白质变性,萃取效果下降[26]。故本文确定(NH4)2SO4质量分数为21%。
平菇蛋白粗提液质量分数对ATPS 萃取平菇蛋白的影响如图2d 所示,随着平菇蛋白粗提液增加,蛋白萃取浓度和萃取率均呈先增后降趋势。当蛋白粗提液在24%时,此时浓度和萃取率分别为1.66 mg/mL 和94.57%,萃取效果最好。但当蛋白质量增加到一定浓度时,继续增加时上相饱和,更多的蛋白溶解在下相,造成萃取效果下降。故本文确定平菇蛋白粗提液添加量为24%。
2.3 响应面试验结果分析
2.3.1 Box-Behnken 试验设计与结果 采用Design-Expert8.0.6 软件设计3 因素3 水平试验,以平菇蛋白萃取浓度作为响应值进行响应面优化试验,见表2。

表2 Box-Behnken 试验设计及结果Table 2 Design and results of Box-Behnken
2.3.2 二次回归模型的建立及显著性分析 运用Design-Expert8.0.6 软件,对响应面试验结果进行回归拟合,得到以A(PEG2000 质量分数)、B((NH4)2SO4质量分数)、C(蛋白粗提液质量分数)为自变量,以平菇蛋白萃取浓度为响应值的二次多项回归方程:
Y=1.59-0.083A+0.12B-0.033C+0.032AB-0.024AC+0.18BC-0.15A2-0.18B2-0.016C2
对回归模型的方差分析见表3。由表3 可知,该模型F值为19.692,P值<0.01,表明该模型差异极显著;失拟项P值=0.8994>0.05,不显著,表明该回归模型可以接受;模型决定系数R2=0.962,校正系数R2Adj=0.9132,说明平菇蛋白萃取效果与该模型拟合程度较高,能够较好地反映各因素与响应值的关系。模型中A、B、BC、A2、B2对平菇蛋白萃取效果影响极显著(P<0.01);C、AB、AC、C2影响不显著。根据F值和P值,各因素对平菇蛋白萃取效果的影响的主次顺序为B>A>C。
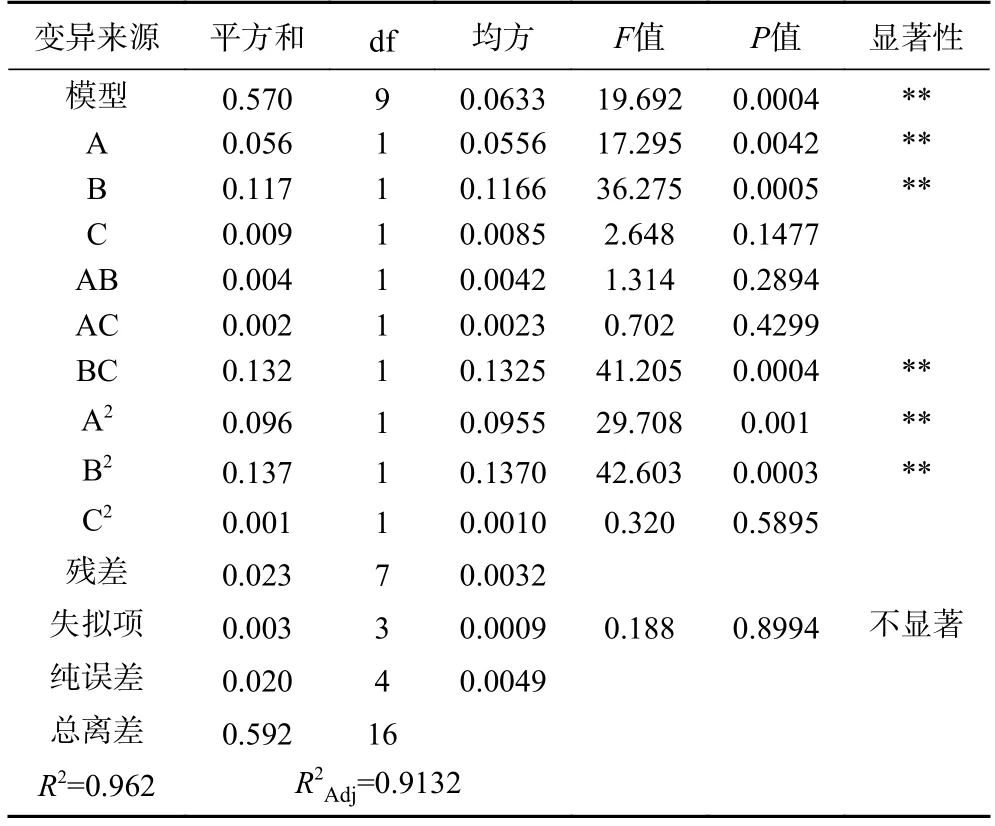
表3 回归方程方差分析Table 3 Variance analysis of Regression equation
2.3.3 响应面各因素交互作用分析 三维曲面图是对各因素影响蛋白萃取效果的最直观的展现,曲面越陡峭,说明因素对响应值的影响越大;曲面越平缓,则影响越小。等高线图则说明两因素交互作用对因变量的影响,若等高线为椭圆型则说明交互作用显著,反之为圆形则不显著[27]。由图3a 可知(NH4)2SO4质量分数和蛋白粗提液质量分数的交互作用等高线为椭圆形,二者交互作用对响应值的影响显著。图3b可知(NH4)2SO4比蛋白粗提液的坡度更陡,说明(NH4)2SO4质量分数对蛋白浓度影响更大。
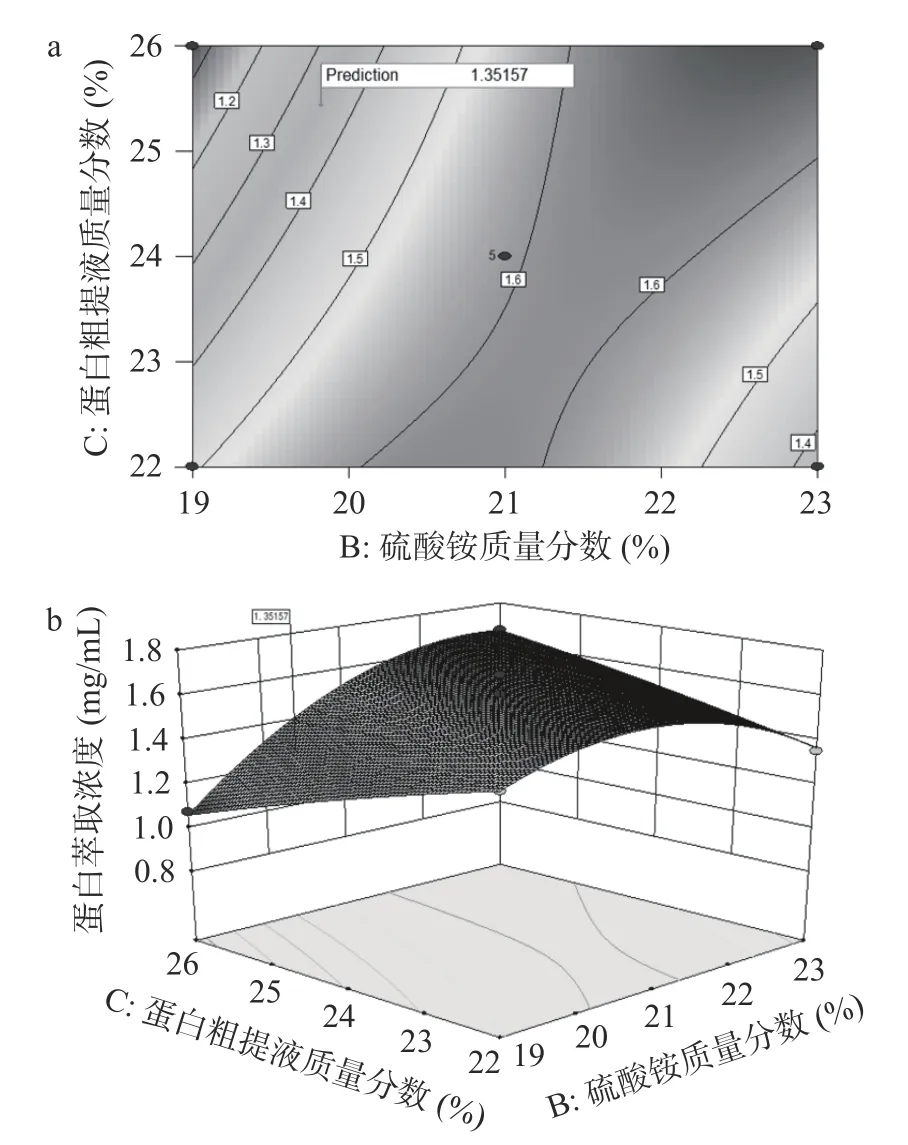
图3 (NH4)2SO4 质量分数与蛋白粗提液质量分数交互作用对蛋白萃取浓度的影响的响应面图Fig.3 Response surface plot of the interaction between the mass fraction of (NH4)2SO4 and the mass fraction of crude protein extract on the concentration of protein extraction
2.3.4 最佳工艺验证试验 运用Design-Expert
8.0.6 软件,分析响应面试验结果,得到平菇蛋白PEG2000-(NH4)2SO4双水相萃取的最佳工艺参数为:10 g 总体系中,19.5% PEG2000,22.6%硫酸铵,26%蛋白粗提液。通过三次平行试验,得出平均蛋白浓度1.71 mg/mL,与预测值1.68 mg/mL 相差较小。在此条件下得到的双水相萃取平菇蛋白的萃取率为93.14%,萃取效果最好。
2.4 平菇蛋白理化性质分析
2.4.1 SDS-PAGE 分析 平菇蛋白电泳结果如图4所示,平菇蛋白质的亚基分布较为集中,共有3 个条带,其中条带a 和b 在52~66 kDa 之间,条带c 在10~15 kDa 之间。经比较,本研究的平菇蛋白与同伞菌目香菇蛋白有类似条带(15、22、52.73 kDa)[28],因此双水相法能够萃取出平菇蛋白。

图4 平菇蛋白电泳图Fig.4 Electrophoresis diagram of Pleurotus ostreatus protein
2.4.2 氨基酸组成分析 平菇蛋白的氨基酸组成和含量见表4。除酸水解破坏色氨酸以外,平菇蛋白的其他氨基酸含量丰富,富含17 种氨基酸。其中必需氨基酸7 种,非必需氨基酸10 种。氨基酸总含量221.46 mg/g,其中EAA/TAA 的值为41.98%,EAA/NEAA 的值为72.34%。这符合FAO/WHO 标准规定的EAA/TAA 须在40%左右,EAA/NEAA 在60%以上[29]。从氨基酸含量来看,Asp 和Glu 含量最多,它们都属于鲜味氨基酸,对香味有增强作用[30],其次是Arg、Leu 苦味氨基酸和Phe 甜味氨基酸,这几种呈味氨基酸都对平菇真菌的滋味贡献很大。
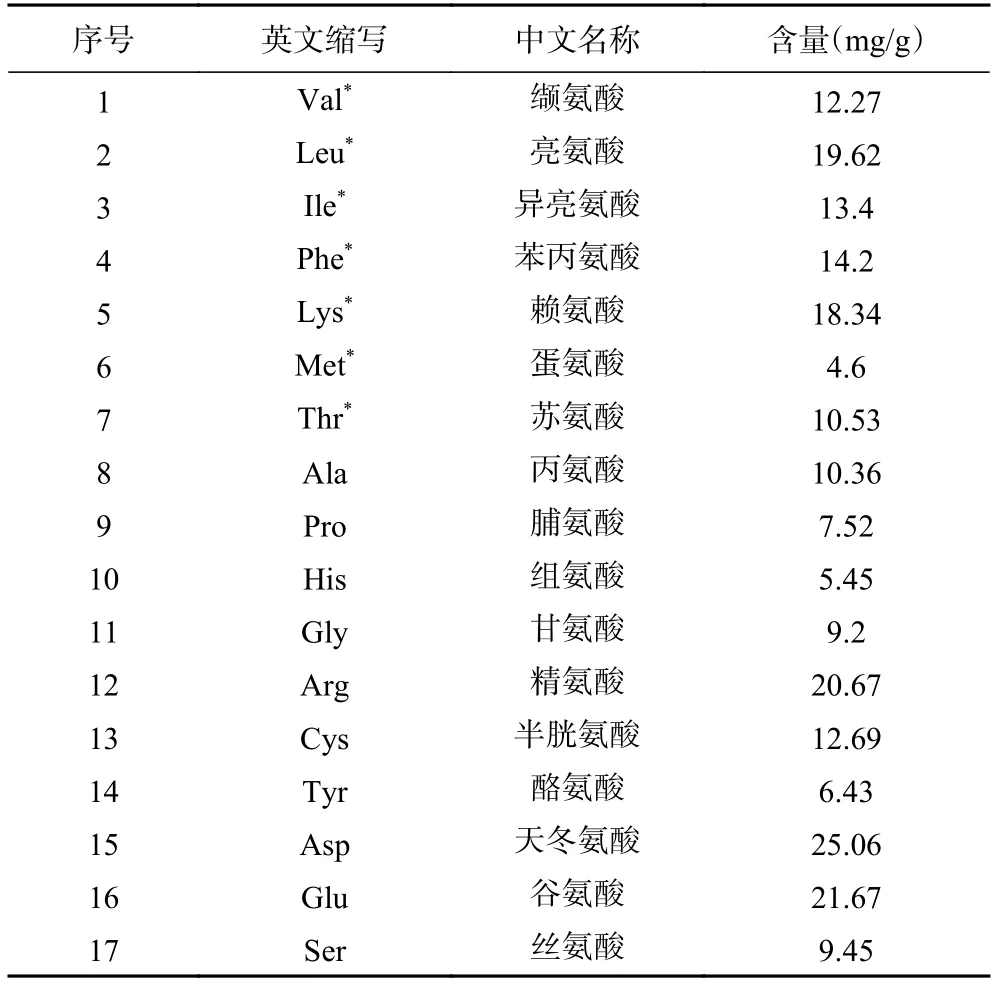
表4 平菇蛋白的氨基酸组成及含量Table 4 Amino acid composition and content of Pleurotus ostreatus protein
2.4.3 形貌及粒径分布分析 利用扫描电镜观察平菇蛋白的外观形貌差异。由图5a~图5b 看出,平菇蛋白呈不规则片状,大小不均一,表面粗糙无规律纹理。如图5c 所示,通过动态光散射测出平菇蛋白的粒径分布呈多峰分布,蛋白有出现聚集状态,其平均粒径约220.2 nm。
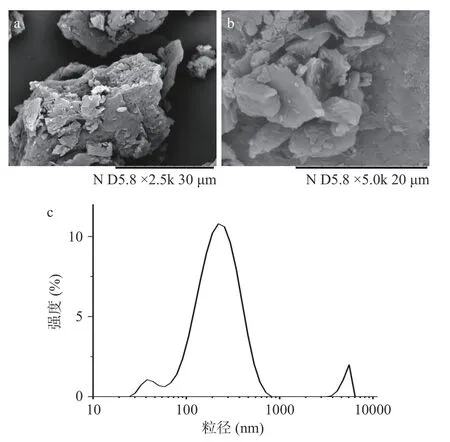
图5 平菇蛋白的形貌及粒径分布图Fig.5 Morphology and particle size distribution diagram of Pleurotus ostreatus protein
2.4.4 傅里叶红外光谱分析 FTIR 光谱常用于分析蛋白质的二级结构,从谱图6 中可获得蛋白质分子中氨基酸基团。目前谱峰指认已经相对成熟,酰胺I 带(H-O-H 弯曲振动和C=O 伸缩振动)主要显示在1700~1600 cm-1处,酰胺II 带(N-H 弯曲)的吸收范围在1600~1500 cm-1处,酰胺III 带(C-O 和C-O-C)的吸收范围在1350~1200 cm-1处[31]。从图6 可知,在4000~500 cm-1处发现了几个主要谱带。平菇蛋白具有酰胺I 带(1650 cm-1)、酰胺II 带(1538 cm-1)、酰胺III 带(1355 和1288 cm-1)特征峰。在3295 cm-1处有蛋白质链与水分子氢键形成的吸收带,在2887 cm-1处观察到饱和C-H 伸缩振动引起的吸收峰,在1355 和1288 cm-1处有由C-OH 振动引起的吸收峰。

图6 平菇蛋白红外光谱图Fig.6 Infrared spectrum of Pleurotus ostreatus protein
2.5 功能性质分析
2.5.1 平菇蛋白等电点及溶解性的分析 本试验考察了平菇蛋白等电点及溶解性的性质。如图7a 可知,随着pH 升高平菇蛋白吸光值先降后升。当体系pH=4.2 时吸光值最小,可知pH=4.2 为蛋白质的等电点;如图7b 可知,蛋白溶解度随着pH 增大呈现先降后升趋势。当pH 在等电点附近时蛋白质溶解性最低,仅为2.99%。

图7 平菇蛋白的等电点及溶解性Fig.7 Isoelectric point and solubility map of Pleurotus ostreatus protein
pH 在4 附近时,平菇蛋白的吸光值和溶解性最低,这是因为等电点与溶解度之间存在一定关系。在等电点附近,由于蛋白质净电荷为零,其表面电荷相互抵消,从而减小了蛋白质分子之间的静电排斥作用。这会导致蛋白质分子容易聚集和沉淀,溶解度相对较低。因此,在等电点附近蛋白质溶解度最低。而在远离等电点蛋白分子表面同性电荷暴露,静电斥力和离子水合作用增强,促进蛋白质分子在溶液中分散。这样,蛋白质的溶解度在远离等电点后相对较高[32-33]
2.5.2 平菇蛋白乳化特性及起泡特性分析 本试验考察了平菇蛋白乳化特性。如图8a 所示,随着pH增大,平菇蛋白质的乳化性和乳化稳定性均呈现先降后升趋势。当pH=10 时,乳化性及乳化稳定性最高,分别为59.91%和65.22%。在碱性条件下,平菇蛋白质的乳化性及乳化稳定性均上升,这是因为平菇蛋白带负电荷,导致多肽链在油-水界面展开与排斥,已溶解的蛋白快速吸附到油-水界面,吸附量越多,乳化能力越强,乳液越稳定[34]。与Jhan 等[35]报道的珍珠小米蛋白(乳化性最高为68.98%,乳化稳定性最高为28.98%)相比较,平菇蛋白乳化性略低,但乳化稳定性则明显高于珍珠小米蛋白。平菇蛋白良好的乳化稳定性能够防止产品水出油现象的产生[36]。
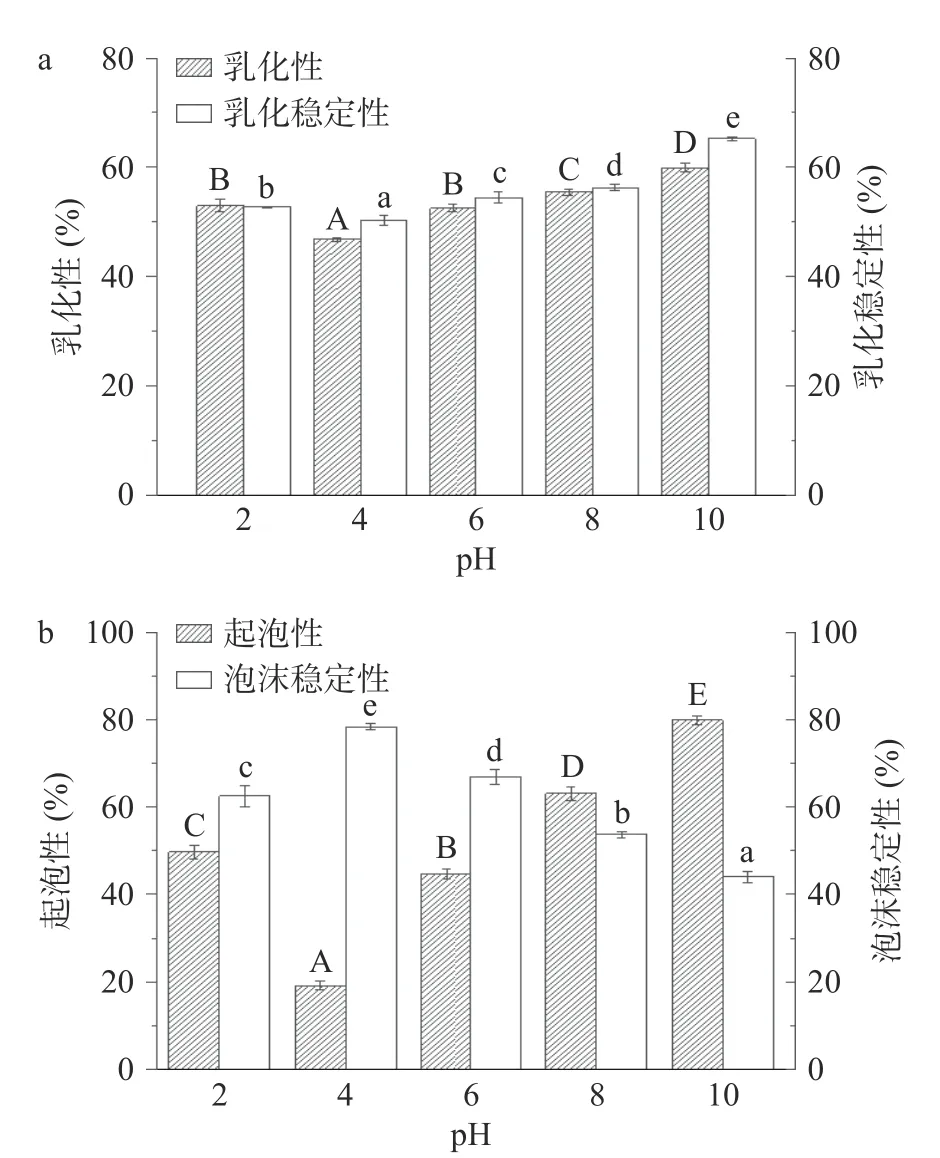
图8 平菇蛋白乳化特性及起泡特性图Fig.8 Emulsifying and foaming properties of Pleurotus ostreatus protein
本实验考察了平菇蛋白起泡特性。如图8b 所示,随着pH 的增大,平菇蛋白质的起泡性呈现先降后升趋势,而起泡稳定性则呈现先升后降趋势。当pH 接近等电点时,蛋白质的起泡性最小,为19.07%,而此时起泡稳定性最高,为78.32%,这是因为在等电点时溶解性最低,等电点附近蛋白水化能力较小,仅蛋白的可溶性部分参与泡沫的生成,因此起泡性最差[37];而这些不溶解的蛋白质粒子的吸附增加了蛋白质膜的粘合力,起泡稳定性得到增强;当pH 偏离等电点后,溶解度增加,疏水相互作用力减弱,起泡性更好。与López 等[38]报道的蛋白(FA 在pH=8.0 时为28.68%,FS 最高为57%)相比,本研究的平菇蛋白起泡性及起泡稳定性均略优。研究显示,良好的起泡性有助于形成稳定的气泡结构,改善食品均匀细腻的口感和优良的质构特性[34]。
2.5.3 平菇蛋白的持水性和持油性 经实验测得平菇蛋白的持水性2.61±0.18 g/g,持油性2.64±0.15 g/g。与白灵菇分离蛋白(持水性2.39±0.09 g/g,持油性4.47±0.49 g/g)和白灵菇清蛋白(2.13±0.06 g/g,持油性5.36±0.27 g/g)相比[37],平菇蛋白持水性较高,持油性则明显较低。研究显示,持水性为1.49~4.72 g/g的蛋白质可用于粘弹性食品中[39]。
3 结论
APTS 作为一种独特的分离和纯化方法,具有操作简单、条件温和的特点,同时体系含水量高可以保持蛋白质等生物活性物质的构象稳定。本实验利用ATPS 萃取平菇中的蛋白质成分,通过响应面法优化了双水相法萃取平菇蛋白的工艺,得到平菇蛋白的萃取率为93.14%,上相平菇蛋白浓度为1.71 mg/mL,获得了较高提取效率,实现了高产高质的平菇蛋白提取,为解决了传统方法在平菇蛋白提取方面的局限性和不足之处提供参考。通过评估蛋白部分性质,表明平菇蛋白具有较高的乳化稳定性、起泡性、起泡稳定性、持水性等功能性质,这些特性可以提高产品的质量特性和营养功效,在食品和保健品等领域具有巨大的应用前景。虽然本研究利用APTS 获得较好萃取效果,但是该方法在食用菌活性物质萃取等方面研究较少,研究者可以进一步考察pH、盐、有机溶剂、聚合物、离子液体或表面活性剂的种类和浓度等要素,建立食用菌功能物质萃取新方法。另一方面,ATPS的应用大多数建立在实验基础上,缺乏对过程规律的认识,尚有许多理论和实践方面的技术有待解决。未来,通过深入研究建立一套完整的理论和方法,可以解释并预测物质在双水相体系中的相行为和被分配物质在两相中分配行为,实现对多组分在ATPS 中分配行为的有效计算和精准预测,从而实现的生物活性物质的高效提取和分离。这一技术因绿色环保将在生物工程、食品、中药制药、健康产品等领域有广泛应用。
——以渤海S油田为例

