超声协同低共熔溶剂提取紫丁香花多酚工艺优化及抗氧化活性分析
刘佳怡,黄磊磊,王天怡,张庆芬,杨逢建,*
(1.东北林业大学森林植物生态学教育部重点实验室,黑龙江哈尔滨 150040;2.东北林业大学化学化工与资源利用学院,黑龙江哈尔滨 150040;3.东北林业大学林业生物制剂教育部工程中心,黑龙江哈尔滨 150040;4.黑龙江省林源活性物质生态利用重点实验室,黑龙江哈尔滨 150040;5.东北林业大学生物资源生态利用国家地方联合工程实验室,黑龙江哈尔滨 150040)
紫丁香(Syringa oblataLindl.)为木樨科(Oleaceae)丁香属(Syringa)落叶灌木或小乔木植物[1],主要分布于我国东北至西南地区[2]。丁香属植物是一类常见的观赏类树木,其根、茎、叶、花、果具有一定的药用价值[3]。有研究表明,紫丁香中最为重要的次生代谢产物是多酚类物质,多酚类化合物含有苯环结构,广泛存在于植物中,植物多酚具有凝血活性[4]、抗氧化[5]、降血糖[6]、清热解毒[7]、抗菌消炎[8]、抗病毒[9],以及保护神经[10]、抗缺氧[11]等多种药用活性。
目前对植物多酚的提取方法有溶剂浸提法[12]、索氏提取法[13]、酶辅助法[14]、微波辅助法[15]、超临界法[16]以及超声波提取法[17]。其中溶剂浸提法和索式提取法存在提取时间过长,效率低,有机溶剂的使用对环境不友好等劣势。而超声波被广泛应用于植物多酚的提取,其利用高频超声波的空化作用,促使溶剂温度升高,在闭合过程中,溶剂内产生大量空腔,内部温度和压力升高,加速目标化合物溶解、扩散至溶剂中,从而提高提取效率[18]。Abboot 等[19]于2003年首次提出低共熔溶剂(Deep Eutectic Solvent,DESs)的理论,低共熔溶剂是一种环境友好的新型绿色溶剂,通常由氢供体(Hydrogen Bond Donor,HBD)和氢受体(Hydrogen Bond Acceptor,HBA)按一定比例非共价结合而成,DESs 在常温下具有挥发性低、无毒、对环境影响小、易于合成、可回收、可生物降解和低制备成本的特点[20]。呈弱酸性的DESs 有助于分解植物细胞壁[21],且能通过氢键作用力更好地渗透到植物细胞中,不仅能快速溶解出多酚类化合物,且酚类物质的完整度高[22],因此逐渐取代有机溶剂,用于植物中多酚类、黄酮类等天然化合物的提取。
本研究首次使用超声-低共熔溶剂法提取紫丁香多酚(Ultrasound-Assisted Deep Eutectic Solvents,UADES),利用单因素以及Box-Behnken 响应面试验,确定提取丁香多酚的最佳工艺,并与传统水提法和有机溶剂提取法进行对比,证实该方式是一种相对绿色环保且高效的提取方法。其次通过DPPH、羟基自由基清除实验来考查紫丁香多酚的体外抗氧化能力,为紫丁香多酚的开发及其活性成分的提取利用提供理论基础。
1 材料与方法
1.1 材料与仪器
紫丁香花 采摘于东北林业大学校园,经东北林业大学森林植物生态学教育部重点实验室毛子军教授鉴定为木犀科丁香属植物紫丁香(Syringa oblataLindl.),采收时间为2022 年5 月,阴干后粉碎并过60 目筛,将样品保存于密封袋,常温避光备用;氯化胆碱、苹果酸、乳酸、乙二醇、丙三醇、1,2-丙二醇、尿素、葡萄糖、草酸 分析纯,阿拉丁试剂公司;福林酚、二苯基苦味酰基苯肼基自由基(DPPH)分析纯,上海源叶生物科技有限公司;Na2CO3、无水乙醇、甲醇 分析纯,天津市致远化学试剂有限公司;抗坏血酸 分析纯,天津市瑞金特化学有限公司。
KQ-500DM-22.5 超声清洗仪 昆山市超声仪器有限公司;UV-2600 紫外分光光度仪 日本岛津公司;2500C 多功能粉碎机 永康市红太阳机电有限公司;BSA124S 电子分析天平 德国 Sartorius;Neo15 高速冷冻离心机 上海力申科学仪器有限公司;SHJ-6AB 磁力搅拌水浴锅 常州金坛良友仪器有限公司。
1.2 实验方法
1.2.1 提取溶剂的制备 探究氢受体(氯化胆碱)和8 种不同氢键供体按一定摩尔比组成的低共熔溶剂体系(DES-1 至DES-8)以及传统溶剂(水、甲醇、60%乙醇)对多酚提取量的影响。DESs 种类如表1,制备低共熔体系以氯化胆碱为氢受体,选用几种糖、有机酸和多元醇为氢供体,以一定的摩尔比,在80 ℃磁力仪中搅拌,直到形成清澈透明液体,冷却至恒温,放置一周仍为均匀透明且不分层的稳定体系溶液,即为低共熔溶剂DESs,常温保存备用[23]。
1.2.2 紫丁香总多酚的提取方法 称取一定量干燥的60 目紫丁香花粉末,加入溶剂于离心管中混匀,置于超声仪,设置超声频率40 Hz、提取温度60 ℃,超声时间60 min,料液比1:30 g/mL,超声功率300 W,待提取液冷却至室温后,10000 r/min 离心10 min,取上清液即为紫丁香多酚粗提产物。
1.2.3 标准曲线的绘制及总多酚含量的测定 总多酚含量测定采用Folin-Ciocalteu(FC)法[24]测定:量取没食子酸标准品,配制浓度为0.05 mg/mL 的标准溶液,分别取0、0.2、0.4、0.5、0.6、0.7、0.8 mL 于避光离心管中,加蒸馏水至1 mL,加入1 mL 10%福林酚试剂混匀,静置3~4 min 后,加入10% Na2CO3,定容至刻度,混匀,40 ℃水浴1 h 后,在紫外波长765 nm处测量吸光值,绘制标准曲线回归方程y=14.362x+0.0516(R2=0.9992),总多酚浓度(mg/mL)与吸光度呈现良好的线性关系。
根据1.2.3 的标准曲线计算以没食子酸当量的紫丁香多酚的质量浓度,进而得出紫丁香花多酚的提取量(mg/g),按下列公式计算:
式中:W 为总多酚含量,mg/g;C 为回归方程计算出提取物多酚浓度,mg/mL;V 为定容后提取液体积,mL;N 为提取物的稀释倍数;m 为紫丁香粉末质量,g。
1.2.4 超声-低共熔溶剂提取紫丁香花多酚的单因素实验 依据1.2.2 的方法进行实验。分别考察不同溶剂(水、60%乙醇、甲醇以及8 种低共熔溶剂)提取效果后,选用提取量最高的DES 为提取溶剂,初始固定参数为:摩尔比1:1.5,提取温度60 ℃,超声时间60 min,料液比1:30 g/mL,超声功率300 W。探究在不同摩尔比(2:1、1:1、1:1.5、1:2 和1:3);不同提取温度(30、40、50、60 和70 ℃);不同超声时间(30、40、50、60 和70 min);不同料液比(1:20、1:30、1:40、1:50 和1:60 g/mL);不同超声功率(150、200、250、300 和350 W)对紫丁香多酚的提取效果。
1.2.5 超声-低共熔溶剂提取紫丁香总多酚的响应面优化试验 在单因素实验基础上,以提取温度(A)、超声时间(B)、料液比(C)、超声功率(D)四个单因素为变量,紫丁香总多酚提取量(Y)为响应量进行优化,试验因素设计与水平设计采用中心组合Box-Behnken 法设置三级别(-1、0、+1)四因素,在Design expert 13.0 软件上对紫丁香多酚提取进行响应面试验,共计29 个实验,各因素及水平见表2。
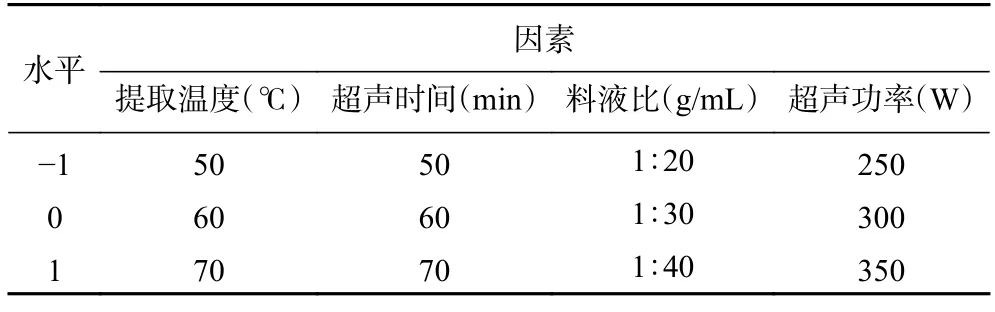
表2 Box-Behnken 试验设计因素与水平Table 2 Box-Behnken experimental design factors and levels
1.2.6 体外抗氧化活性测定 将紫丁香总多酚粗提液过AB-8 型大孔树脂吸附,去离子水洗去杂质,再经70%乙醇洗脱,收集洗脱液,旋蒸除乙醇后,冻干,得到多酚提取物,进行DPPH 和羟基自由基的体外抗氧化实验。
1.2.6.1 DPPH 自由基清除活性测定 参考王雨[25]的方法,在比色管中加入2 mL 各浓度多酚提取物溶液(0.0125、0.125、0.25、0.5、1.0、2.0 mg/mL)和3 mL DPPH-乙醇工作液(2 mmol/L),摇匀后在避光条件下充分反应30 min,随后于紫外分光光度计的517 nm 处测定吸光值,记为测定组A1。用无水乙醇代替DPPH 工作液,按上述方法测定吸光值,记为对照组A2;用无水乙醇代替多酚提取液,按上述方法测定吸光值,记为空白组A0。多酚对DPPH 自由基的清除率按下列公式计算:
式中:A0表示空白组吸光值;A1表示测定组吸光值;A2表示对照组吸光值。
1.2.6.2 羟基自由基清除作用 参考Sun 等[26]的方法稍作修改,在比色管中加入2 mL 各浓度多酚提取物溶液(0.0625、0.125、0.25、0.5、1.0、2.0 mg/mL),2 mL 1.5 mmol/L FeSO4,1 mL 3 mmol/L 水杨酸-乙醇溶液、2 mL0.1% H2O2,混匀,37 ℃下反应30 min,冷却至室温后,随后于512 nm 处测定吸光值,记作测定组A1,用蒸馏水代替H2O2溶液,按上述方法测定吸光值,记作对照组A2;用蒸馏水代替多酚提取液,按上述方法测定吸光值,记作空白组A0。多酚对羟基自由基的清除率按下列公式计算:
式中:A0表示空白组吸光值;A1表示测定组吸光值;A2表示对照组吸光值。
1.3 数据处理
本实验均重复实验三次,数据结果以平均值±标准误差(Mean±SD)表示,利用软件SPSS Statistics 26.0 进行方差分析,P<0.01 表示差异性极显著,P<0.05 表示差异性显著,利用Design expert 13.0 软件对实验数据进行统计分析,利用Origin 2023 进行绘制数据图。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同DESs 组分筛选 由图1 可知,DES 种类对提取量影响较大,与传统溶剂相比,大部分DESs(除DES-3 和DES-5)均能显著提高多酚提取量(P<0.05)。DES-6(氯化胆碱-苹果酸)所提取的紫丁香多酚提取量(53.78±0.46 mg/g)最高,显著高于传统溶剂水、60%乙醇和甲醇(30.73±0.68、37.49±0.33和35.50±0.12 mg/g)的提取(P<0.05)。氢供体为多元羧酸的体系(DES-6、DES-7、DES-8),含有一定的游离氢离子,与多酚中的酚羟基结构结合,能形成较强的氢键,促进多酚溶出到溶剂介质中[27]。
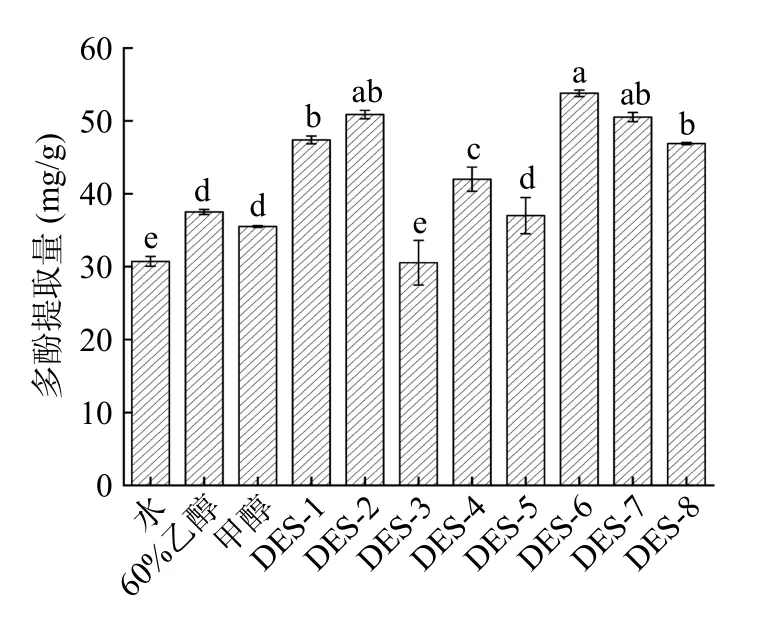
图1 不同DESs 溶剂对紫丁香多酚提取量的影响Fig.1 Effects of different DESs on the yield of polyphenols from Syringa oblata Lindl.
然而DES-1 和DES-2 体系的氢供体为多元醇类,虽略低于羧酸体系的提取量,但因其体系粘度过大不利于操作[28];以糖类为氢供体的体系(DES-3、DES-4、DES-5)提取量显著低于多元羧酸和多元醇为氢供体的体系,故不作选择。这与尚宪超[29]的研究结果一致。
2.1.2 低共熔体系的摩尔比对紫丁香多酚的提取影响 如图2 所示,随着氢供体在体系中比例增加,紫丁香多酚的提取量呈现先增加再减少的趋势。在摩尔比为1:1.5 时多酚提取量达到峰值,之后逐渐下降。氢键供体和氢键受体的摩尔比是溶剂理化性质的关键因素,多酚的提取量很大程度会受到溶剂体系摩尔比的影响。由于多酚中含有酚羟基结构,弱酸性的环境更适合多酚的溶出,当氢键供体在体系中占比增大时,溶剂体系酸性增强,则过强的酸性环境会影响多酚的溶出,导致提取量降低。同时提高氢供体在体系中的比例,会导致DES 过于粘稠,使多酚在体系中的溶解空间不足,因此提取量减少[30]。
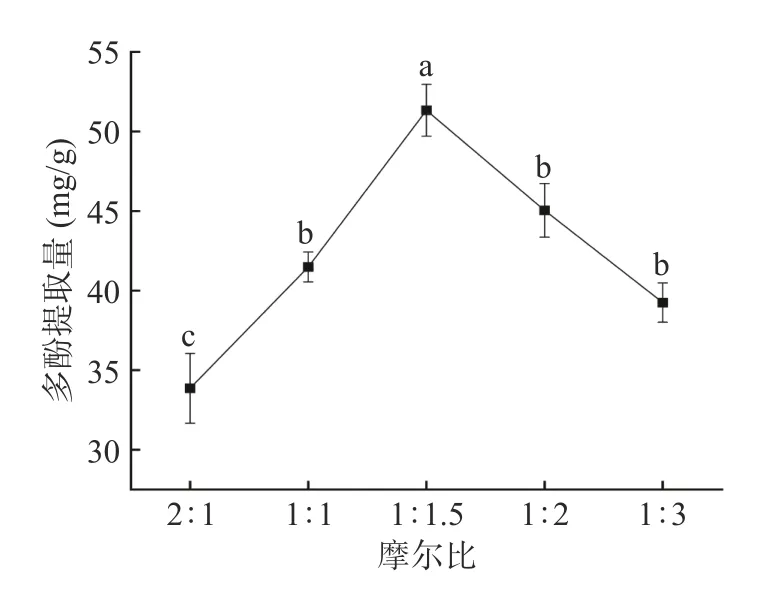
图2 不同摩尔比DESs 溶剂对紫丁香多酚提取量的影响Fig.2 Effect of DESs with different molar ratios on the yield of polyphenol from Syringa oblata Lindl.
2.1.3 提取温度对紫丁香多酚提取量的影响 如图3所示,提取温度对紫丁香多酚的提取量的影响较为显著,多酚的提取量随温度升高,呈先上升后下降的趋势,在60 ℃时紫丁香多酚提取量达到峰值。首先,提高温度可以使溶剂体系的黏度减小,加速分子运动使多酚可扩散空间变大,多酚更容易从细胞内部扩散到溶剂中,进而提高多酚的提取效果;其次由于多酚的化学结构不稳定,当温度高于60 ℃,多酚物质易降解,且含有杂质如多糖、蛋白、果胶等活性物质溶出增加,导致目标化合物与介质之间相对浓度差减小,不利于多酚从基质中溶出[31]。因此,超声温度选用60 ℃进行后续试验。
图3 不同提取温度对紫丁香多酚提取量的影响Fig.3 Effect of extraction temperature on the yield of polyphenol from Syringa oblata Lindl.
2.1.4 超声时间对紫丁香多酚提取量的影响 图4所示,随超声时间增加,紫丁香总多酚的提取量整体呈先增大后减小的趋势。在60 min 时达到峰值,与张波等[32]利用超声辅助提取法优化提取西柚皮多酚工艺提取时间为60 min 一致。超声时间是影响多酚提取量的重要参数之一,提取时间较短时,多酚与其他活性物质不易分离,随超声时间的增加,使细胞壁破碎的更加充分,从而便于多酚从中释放和溶出,使得提取出的多酚量增加。但当时间超过60 min 后,由于受到光、热等因素的影响,导致提取出的多酚受到氧化甚至分解等情况,从而降低了多酚的提取量[32]。且超声时间过长会增加耗能,导致提取成本的增加[33]。因此,选择超声时间为60 min 进行后续试验。

图4 不同超声时间对紫丁香多酚提取量的影响Fig.4 Effect of extraction time on the yield of total polyphenol from Syringa oblata Lindl.
2.1.5 料液比对紫丁香多酚提取量的影响 由图5可知,紫丁香多酚的提取量呈现先显著增加后显著降低的趋势(P<0.05),料液比为1:30 g/mL 时,紫丁香多酚提取提取量最高,可能由于目标化合物和溶剂的浓度梯度差变大,使紫丁香粉末颗粒的可扩散空间增加,增加与溶剂之间的接触面积,从而传质推动力增大,加快物质运输的进程,有利于增加多酚的提取量;然而随溶剂体积继续增大,使DESs 体系会过粘稠,导致作用于原料的辐射能量减小,因此多酚溶出量会减少[34],且可能促进一些脂溶性和醇溶性杂质的溶出[35],不仅使得目标化合物提取量下降,还会造成溶剂的浪费。因此,选择料液比为1:30 g/mL 用于后续试验。

图5 料液比对紫丁香多酚提取量的影响Fig.5 Effect of with solid-liquid ratio on the yield of polyphenol from Syringa oblata Lindl.
2.1.6 超声功率对紫丁香多酚提取量的影响 由图6可知,超声功率在150~300 W 之间时,多酚提取量随功率变大而逐渐增加,当功率达到300 W 时,紫丁香多酚提取量达到最大值,随后下降。可能由于在提取初始阶段,超声波使原料质点在溶剂空间中进行振动状态从而出现“空化现象”[36],使植物细胞部分被破坏,从而增加目标物质的扩散。当超声功率超过300 W 时,可能由于功率过高,其热效应与机械效应导致多酚类物质的破坏,导致部分多酚分解,含量降低[37]。

图6 不同超声功率对紫丁香多酚提取量的影响Fig.6 Effect of ultrasonic power on the yield of polyphenol from Syringa oblata Lindl.
2.2 响应面试验优化工艺
2.2.1 响应面试验设计建立与显著性分析检验 中心组合优化试验设计及结果如表3。以紫丁香多酚提取量(Y)为响应值,自变量为提取温度(A)、超声时间(B)、料液比(C)、超声功率(D)四个因素,在Design Expert 13.0 软件中,用多元线性回归拟合得二次多项回归方程模型如下:
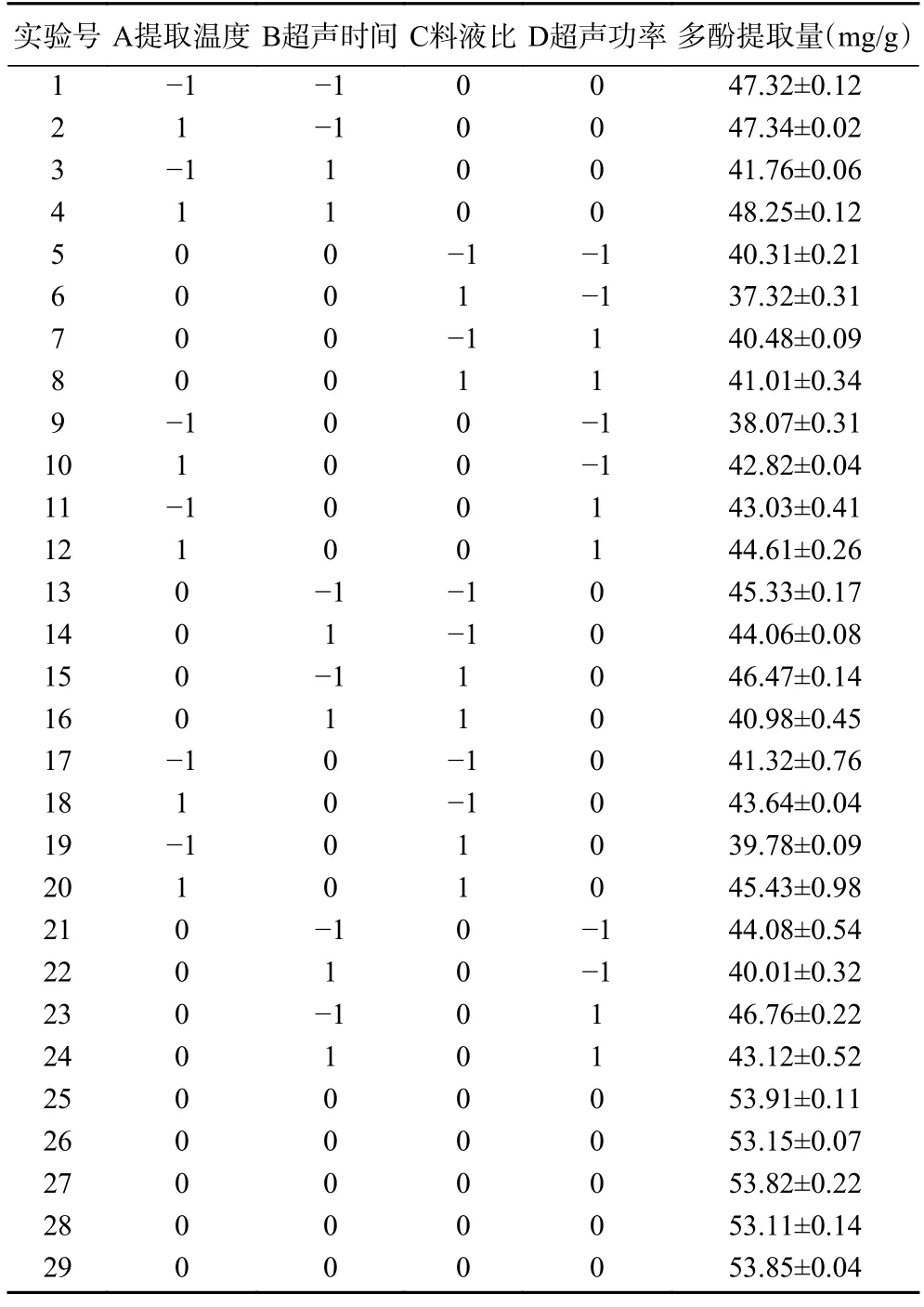
表3 响应面中心组合试验设计及试验结果Table 3 Response surface center combination experimental design and results
F表示模型拟合方程的显著程度,即F值越大,对响应值的影响越大,拟合程度越好。从表4 可知,实验模型的F=145.28,P<0.01,达到极显著水平,具有统计学意义;F失拟项=2.43,P>0.05,说明该模型不存在显著误差,模型拟合度较为良好,可用于紫丁香花多酚提取量分析;其中,模型Y中A、B、D、A2、B2、C2、D2、AB、BC、CD 对紫丁香多酚提取量有极显著差异(P<0.01),AC、AD 对多酚提取量显著差异(P<0.05),说明两者的组合因素对多酚提取量影响显著,其他因素不显著(P>0.05)。模型决定系数R2=0.9932,RAdj2=0.9863,均大于0.9,因此,该模型相关度较好,拟合度较高,实验稳定性较好,可以较好反映出各因素之间的关系,利用回归方程进行预测各因素对后续实验的影响规律。
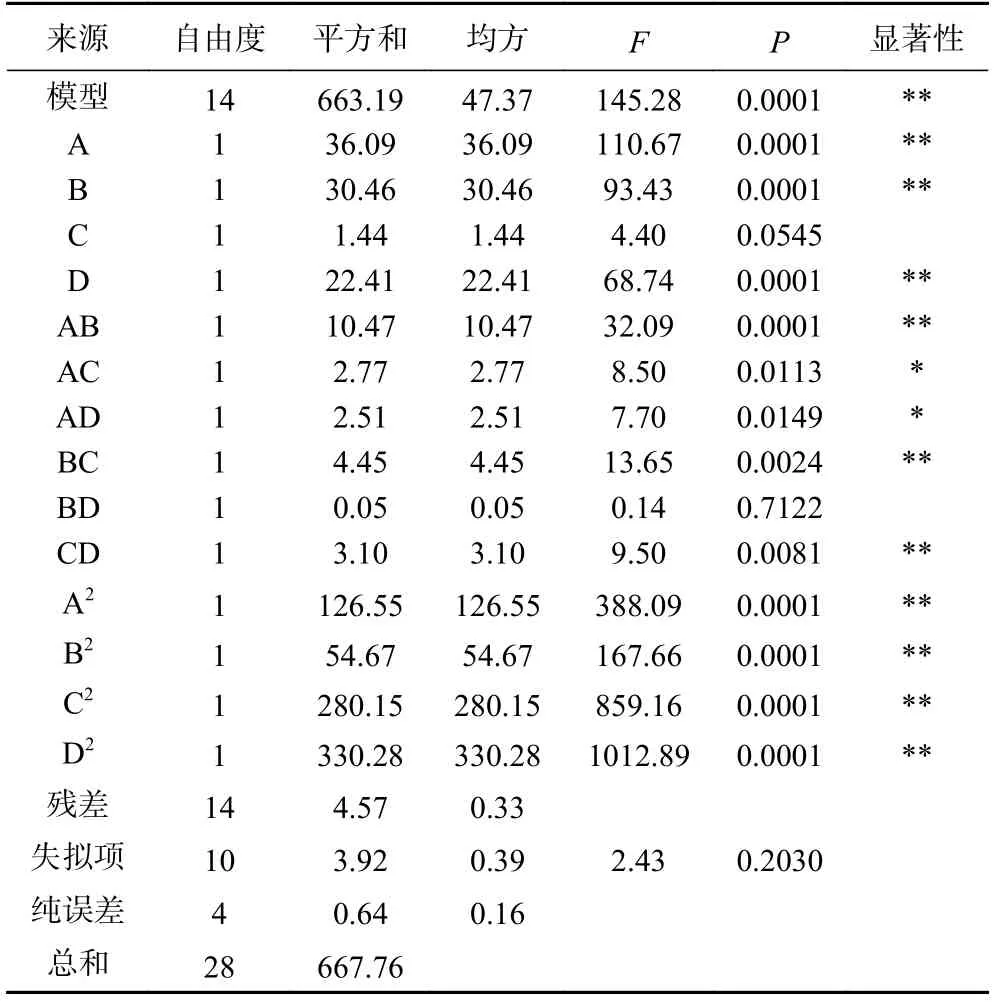
表4 响应面拟合二次回归方程方差分析结果Table 4 Results of response surface fitting regression equation ANOVA
根据显著性检验F大小可知,各因素对多酚提取量的影响从大到小分别为:提取温度(A)>超声时间(B)>超声功率(D)>料液比(C)。
2.2.2 各因素交互作用的3D 响应曲面图 在Design-expert 13.0 对表4 的数据进行多元回归拟合,得3D 响应曲面图后可直观评价各因素对紫丁香多酚提取量影响交互作用的强弱,从而得到各变量的最佳条件。3D 响应曲面坡度越陡峭、等高线性状越扁平,则说明各因素交互效应越显著,图内蓝色到红色的变化,则为提取量从少到多的变化[38]。若等高线为圆形,则表示两因素交互作用对响应值的影响不显著,若等高线呈椭圆形或马鞍形则表示两因素交互效应对响应值的影响显著[39]。
图7 直观地反映了各因素对多酚提取量的影响程度。如图7(a),响应面的曲线坡度较陡峭,等高线为椭圆形,说明AB 间交互作用对响应值的影响显著,随两因素的增大,紫丁香多酚的提取量也逐渐升高。提取温度的升高,可促进植物多酚与基质间的物理吸附和化学相互作用[40]。在提取温度60 ℃,超声时间60 min 时,多酚提取量较高。超过此参数条件后,多酚的提取量开始下降,与单因素结果一致。由图7b~图7d、图7f 可知,等高线密集且呈椭圆,说明AC、AD、BC、CD 的相互作用对响应值的影响均为显著。如图7e 所示,3D 曲面图坡度较为平缓,说明BD 交互作用对响应值的影响不显著。
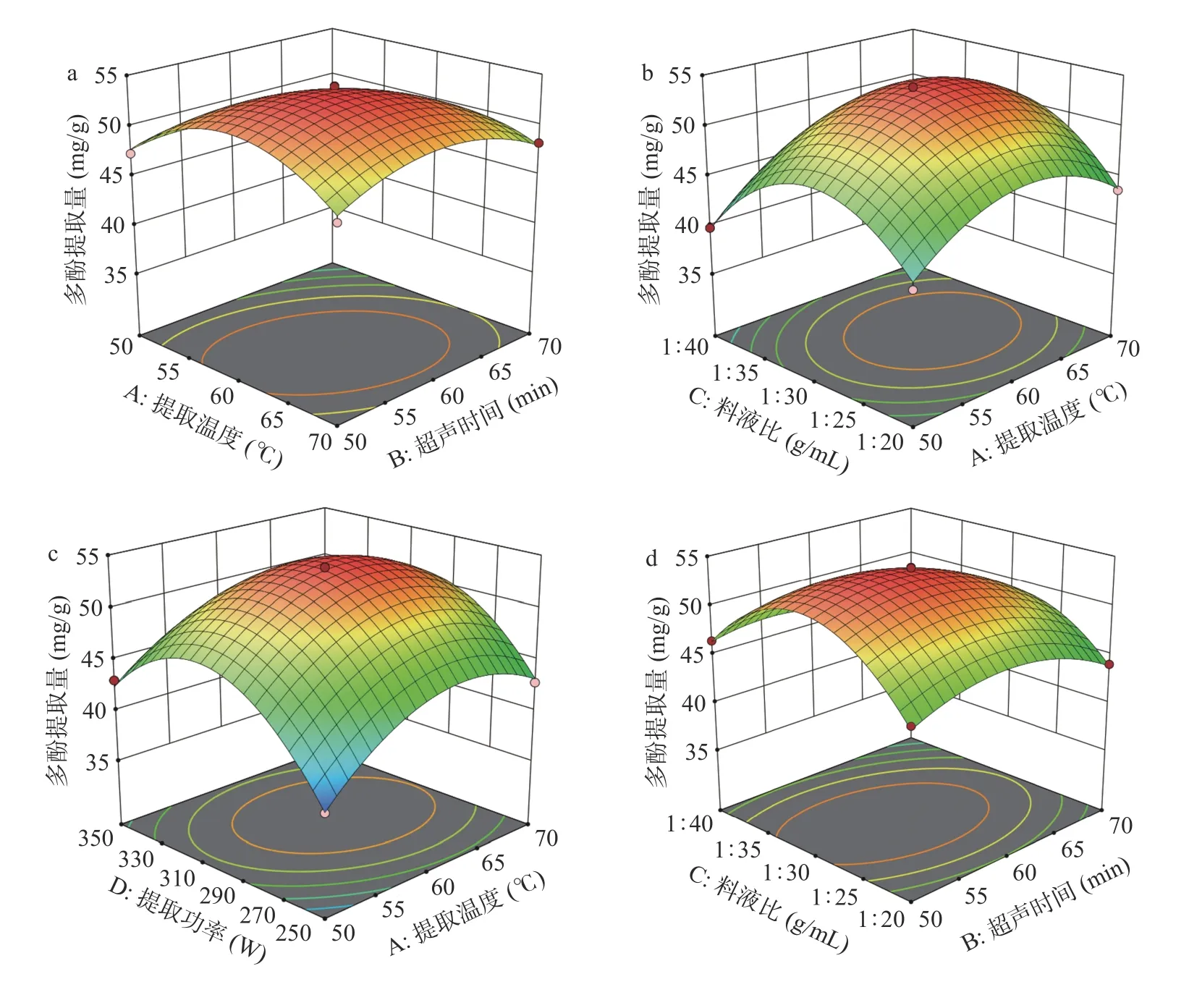
图7 不同因素间的交互作用对紫丁香多酚提取量影响Fig.7 Interactions of different experimental factors on the effects of extraction yield of polyphenols from Syringa oblata Lindl.
2.3 验证试验
根据以上模型分析,紫丁香中提取多酚的最佳条件:提取温度61.48 ℃,超声时间57.67 min,超声功率304.32 W,料液比1:30.08 g/mL,并进行了3 次平行试验。根据实际情况调整参数为:提取温度60 ℃,超声时间60 min,超声功率300 W,料液比1:30 g/mL,紫丁香总多酚提取量为52.19±0.13 mg/g,与预测值53.57±0.57 mg/g 吻合度较高,说明该模型条件可靠具有一定的实用价值。
2.4 紫丁香多酚提取物的抗氧化活性
2.4.1 DPPH 自由基清除能力 DPPH 基于自身三个苯环的共振稳定作用和空间障碍,是一种较为稳定的氮中心的自由基,作为一种稳定的自由基,DPPH可以捕获其他的自由基。因此,常用于考察目标化合物的体外抗氧化效果[41]。如图8 可知,在0.03125~0.5 mg/mL 内各浓度紫丁香多酚提取液对DPPH 自由基的清除率与测样浓度呈现正相关关系。在浓度为0.5 mg/mL后,清除能力缓慢增强。但同浓度下的VC清除自由基能力始终高于紫丁香多酚提取液,且在0~0.125 mg/mL 之间无显著差异(P>0.05)。当浓度大于1 mg/mL,两者的抗氧化能力相接近。紫丁香多酚在浓度为2 mg/mL 时,DPPH 清除能力达93.28%,说明其较强抑制DPPH 自由基的能力。与黄琼等[42]对铁皮石斛叶多酚对DPPH 清理能力的研究结果相近。
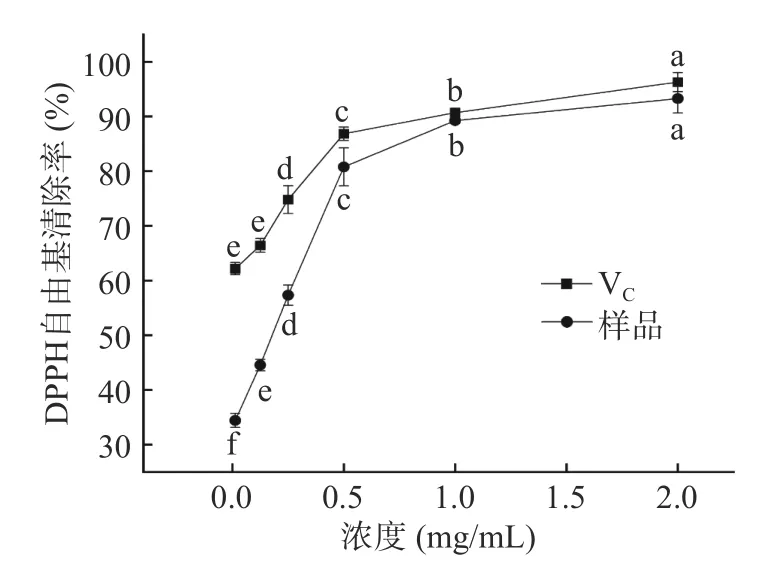
图8 VC 和多酚提取物对DPPH 自由基清除率Fig.8 Scavenging rate of DPPH free radical by VC and polyphenol extract
2.4.2 羟基自由基清除能力 羟基自由基氧化活性很强,如自由基的大量产生和累积会导致氧化应激反应,与活细胞中分子相互作用,且对DNA 等生物分子造成损伤,进而产生组织病变、心血管和神经退行性等疾病的发生[43]。紫丁香多酚和VC对羟基自由基的清除作用如图9 所示,在0.0625~2 mg/mL 内不同浓度的多酚提取液对羟基自由基均有一定的清除能力,且随浓度的升高而增大,与浓度呈现正相关。在浓度2.0 mg/mL 时,对羟基自由基的清除能力可达52.57%。然而,在相同浓度下的VC对照组清除能力始终高于紫丁香多酚提取液。
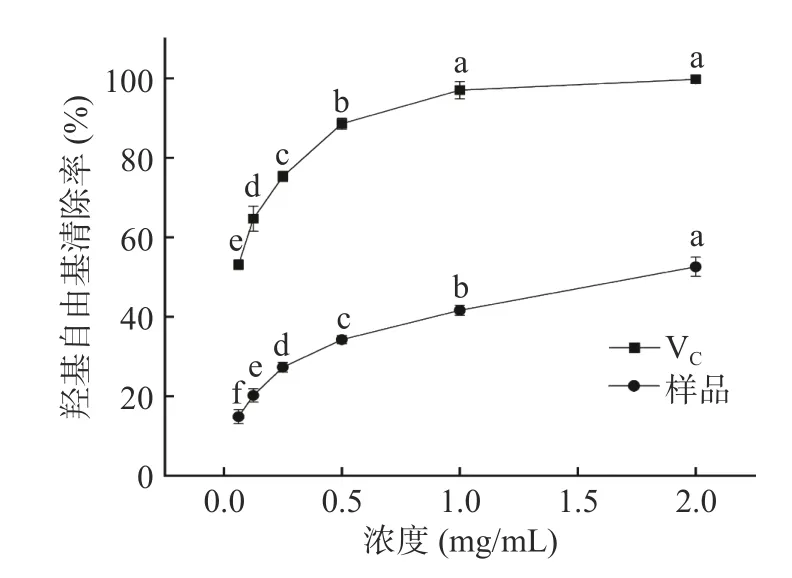
图9 VC 和多酚提取物对羟基自由基的清除率Fig.9 Scavenging rate of hydroxyl free radical by VC and polyphenol extract
3 结论
本文利用超声协同低共熔溶剂法对紫丁香多酚的工艺进行优化。首先,在8 种不同DES 体系中,筛选出提取量最高的DES 体系:氯化胆碱-苹果酸(摩尔比为1:1.5),且提取量高于传统溶剂水、60%乙醇和甲醇(30.73±0.68、37.49±0.33、35.50±0.12 mg/g)。在单因素的基础上,利用响应面试验进行优化,最佳提取工艺参数为提取温度60 ℃,超声时间60 min,料液比1:30 g/mL,超声功率300 W,紫丁香多酚可达紫丁香总多酚提取量为52.22±0.12 mg/g。此方法远高于赵青等[44]利用有机溶剂浸提法提取紫丁香多酚的得率1.73±0.05 mg/g。综上表明,超声协同低共熔溶剂法在提取紫丁香多酚工艺中具有可行性以及相较于传统提取方法,效率显著提升,方法更加绿色环保且提取成本更为廉价。在浓度为0~2 mg/mL 时,紫丁香多酚对DPPH 和羟基自由基均具有一定的清除能力,为紫丁香花多酚高效绿色的提取工艺及其资源开发利用提供思路。

