鸢尾素激活PGC-1α、UCP-1促进噬脂和褐变抑制ACHN细胞增殖和迁移*
熊绍风,熊小伟,彭国平,王 昆,方 洋,吕燕妮△
(1.南昌大学第一附属医院药学部,南昌 330000;2.南昌大学药学院药理教研室,南昌 330000;3.江西应用科技学院,南昌 330100)
肾细胞癌是一种起源于肾小管上皮细胞的癌症,在肾恶性肿瘤中占比高达90%以上[1],且统计发现,肾细胞癌占所有成人恶性肿瘤的3.79%,被认为是最致命的泌尿系统恶性肿瘤之一[2-3]。肾细胞癌除了具有异常的糖原代谢特征外,癌细胞中还会出现大量的脂质积累、侵袭和转移现象[4-5],因此肾细胞癌在组织学上被定义为脂质积累和储存的代谢疾病[6-7]。然而,肾细胞癌异常脂质代谢的分子机制和意义尚不清楚。此外,肥胖、糖尿病和动脉粥样硬化也被认为是肾细胞癌的危险因素[8-10]。
近几年,研究者们又把褐变这一观念引入肿瘤“瘦身”方面,通过调控肿瘤细胞中脂质的褐变,使得肿瘤组织成为一个“自己燃烧自己”的“瘦身”状态,达到抑制肿瘤生长、发展的作用[11]。大量研究证实,自噬的发生与癌症息息相关。自噬途径及其相关的通路被认为是治疗癌症的潜在干预靶点。鉴于肾细胞癌是以一种脂质积累和储存的代谢疾病,本课题组把噬脂及脂质褐变与肾细胞癌的发生紧密连在一起。因此,本研究旨在阐明鸢尾素对肾细胞癌的影响及作用机制,探究噬脂与脂质褐变在鸢尾素影响肾细胞癌发展中的积极作用,通过一系列研究,可丰富对抗癌症的作用机理,也为现阶段新出现肿瘤“瘦身”概念及想法提供坚实的实验基础和理论依据,现报道如下。
1 材料与方法
1.1 材料
1.1.1细胞
实验用人肾细胞腺癌细胞(ACHN)株购自武汉普诺赛生命科技有限公司(CL-0021)。
1.1.2试剂
β-Actin鼠多克隆抗体(TA-09)购自北京中杉金桥生物技术有限公司;PGC-1α兔单克隆抗体(ab106814)、UCP-1兔单克隆抗体(ab234430)均购自美国Abcam公司;逆转录试剂盒购自上海吐露港生物科技有限公司(22107);SYBR Green(FP201)购自天根生化科技(北京)有限公司;TRIzol试剂(15596026)购自美国Invitrogen公司;实时荧光定量逆转录PCR(qRT-PCR)引物、PGC-1α和UCP-1的敲除慢病毒及相应的控制载体均购自上海吉凯基因化学技术有限公司;胎牛血清购自美国Gbico公司;DMEM培养基购自北京索莱宝科技有限公司。
1.2 方法
1.2.1检测鸢尾素对ACHN细胞存活率的影响
将ACHN均匀接种于96孔培养皿,分为6组,即对照组和鸢尾素20、50、100、200、400 nmol/L组,处理细胞48 h后,采用CCK-8测定细胞存活率。
1.2.2检测鸢尾素对ACHN细胞噬脂、褐变、自噬及凋亡的影响
将ACHN均匀接种于培养皿,分为4组,即对照组和鸢尾素20、50、100 nmol/L组,处理细胞48 h后采用Western blot检测PGC-1α和UCP-1蛋白表达情况;采用qRT-PCR测定Beclin-1、LC3Ⅱ/Ⅰ、p62、PGC-1α、UCP-1和PRDM16 mRNA表达情况;采用细胞自噬染色(MDC)检测自噬小体情况;采用划痕实验检测细胞修复愈合情况;采用油红O染色检测噬脂情况;流式细胞仪检测细胞凋亡情况。
1.2.3qRT-PCR检测mRNA表达情况
PCR扩增引物均有由上海吉凯生物有限公司合成,引物序列见表1,逆转录与qRT-PCR操作参照试剂盒说明书进行。

表1 qRT-PCR引物序列
1.2.4Western blot检测相关蛋白表达情况
将不同处理组的细胞中加入细胞裂解液(RIPA裂解液∶PMSF为100∶1)置于冰上裂解15 min,之后测定蛋白浓度,根据定量结果进行制样,将上样缓冲溶液加入细胞裂解液中并煮沸10 min,随后采用10%的十二烷基硫酸钠-聚丙烯凝胶电泳分离,随后湿转到聚偏二氟乙烯膜上,湿转完成后使用10%脱脂牛奶封闭2 h,加一抗4℃孵育过夜,TBST洗膜5遍,二抗常温孵育2 h,TBST洗膜后用电化学发光法进行检测。
1.2.5流式细胞仪检测细胞凋亡情况
根据试剂盒说明书要求,把不同处理组的细胞上清液分为空白孔、标准孔、测定孔、对照孔,按步骤依次加入各种试剂,最后采用流式细胞仪测定。
1.2.6划痕实验检测细胞愈合和修复情况
ACHN接种于6孔板中,待细胞生长融合至90%时,根据实验目的在培养孔内加入不同浓度的药物或联合药物处理48 h后,用200 μL灭菌枪头在培养孔内划痕,磷酸盐缓冲液(PBS)清洗后加入无血清培养基并置于37 ℃、5% CO2培养箱中培养24 h,倒置显微镜下观察细胞愈合距离的变化检测ACHN的细胞迁移情况。
1.2.7油红O染色检测噬脂情况
将处理好的细胞,用PBS溶液清洗2遍,加入新配制的10%多聚甲醛固定20 min,用PBS溶液清洗2遍,后加入油红O染料,37 ℃恒温箱染色30 min;用PBS清洗2遍,置于倒置显微镜下观察其染色情况,拍照记录。除此之外,还需用100%异丙醇洗脱细胞内的染料以进行定量,通过紫外分光光度计测量510 nm处的吸光度(A)值,记录数据。
1.2.8检测PGC-1α在鸢尾素抑制ACHN细胞生长中的关键作用
将ACHN均匀接种于培养皿,分为4组,即对照组、鸢尾素100 nmol/L组、鸢尾素100 nmol/L+sh-NC组、鸢尾素100 nmol/L+sh-PGC-1α组,处理细胞48 h后采用荧光显微镜观察病毒感染情况;采用qRT-PCR测定PGC-1α、UCP-1和PRDM16 mRNA表达情况;流式细胞仪检测细胞凋亡情况。
1.2.9检测UCP-1在鸢尾素抑制ACHN细胞生长中的关键作用
将ACHN均匀接种于培养皿,分为4组,即对照组、鸢尾素100 nmol/L组、鸢尾素100 nmol/L+sh-NC组、鸢尾素100 nmol/L+sh-UCP-1组,处理细胞48 h后采用荧光显微镜观察病毒感染情况;采用qRT-PCR测定PGC-1α、PRDM16和UCP-1基因mRNA表达情况;流式细胞仪检测细胞凋亡情况。
1.3 统计学处理
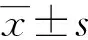
2 结 果
2.1 鸢尾素对ACHN细胞存活率及褐变的影响
经过20、50和100 nmol/L鸢尾素处理48 h后,ACHN细胞存活率无明显变化,差异无统计学意义(P>0.05)。当鸢尾素浓度增至200和400 nmol/L时,细胞存活率呈明显降低趋势,差异有统计学意义(P<0.05)。经鸢尾素处理48 h后,PGC-1α、UCP-1表达水平升高(P<0.05),且具有浓度依赖性,100 nmol/L鸢尾素处理后PGC-1α和UCP-1的表达增加最明显,见图1。
A:CCK-8试剂检测鸢尾素处理细胞48 h后细胞的存活率;B:Western blot检测棕色化相关蛋白的表达情况;C:qRT-PCR检测棕色化相关基因mRNA表达情况;D:对Western blot结果进行定量分析;a:P<0.05,与对照组比较。
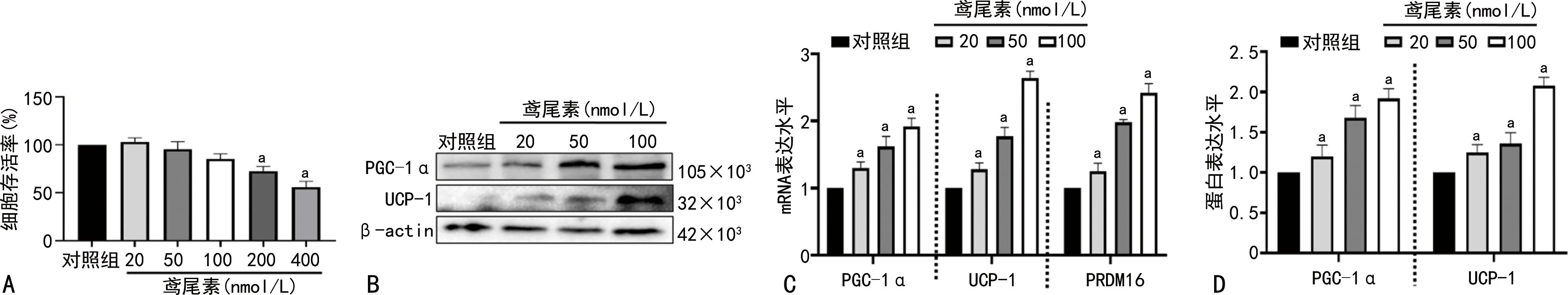
2.2 鸢尾素对ACHN细胞凋亡及迁移的影响
细胞凋亡结果显示,鸢尾素能够促进ACHN的细胞凋亡(P<0.05)。划痕实验显示,鸢尾素抑制ACHN的细胞迁移(P<0.05),见图2。
A:流式细胞术检测鸢尾素处理后细胞凋亡情况;B:流式结果统计分析计算细胞凋亡率;C:鸢尾素处理细胞48 h后进行划痕实验,24 h后观察细胞的迁移情况(50×);D:对划痕实验结果进行统计分析计算细胞迁移率;a:P<0.05,与对照组比较。
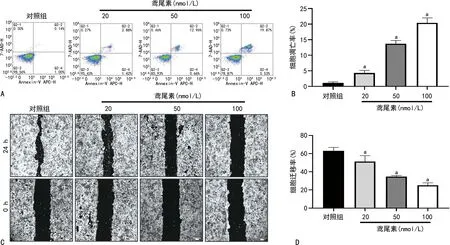
2.3 鸢尾素对ACHN细胞自噬及噬脂的影响
与对照组比较,鸢尾素的加入使得自噬相关Beclin-1和LC3Ⅱ/Ⅰ mRNA表达水平明显升高(P<0.05),p62 mRNA表达水平明显降低(P<0.05)。油红O染色结果显示,鸢尾素在ACHN中以浓度依赖方式促进细胞噬脂,在100 nmol/L的鸢尾素中脂滴最少,噬脂最明显(P<0.05),见图3。
A:qRT-PCR检测鸢尾素处理后自噬相关基因mRNA的表达情况;B:油红O染色检测鸢尾素处理对细胞脂滴聚集的影响(40×);C:酶标仪检测A510值;a:P<0.05,与对照组比较。
2.4 PGC-1α在鸢尾素抑制ACHN细胞生长中的关键作用
PGC-1α会削弱鸢尾素对ACHN的影响,见图4。
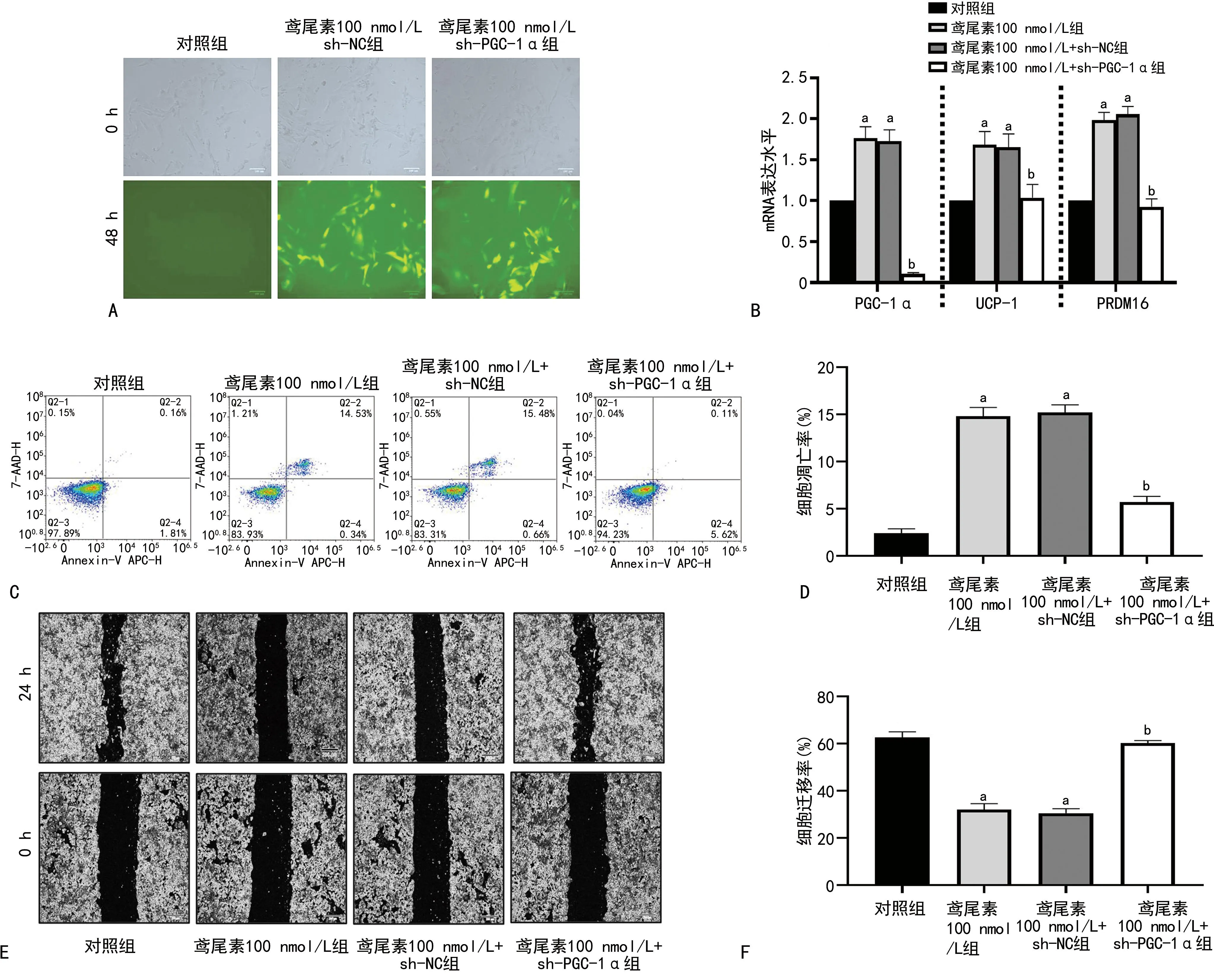
A:荧光观察慢病毒sh-PGC-1α感染效果(100×);B:qRT-PCR检测慢病毒sh-PGC-1α感染后棕色化相关基因mRNA表达情况;C:流式细胞术检测慢病毒sh-PGC-1α感染对鸢尾素处理细胞后细胞凋亡的影响;D:对流式细胞术检测结果进行统计分析计算细胞凋亡率;E:划痕实验检测慢病毒sh-PGC-1α感染对鸢尾素处理细胞后的细胞迁移的影响(50×);F:对划痕实验结果进行统计分析计算细胞迁移率;a:P<0.05,与对照组比较;b:P<0.05,与鸢尾素100 nmol/L组比较。
2.5 UCP-1在鸢尾素抑制ACHN细胞生长中的关键作用
UCP-1制会削弱鸢尾素对ACHN的影响,见图5。
3 讨 论
肿瘤微环境中的癌细胞,在肿瘤发展过程中营养可得性不断变化,常常利用脂质代谢来获取能量、生物膜成分,以便于支持其快速增殖、存活、迁移、侵袭、转移及对肿瘤微环境影响和癌症治疗的响应所需的信号分子[12-13],因此,脂质代谢异常成为癌症中最明显的代谢改变之一,不可忽视,现已证实脂质代谢异常与肾细胞癌、前列腺癌、子宫内膜癌、乳腺癌、宫颈癌、卵巢癌、胃癌和直肠癌发展密切相关[14-17],肾细胞癌被定义为脂质积累和储存的代谢性疾病,仅2018年全球就出现了40万新病例和17.5万死亡病例(全球癌症观测站)。现已证实,异常的脂质积累和储存为肾细胞癌的发展提供必不可少的提供能量支持。
正常情况下,米/褐色脂肪细胞属于沉睡静息状态,但在特定的条件下如机体受到寒冷刺激[18]或运动时[8],白色脂肪细胞可以转化为米/褐色脂肪细胞,这一过程被称之为“褐变”,褐变过程中会伴随着棕色化标记物(PGC-1α、UCP-1、PRDM16)的增加[19-21]。PGC-1α是能量代谢和脂质稳态的关键调节剂,与糖尿病和肥胖的代谢紊乱有关,有研究报道,与正常组织相比,肾细胞癌组织中PGC-1α表达降低,数据显示患者预后不良与癌症基因组图谱(TCGA-KIRC)中PGC-1α表达降低有关,且PGC-1α在肾细胞癌中的下调与疾病进展密切相关[22]。UCP-1又名增温素,能够促进线粒体解耦联氧化磷酸化,抑制细胞线粒体膜上三磷酸腺苷(ATP)的合成,促进机体产热而不依赖ATP,以此增强生理状态下机体的产热反应。肿瘤“瘦身”是一种新的概念,即具有异常脂质的肿瘤细胞有效消耗脂质来抑制肿瘤的发展,而不产生额外的ATP[11]。有研究报道,PLCL1在肾细胞癌中下调,当恢复肾细胞癌细胞中PLCL1表达时通过增加UCP-1的泛素化可明显抑制肿瘤进展,减少异常脂质积聚,因此PLCL1/UCP-1介导的脂质褐变对肾细胞癌细胞有促进“瘦身”并消耗异常的脂质堆积作用,从而抑制肾细胞癌的进展。现已证实UCP-1介导的脂质褐变能够促进肾癌细胞“瘦身”进而抑制肿瘤进展[23]。
自噬是指在饥饿和损伤等应激条件下细胞在双层膜中形成自噬体,然后自噬体与溶酶体融合形成自溶体,降解内容物,为细胞生存提供能量的适应性过程[24]。已被证实自噬抑制了肾细胞癌的增殖[25],LncRNA SCAMP1通过miR-429调控ZEB1/JUN和自噬,促进氧化应激下儿童肾细胞癌的发生[26]。
2012年,科学家发现了一种新的肌肉因子——鸢尾素[27],它是由FNDC5裂解产物,经蛋白水解酶剪切后形成的多肽片段,由112个氨基酸残基多肽片段组成,分子量为12×103,其氨基酸序列在大多数哺乳动物中高度保守,是一种与运动相关的、可调节糖脂代谢的新型肌肉因子,具有改善胰岛素抵抗、促进白色脂肪棕色化、减轻体重等作用,是很具前景的代谢性疾病防治靶点。近些年研究证实鸢尾素主要在糖尿病、肥胖等代谢性疾病和癌症方面发挥作用[28-30]。
本课题组试图通过加入鸢尾素,探讨其能否通过噬脂与脂质褐变消除异常脂质沉积,进而抑制ACHN细胞生长发展的目的。随着鸢尾素浓度的增加,PGC-1α和UCP-1蛋白表达逐渐增加,表明鸢尾素引起PGC-1α和UCP-1蛋白表达变化呈现剂量依赖性;流式结果显示,鸢尾素的浓度增加,肿瘤细胞的凋亡率逐渐升高;利用划痕实验来探讨鸢尾素对肿瘤细胞迁移的影响,结果显示鸢尾素可明显抑制细胞迁移。此外,本研究进一步探讨鸢尾素各浓度在引起自噬和噬脂中的影响,Western blot结果显示,自噬相关Beclin-1和LC3Ⅱ/Ⅰ mRNA表达水平明显降低,与此同时,p62 mRNA表达水平明显升高,表明鸢尾素可促进细胞自噬。油红O染色结果进一步佐证了鸢尾素可促进噬脂,减少细胞脂肪的异常沉积,这就有可能使得细胞“瘦身”增加肿瘤细胞凋亡。为了进一步探究PGC-1α和UCP-1在肿瘤细胞中的作用,构建PGC-1α和UCP-1慢病毒并将其转染进细胞中,发现鸢尾素可增加肿瘤细胞凋亡并抑制细胞迁移,但下调PGC-1α和UCP-1的表达之后,上述作用被逆转,证实PGC-1α和UCP-1在鸢尾素抑制ACHN进展中发挥的关键性作用。
综上所述,鸢尾素能够明显抑制ACHN细胞迁移和增殖,且增加了ACHN细胞凋亡,这一作用的产生与激活噬脂和脂质褐变密切相关,其机制可能与下调PGC-1α和UCP-1蛋白在细胞的表达有关。本课题组通过探究鸢尾素对ACHN的影响及PGC-1α、UCP-1的关键性作用,为临床的治疗肾细胞癌提供了一定的理论依据和新的方向。但局限的是,目前只在细胞水平证明鸢尾素对肾细胞癌的影响,在动物水平是否有同样的结果还需要进一步验证。

