基于出芽短梗霉发酵法制备β-聚苹果酸
谭 昕 ,康建平,2* ,李佳逸 ,何雨静,2 ,王燕来 ,何 勇
(1.四川省纺织科学研究院有限公司,成都 610083;2.高技术有机纤维四川省重点实验室,成都 610083)
β-聚苹果酸(Polyβ-malic acid,β-PMLA)是一种重要的高分子聚合物,以苹果酸为唯一单体且具有完全生物可降解性,因主链上含有酯键而被称为聚酯类化合物,由Shimada等人于1969年首次发现[1-2]。传统的聚苹果酸生产工艺主要依赖化学合成法,然而这种方法存在着原料有限、环境污染和工艺复杂等问题[3-4]。为此,发酵生产聚苹果酸成为了一种可行的替代方案[5-7]。
对出芽短梗霉的培养条件和培养基组分进行调整,可实现β-PMLA 的发酵过程优化。对出芽短梗霉发酵生产β-PMLA 的工艺进行深入研究和优化。通过通过改变出芽短梗霉Aureobasidium pullulans的发酵、碳源、氮源、p H 值及氨基酸种类,期望优化β-聚苹果酸发酵生产的工艺条件,实现β-聚苹果酸产量的最大化和工艺的最优化。研究结果有助于推动出芽短梗霉发酵生产β-聚苹果酸工艺的进一步发展,并为β-聚苹果酸的工业化生产提供技术支持。
1 材料与方法
1.1 试验材料
1.1.1 菌 种
出芽短梗霉Aureobasidium pullulans40331,Aureobasidiumpullulans2696,由中国工业微生物菌种保藏中心提供。
1.1.2 培养基
(1)斜面培养基:PDA 培养基[8]。
(2)种子培养基/(g·L-1):蔗糖60.0,酵母膏3.0,丁二酸2.0,硫酸铵1.0,K2CO30.4,KH2PO40.1,MgSO4·7 H2O 0.1,ZnSO4·7 H2O 0.005,玉米浆0.1%,CaCO320.0(单独灭菌)。
(3)发酵培养基/(g·L-1):蔗糖100.0,蛋白胨35.0,KH2PO40.1,NaNO32.0,MgSO4·7H2O 0.3,KCl 0.5,MgSO40.05,CaCO320.0(单独灭菌)[9]。
1.1.3 主要设备
LC-2023C高效液相色谱仪(上海纳锘实业有限公司)、BKQ-B75Ⅱ立式高压蒸汽灭菌器(博科控股集团有限公司)、BHC-1300A2生物安全柜(上海丙林电子科技有限公司)、SN-SPX-150B 生化培养箱(上海尚仪仪器设备有限公司)、ZWY-2102C摇床(上海智城分析仪器制造有限公司)、XJ620M 分析天平(上海天美天平仪器有限公司)、PHSJ-6L 型酸度计(上海仪电科学仪器股份有限公司)、TGL-16M 离心机(湖南湘仪离心机仪器有限公司)。
1.2 试验方法
1.2.1 斜面培养
将4 ℃斜面保存的出芽短梗霉菌株转接到新鲜的PDA 斜面上于25 ℃培养4~5 d。
1.2.2 种子培养
将种子培养基分装在500 m L 锥形瓶中,每瓶90 m L培养基,在121 ℃下灭菌20 min。于无菌条件下,用10 m L无菌生理盐水洗下培养基表面的孢子,制成孢子悬液,按照10%(V/V)的接种量,取10 m L 接种到装有90 m L种子培养基的500 m L 锥形瓶中,置于恒温25 ℃、转速250 r/min的摇床上培养48 h。
1.2.3 摇瓶发酵培养
将制备好的种子液混合均匀,在无菌环境下按10%(V/V)的接种量,取10 m L接种到装有90 m L发酵培养基的500 m L 锥形瓶中,置于恒温25℃、转速250 r/min的摇床上培养时间6 d。
1.2.4 发酵工艺条件优化
考察发酵p H 值、碳源、氮源、氨基酸等因素对β-PMLA 产量及分子量的影响,得出出芽短梗霉发酵产β-PMLA 的优化工艺条件。
1.3 分析方法
1.3.1 β-PMLA的测定方法[10]
取10 m L 发酵液,经转速12 000 r/min 离 心10 min除去菌体,取5 m L上清液加入等体积1 mol/L的H2SO4溶液,调节温度90 ℃,水解12 h,将聚苹果酸完全水解为单体苹果酸。高效液相色谱法(HPLC)检测水解前后苹果酸的含量,两者之差即为聚苹果酸的产量。
式中:C聚为聚苹果酸的质量浓度,g/L;C后为苹果酸水解后的质量浓度,g/L;C前为苹果酸水解前的质量浓度,g/L。
1.3.2 β-PMLA分子量的测定方法
采用凝胶渗透色谱法进行分子量的测定。GPC检测β-PMLA 分子量的条件:色谱柱为凝胶色谱柱(8.0 mm×300 mm);柱温25 ℃;参比池温度30 ℃;流动相为5 mmol/L Na2SO4溶液;进样量20μL;p H自然;流速0.5 m L/min。
1.3.3 pH值的测定方法
采用p H 计进行测定。
2 结果与讨论
2.1 出芽短梗霉合成β-PMLA的产量及分子量
图1为苹果酸标准曲线,将不同浓度的苹果酸标准样品进行测定,以苹果酸质量浓度为横坐标,色谱峰面积为纵坐标做线性回归,得到L-苹果酸标准样品线性方程y=428x+287.78(R2=0.998 8)。
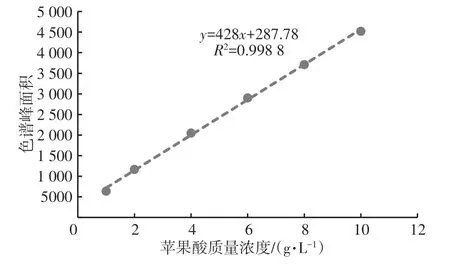
图1 L-苹果酸标准曲线
由图2 和图3 可知,通过液相色谱法检测得到Aureobasidium pullulans2696 和Aureobasidium pullulans40331两株菌株所产苹果酸的出峰时间及峰面积,代入标准曲线计算,得到浓度分别为13.46 g/L和9.51 g/L。

图2 Aureobasidium pullulans 2696所产苹果酸水解前后液相色谱图
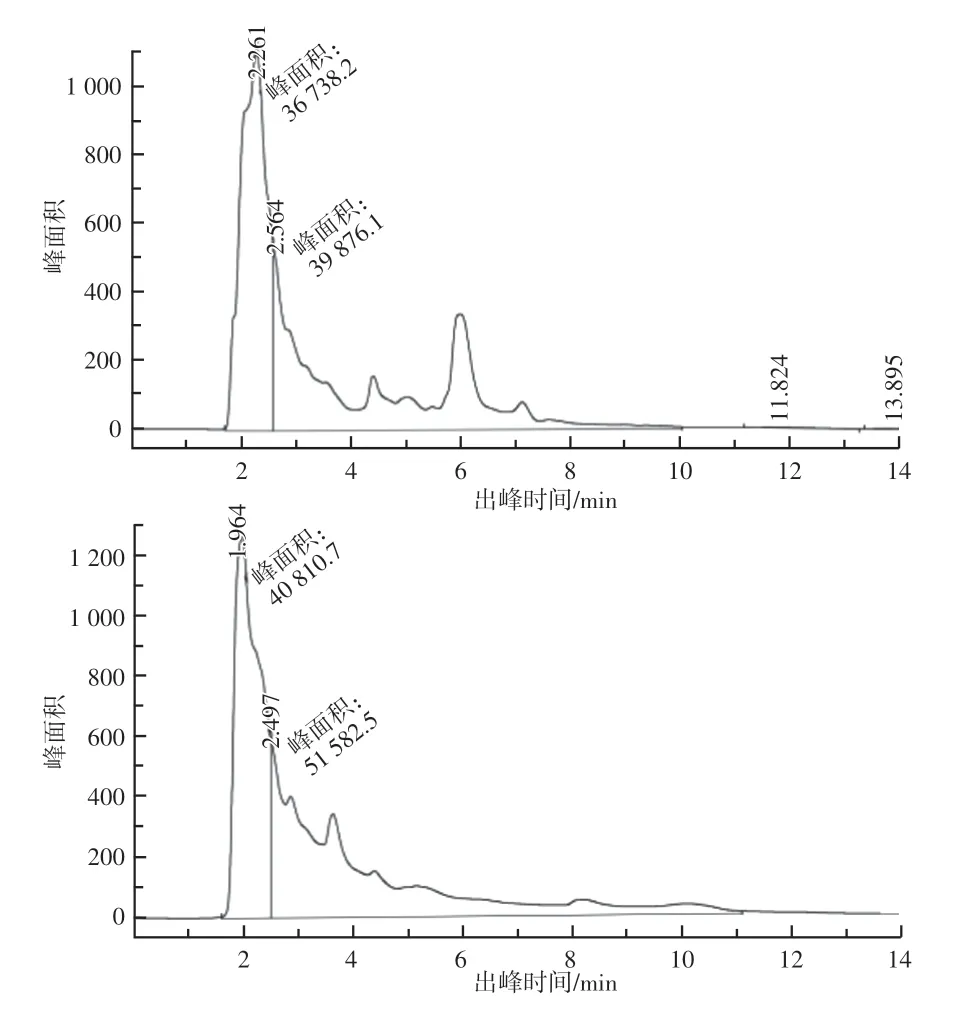
图3 Aureobasidium pullulans 40331所产苹果酸水解前后液相色谱图
采用凝胶渗透色谱法测试发酵上清液,得到Aureobasidiumpullulans2696和Aureobasidiumpullulans40331所产β-PMLA 的分子量分别为6 532 Da和7 457 Da。
2.2 发酵条件优化对β-PMLA产量及分子量的影响
根据上述试验结果,Aureobasidium pullulans2696所产β-PMLA产量为13.46 g/L,分子量为7 457 Da,均优于Aureobasidiumpullulans40331。选取Aureobasidiumpullulans2696作为优化发酵条件的试验菌株。
2.2.1 碳源对β-PMLA发酵结果的影响
选取蔗糖、葡萄糖和木糖分别作为碳源进行发酵,浓度100 g/L,培养时间6 d。测定β-PMLA 的产量和分子量,结果如图4、5 所示。碳源的添加均对β-PMLA 的产量和分子量有促进作用。其中葡萄糖发酵生产β-PMLA 的产量和分子量分别为16.84 g/L、7 920 Da,发酵效果最好,较空白组产量提高了25.11%,分子量提高了6.21%;蔗糖的促进效果次之,木糖的更低。这一结果与文献[11-12]报道一致。

图4 不同碳源对β-PMLA 产量的影响

图5 不同碳源对β-PMLA 分子量的影响
2.2.2 氮源对β-PMLA发酵结果的影响
分别选取硝酸钠、尿素、硫酸铵和丁二酸铵作为氮源进行发酵,浓度2 g/L,培养时间6 d。测定β-PMLA的产量和分子量,结果如图6、7所示。丁二酸铵作为氮源时,β-PMLA产量为15.89 g/L,分子量为7 680 Da,其他3种次之,且添加硫酸钠时发酵所产β-PMLA 的分子量相较于空白组更低。

图6 不同氮源对β-PMLA 产量的影响

图7 不同氮源对β-PMLA 分子量的影响
2.2.3 pH值对β-PMLA发酵结果的影响
参考已有文献[13],出芽短梗霉产聚苹果酸的最适p H 值偏酸。通过设置发酵液的初始p H 值为3.0、3.5、4.0、4.5、5.0,探究其对发酵效果的影响,结果如图8所示。p H 值在4.0时β-PMLA 产量最高,达到15.31 g/L。p H 值为4.0~4.5之间分子量变化不大,并在此后逐渐降低。故选取4.0作为出芽短梗霉产β-PMLA 的 最适p H 值。
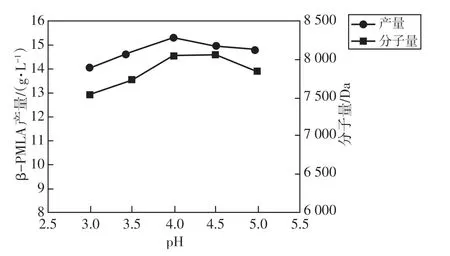
图8 p H 对β-PMLA 产 量及分子量的影响
2.2.4 氨基酸对β-PMLA发酵结果的影响
通过预试验选取了亮氨酸、天冬氨酸、谷氨酸、苏氨酸及丙氨酸5种对出芽短梗霉发酵有促进作用的氨基酸,按照摇瓶发酵法进行培养,结果如图9、10所示。分别添加5种氨基酸的培养基所产β-PMLA 的产量及分子量均有一定程度提升,其中添加亮氨酸和天冬氨酸效果最佳。添加亮氨酸较优化前产量提升了28.75%,分子量较优化前提升了15.4%,添加天冬氨酸较优化前产量提升了20.43%,分子量较优化前提升了15.94%。
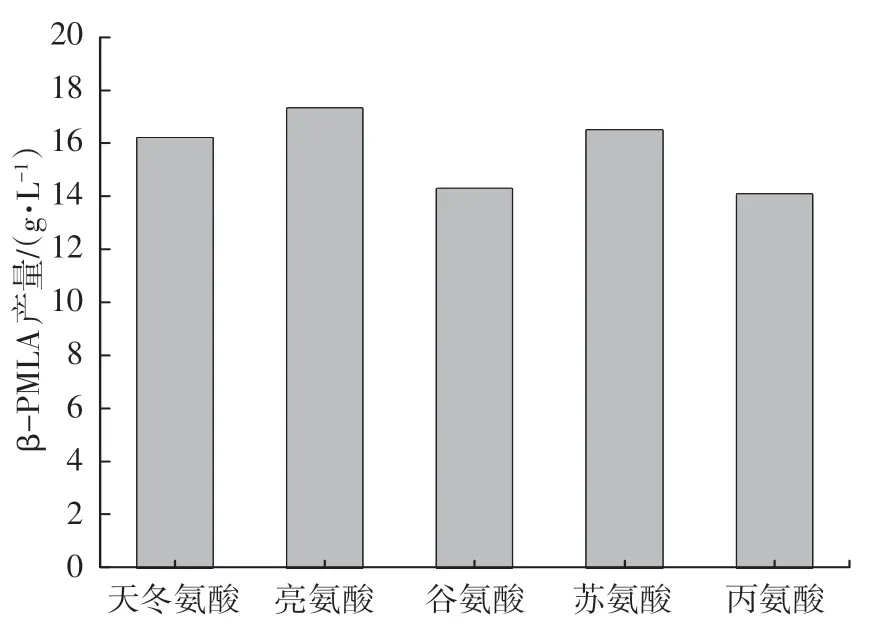
图9 不同氨基酸对β-PMLA 产量的影响

图10 不同氨基酸对β-PMLA 分子量的影响
3 结束语
优化了出芽短梗霉Aureobasidium pullulans发酵产β-PMLA 的培养条件和培养基组分,通过调控发酵初始p H、碳源、氮源及氨基酸种类,得到最佳培养条件和培养组分为:100 g/L葡萄糖,35 g/L蛋白胨,2 g/L丁二酸铵,0.1 g/L KH2PO4,0.3 g/L MgSO4·7H2O,0.5 g/L KCl,0.05 g/L MgSO4,0.5 g/L 亮氨酸,20 g/L CaCO3,p H 为4.0,发酵温度25℃,培养时间6 d。在该条件下进行发酵培养,PMLA 的产量较优化前提高了80.53%,最终为24.3 g/L,分子量提高了20.0%,最终为8 948 Da。

