氧化铝/聚四氟乙烯热化学反应特性及影响因素
刘瑞华,王亚军,万 奕,甘 强
(北京理工大学 爆炸科学与安全防护国家重点实验室,北京 100081)
引 言
亚稳态分子间复合物,又称纳米铝热剂,是由纳米金属(如铝、镁等)与氧化剂(如金属氧化物、氟聚物等)组成,能够储存大量化学能并且在需要时快速释放,具有高能量密度和出色反应特性的一种新型含能材料[1-4]。传统铝热剂以金属氧化物为氧化剂,存在反应不完全和能量释放率低的缺陷,铝/聚四氟乙烯(Al/PTFE)反应材料由于具有较低的点火温度、较大的产气量、较低的铝粉(复合材料中)团聚程度和较高的体系能量释放率等优点,成为含能材料领域的一大研究热点[3, 5-11]。研究发现,在纳米Al与PTFE的反应过程中,PTFE的分解产物会与Al表面的氧化层发生放热反应,此反应又会继续促进PTFE的分解,被称为预点火反应(Pre-ignition Reaction,PIR)[12]。预点火反应由Al颗粒表面的Al2O3的氟化反应控制,能够增加活性Al与外界之间的接触面积,从而促进反应进行,提高反应速率,并释放更多热量[13-14]。
对于预点火反应,已有一些实验结果和相关研究。何丽蓉等[15]研究发现,由于γ-Al2O3的存在,富燃料配比的n-Al/n-PTFE在470~520℃区间出现了预点火现象。吴家祥等[16]研究发现,加入少量纳米Al2O3的Al/PTFE材料的放热性能有所提升,反应更加剧烈。Padhye等[17]研究认为PIR的激烈程度与Al2O3的表面羟基密度成正比。Hobosyan等[18]研究发现,微米Al粉表面的Al2O3在高升温速率下具有化学活性。胡万翔等[19]、毛亮等[20]研究发现,粒径小于50nm的Al粉表面的Al2O3在加热条件下能与PTFE的分解产物发生反应。Osborne等[12]研究认为,Al2O3与PTFE的反应放热由Al2O3与PTFE分解产物的反应放热和AlF3晶型转变放热两部分组成。Pantoya等[21]研究发现,小尺寸和高比表面积的Al2O3能延迟PTFE的分解,降低反应产物AlF3晶型转变的起始温度,从而促进PIR的进行。研究认为,可以通过改变PIR来调整Al/PTFE复合材料的整体反应性能,以满足应用需求。
目前,PIR的相关研究多以Al和PTFE为研究对象,对PIR的具体影响因素、反应条件和反应机理的研究仍处于初步阶段。深入了解不同条件(如反应物粒径、晶型等)下Al2O3与PTFE的热化学反应行为,能够进一步探究各种因素对PIR的影响,可为PIR机理研究提供一定支撑,并且通过分析不同条件下PIR对Al/PTFE放热性能的影响,可为Al/PTFE性能的改进提供思路。为研究不同条件下Al2O3与PTFE的热化学反应行为,本研究采用超声混合法制备Al2O3/PTFE复合粉体材料,采用扫描电子显微镜(SEM)、X射线衍射仪(XRD)和傅里叶变换红外光谱仪(FT-IR)对样品的微观形貌和晶体结构等进行观察和表征,采用差式扫描量热(DSC)和热重(TG)法研究反应物粒径、Al2O3晶型和升温速率等对复合材料热反应性能的影响。
1 实 验
1.1 试剂与仪器
α-Al2O3粉末(粒径分别为30、50、80、200nm),纯度99.9%,上海麦克林生化科技有限公司;γ-Al2O3粉末(10nm),纯度99.9%,上海麦克林生化科技有限公司;PTFE(平均粒径1μm和5μm),上海麦克林生化科技有限公司;无水AlCl3,纯度99%,福晨(天津)化学试剂有限公司;NaOH,纯度98%,上海迈瑞尔化学技术有限公司;无水乙醇,优级纯,北京化工厂;去离子水,实验室自制。材料的纯度和粒径数据均由供应商提供,所有材料均在没有进一步处理的情况下使用。
KQ100B超声清洗器,昆山市超声仪器有限公司;DZF-6020电热真空干燥箱,上海一恒科学仪器有限公司;H1850台式高速离心机,湘仪集团;TCXC-1200型高温马弗炉,上海仝科电炉设备有限公司;S-4800型扫描电子显微镜(SEM),日本HITACHI;Netsch Jupiter F3同步热分析仪(DSC-TG),德国耐驰;D8 advance X射线衍射仪(XRD),德国Bruker;TENSOR 27傅里叶变换红外光谱仪(FT-IR),德国Bruker。
1.2 无定形Al2O3的制备
纳米Al表面自然氧化形成的氧化层通常为无定形Al2O3。因此,本研究自制了无定形纳米Al2O3。以无水AlCl3和NaOH为原料,采用化学沉淀法制备无定形Al2O3。首先,向AlCl3溶液中缓慢滴加NaOH溶液,至白色沉淀不再增加,采用离心机分离得到Al(OH)3凝胶;将所得凝胶置于100℃真空干燥箱内干燥后,研磨得到Al(OH)3粉末;最后,将粉末在马弗炉内于300℃焙烧3h,得到无定形Al2O3粉末。制备流程见图1。
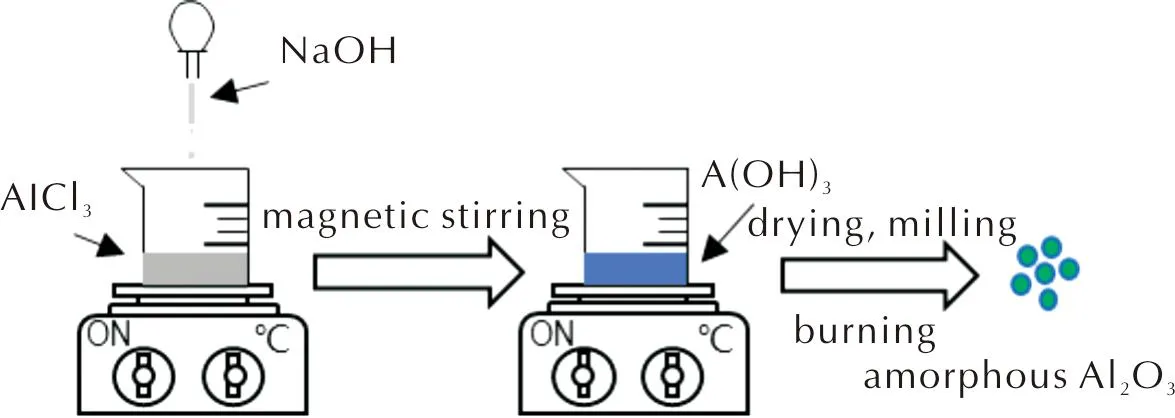
图1 无定形Al2O3的制备流程示意图Fig.1 Schematic diagram of preparation process of amorphous Al2O3
1.3 Al2O3/PTFE复合材料的制备
采用超声混合法[22]制备Al2O3/PTFE复合材料。根据两种材料理论化学反应式Al2O3+1.5/n(—C2F4—)n→2AlF3+3CO,将不同粒径(30、50、80、200nm)和晶型(α型、γ型、无定形)的Al2O3与PTFE(1μm、5μm)按质量比为34∶66混合均匀,加入分散剂无水乙醇;将混合液磁力搅拌30min,超声30min,再磁力搅拌1h;最后,将所得悬浊液进行离心处理,得到Al2O3/PTFE混合物;在真空干燥箱内于80℃干燥,研磨得到Al2O3/PTFE复合物粉末。制备流程如图2所示。
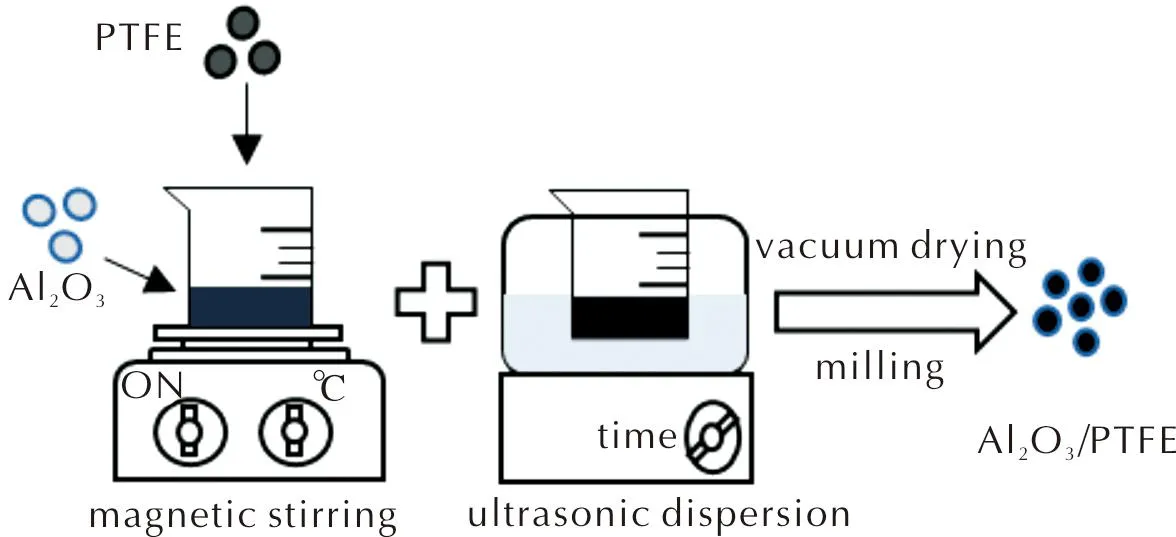
图2 Al2O3/PTFE材料的制备流程示意图Fig.2 Schematic diagram of preparation process of Al2O3/PTFE
1.4 性能表征
采用SEM对材料的微观形貌进行观察和表征;采用DSC-TG分析材料的热化学性能,热分析条件为:样品用量10mg, Pt坩埚,坩埚不加盖,高纯氩气(Ar),温度范围298~1198K,加热速率为10、15、20K/min;采用XRD对晶体结构进行表征;采用FT-IR对材料成分进行表征。
2 结果与讨论
2.1 微观形貌分析
图3为Al2O3和Al2O3/PTFE复合物的SEM图。由图3(a)可知,无定形Al2O3基本为球形颗粒状,平均粒径约为50nm。由图3(a)~(c)可以看出,各晶型Al2O3均存在较严重的团聚现象。由于3种晶型的Al2O3与PTFE制备的Al2O3/PTFE复合材料在微观形貌上无明显差异,因此仅给出1μm PTFE为组分的复合材料的SEM结果。如图3(d)~(f)所示,Al2O3呈球形颗粒状,较为均匀地吸附在PTFE表面,由于纳米Al2O3粒径较小,存在一定的团聚现象。


图3 Al2O3和Al2O3/PTFE材料的SEM图Fig.3 SEM images of Al2O3 and Al2O3/PTFE materials
2.2 结构分析
对粒径为50nm的α-Al2O3、1μm的PTFE及二者制备得到的Al2O3/PTFE材料进行结构分析。
由于无定形Al2O3在XRD中没有明显的特征衍射峰,因此通过研究中间产物的成分来进一步确认最终产物成分。采用XRD对化学沉淀法得到的中间产物和300℃焙烧后的产物进行表征,结果如图4所示。可以看出,中间产物存在明显的Al(OH)3的特征衍射峰,没有其他杂质;焙烧后产物没有检测到明显的结晶Al2O3特征衍射峰,说明焙烧后所得产物为无定形Al2O3。
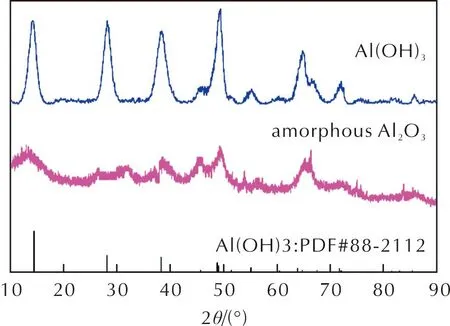
图4 无定形Al2O3制备过程的中间产物Al(OH)3和最终产物的XRD谱图 Fig.4 X-ray diffraction patterns of the intermediate product Al(OH)3 and the final product in the preparation of amorphous Al2O3
采用FT-IR对Al2O3、PTFE和Al2O3/PTFE材料反应前后的化学结构进行了表征分析(反应后成分取自加热速率为20K/min条件下的DSC-TG测试),结果见图5。
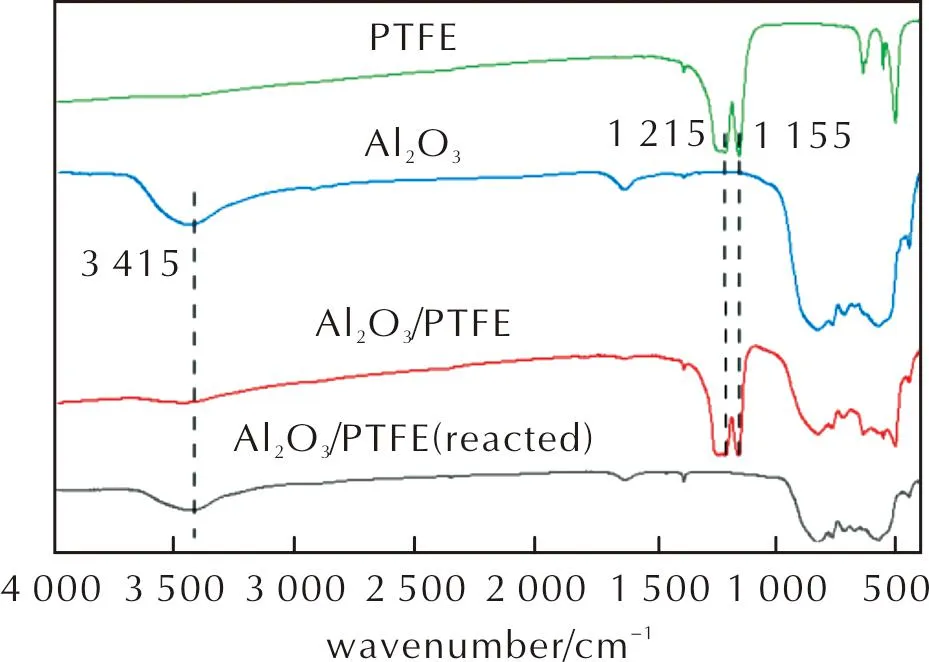
图5 Al2O3、PTFE和Al2O3/PTFE复合材料反应前后的FT-IR图谱Fig.5 FT-IR spectra of Al2O3, PTFE and Al2O3/PTFE composites before and after reaction
在图5中,3415cm-1处的峰是—OH的伸缩振动吸收峰;1215cm-1和1155cm-1处是—CF2的伸缩振动吸收峰,为PTFE的特征吸收峰;400~1000cm-1为Al—O的一系列振动吸收峰。对比发现,Al2O3/PTFE的FT-IR曲线中同时存在Al2O3和PTFE的特征振动吸收峰,说明在制备过程中,两种组分之间的结合是简单的物理混合作用。对比反应前后的Al2O3/PTFE曲线,反应后PTFE的—CF2特征吸收峰完全消失,而Al2O3的Al—O特征峰仍然存在,表明反应后PTFE完全分解,而Al2O3存在一定量残留。由于Al—F的振动吸收峰与Al—O的吸收峰非常接近,因此无法通过红外结果证明反应后生成了AlF3。
进一步采用XRD对Al2O3、PTFE和Al2O3/PTFE材料反应前后的成分进行表征,结果见图6。

图6 α-Al2O3、PTFE和α-Al2O3/PTFE反应前后的XRD谱图Fig.6 X-ray diffraction patterns of α-Al2O3, PTFE and α-Al2O3/PTFE composites before and after reaction
从图6可以看出,通过XRD检测出的物质主要有Al2O3、PTFE和AlF3。2θ在18.1°有明显的衍射峰,对应于PTFE,完全符合PTFE的标准卡片PDF#54-1595;2θ在25.5°、35.1°、37.8°、43.4°、52.6°、57.5°、66.5°、68.2°有较强的衍射峰,对应于α-Al2O3,符合标准卡片PDF#74-1081;2θ在31.4°、32.8°、36.7°、38.9°、44.8°、47.6°、64.0°、67.4°有较强的衍射峰,对应于θ-Al2O3,符合标准卡片PDF#35-1021;2θ在25.3°、42.6°、51.9°、58.1°有较强的衍射峰,对应于α-AlF3,符合标准卡片PDF#44-0231。
从XRD结果可以看出,Al2O3存在α和θ两种晶型,由于在实验过程中并未对Al2O3进行二次处理,因此θ-Al2O3应是制备材料不纯而含有的。Al2O3与PTFE混合时没有发生化学反应生成新的物质,两者之间的结合是物理作用。从Al2O3/PTFE的反应产物中检测出了AlF3的特征衍射峰 ,表明Al2O3和PTFE在高温下发生了化学反应。
2.3 反应物粒径对Al2O3/PTFE热化学反应性能的影响
图7为粒径1μm的PTFE在升温速率20K/min条件下的热分析结果。可以看出,PTFE在315.2℃左右转变为熔融态,产生一个小的熔融吸热峰;随着温度逐渐上升,PTFE由熔融态开始发生分解,并在576.9℃时产生一个较大的分解吸热峰,分解过程持续到约600℃结束,此时TG曲线显示的质量分数降为0 ,表明PTFE在600℃时已经完全分解,以气体形式逸散。

图7 升温速率20K/min下PTFE的TG-DSC曲线Fig.7 TG-DSC curves of PTFE at a heating rate of 20K/min
2.3.1 Al2O3粒径对Al2O3/PTFE热化学反应性能的影响
图8是以不同粒径的α-Al2O3和粒径为1μm的PTFE为原料制备的Al2O3/PTFE材料在升温速率20K/min条件下的热分析结果。
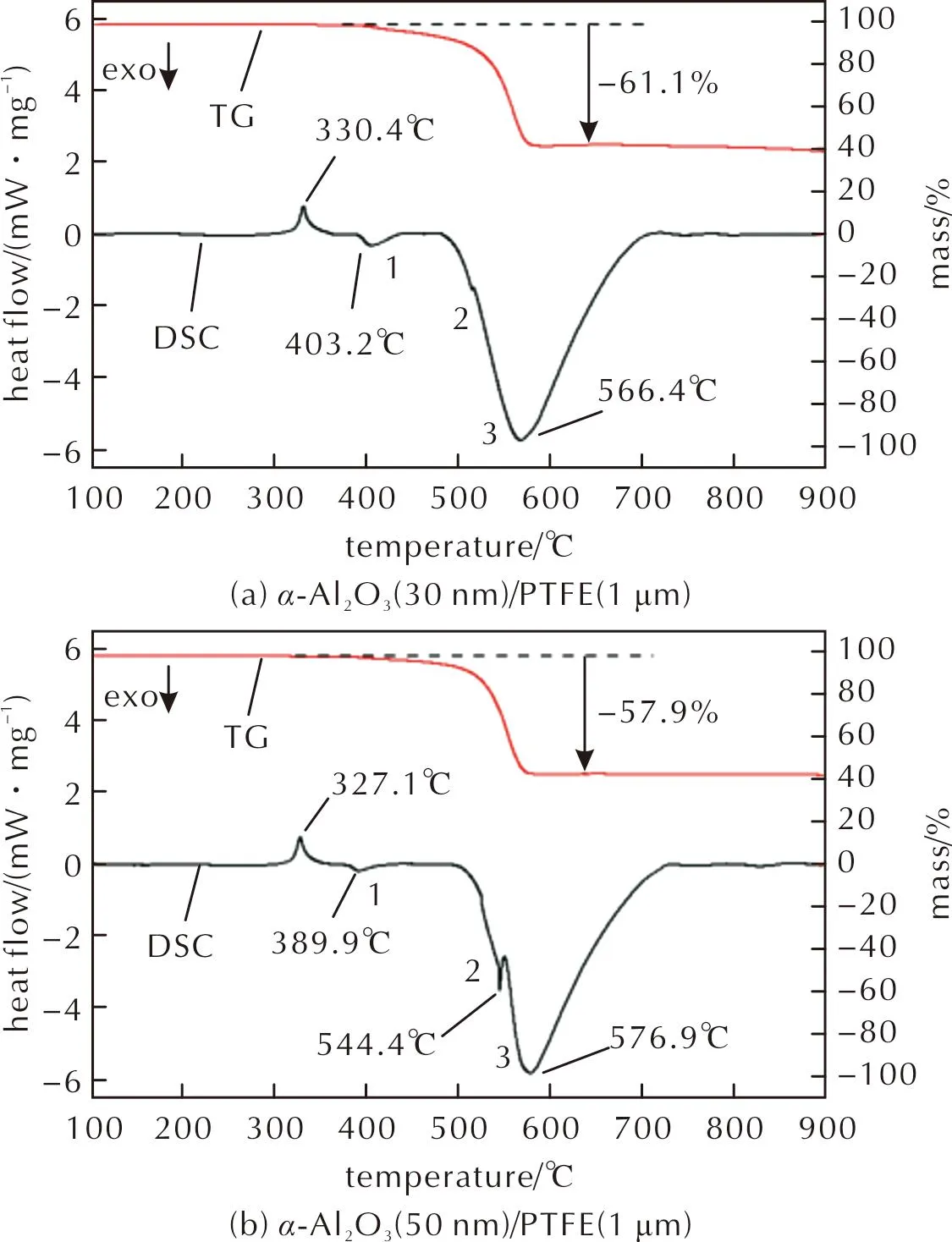
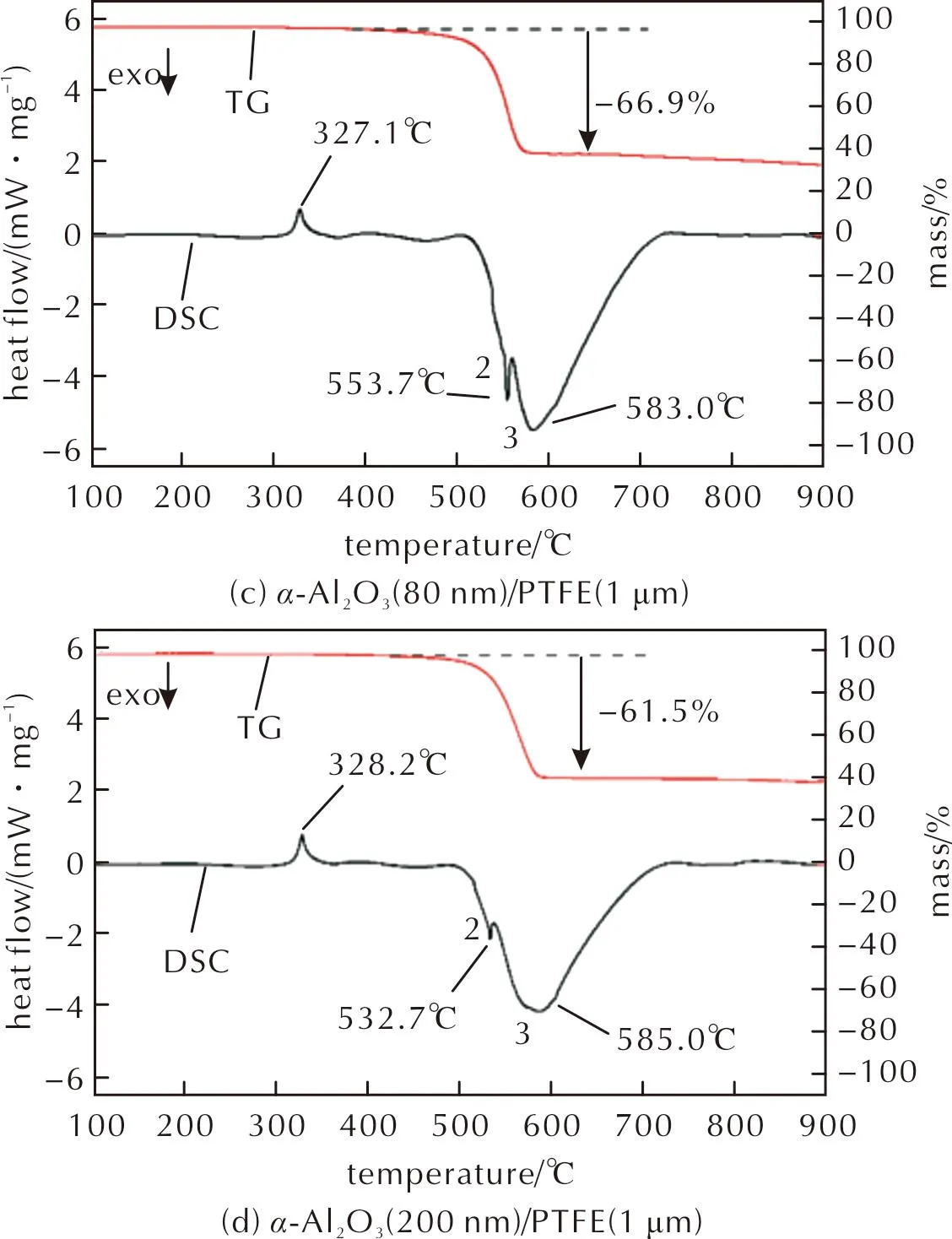
图8 不同粒径α-Al2O3/PTFE(1μm)的TG-DSC曲线Fig.8 TG-DSC curves of different particle sizes of α-Al2O3/PTFE (1μm)
由DSC曲线可以看出,各种复合材料中PTFE的熔化吸热温度均发生在327℃左右,相较图7中吸热峰的温度延迟了约10℃。图8(a)和(b)显示的α-Al2O3(30nm)/PTFE和α-Al2O3(50nm)/PTFE的DSC曲线中各出现了3个放热峰,峰1的峰值温度随Al2O3粒径增大而降低,当Al2O3粒径大于50nm后,该放热峰消失。峰2的峰值温度随Al2O3粒径增大先升高后降低,粒径为80nm时复合材料的峰值温度(553.7℃)最大。峰3的峰值温度随着Al2O3粒径的增大逐渐增大,且与峰2的温度差增大。通过对图8的放热峰曲线进行积分,得到α-Al2O3/PTFE材料的峰2、峰3的单位总放热量分别为572.6、552.0、538.8和433.7J/g。随α-Al2O3粒径增大,峰2和峰3的总放热量逐渐减小,当α-Al2O3粒径大于50nm后,放热量降低程度明显。上述峰值温度的变化趋势与Osborne等[12]对不同粒径的Al2O3和200nm PTFE的热分析结果相似。由于文献中的PTFE粒径(200nm)小于本研究所用粒径(1μm),反应温度存在一定差异。Pantoya等[21]认为,放热峰1和2是由生成AlF3的放热反应导致的,主放热峰则是由AlF3的晶型转变(β-AlF3转变为α-AlF3)引起的。基于上述文献结果,由于Al2O3粒径的减小降低了晶型转变的开始温度,并减小了放热峰2和3之间的峰值温度差,因此当Al2O3粒径为30nm时,放热峰2和3接近融合,在500~600℃只显示出一个放热量较大的放热峰。同时,由于峰2和峰3的峰值温度十分接近,因此峰3可能是由两种放热方式同时引起的,即AlF3的生成反应和其晶型转变。
在TG曲线中,质量损失的趋势在570~585℃基本结束,与DSC曲线中的主放热峰的峰值温度相符。由于PTFE在Al2O3/PTFE材料中质量分数为66%,若两者未发生反应,PTFE将完全分解,以气体形式逸散出体系(图7),材料的质量损失将在66%左右,而图8的TG结果显示质量损失均小于66%,因此,部分PTFE存在于材料体系中,参与了放热反应。在4种粒径体系中,α-Al2O3(50nm)/PTFE的质量损失最少 ,反应程度最高,其他几组Al2O3质量损失都在60%以上,反应程度较低。Al2O3粒径的增大,一方面使Al2O3与PTFE之间的粒径差减小,颗粒间接触面积增大,有利于Al2O3催化PTFE分解;另一方面导致Al2O3反应活性(比表面积)降低,这不利于Al2O3与PTFE分解产生的氟碳碎片相互接触并发生反应,两者综合影响使得粒径为50nm的Al2O3与1μm的PTFE反应程度最高。
综合上述结果,Al2O3粒径越小,其越容易与PTFE发生放热反应,AlF3生成反应的起始温度和晶型转变温度越接近,最终反应放热越集中,放热量越大。
2.3.2 PTFE粒径对Al2O3/PTFE热化学反应性能的影响
α-Al2O3(50nm)/PTFE(5μm、1μm)在升温速率为20K/min下的热分析结果见图9。不同于α-Al2O3/PTFE(1μm),α-Al2O3/PTFE(5μm)的DSC曲线中存在两个明显的放热峰(峰2和3),峰值温度均向高温区移动,且放热峰之间的温度差明显增大。随着PTFE粒径的增大,主反应峰(峰3)的放热量降低。结合2.3.1节的分析,PTFE粒径的减小导致AlF3生成反应和晶型转变的起始温度提前,并使两个反应峰的峰值温度差减小,增大了反应的集中放热量。
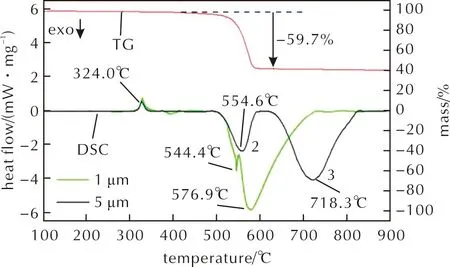
图9 α-Al2O3(50nm)/PTFE(5μm、1μm)的热分析曲线Fig.9 Thermal analysis curves of α-Al2O3 (50nm)/PTFE (5μm,1μm)
在TG曲线中,α-Al2O3/PTFE(5μm)的质量损失为59.7%,反应程度低于α-Al2O3/PTFE(1μm)。随PTFE粒径增大,PTFE与Al2O3的粒径差增大,颗粒之间的接触面积减小,导致反应程度下降。
图9中峰2结束时,TG曲线已经趋于平稳,此时PTFE分解结束,峰2为生成AlF3的放热反应;峰3发生时PTFE已不存在于体系中,此时的放热峰是由AlF3的晶型转变导致的,符合Pantoya等[21]的研究结果。
综上所述,PTFE粒径增大会导致反应程度降低,同时延缓了AlF3的晶型转变,导致最终放热不集中,并且放热量较少。
2.4 Al2O3晶型对Al2O3/PTFE热化学反应特性的影响
以不同晶型Al2O3和粒径为1μm的PTFE为原料制备Al2O3/PTFE材料,并进行了热化学反应分析,结果见图10,并将α-Al2O3(50nm)/PTFE(1μm)的DSC曲线合并在图中进行对比。
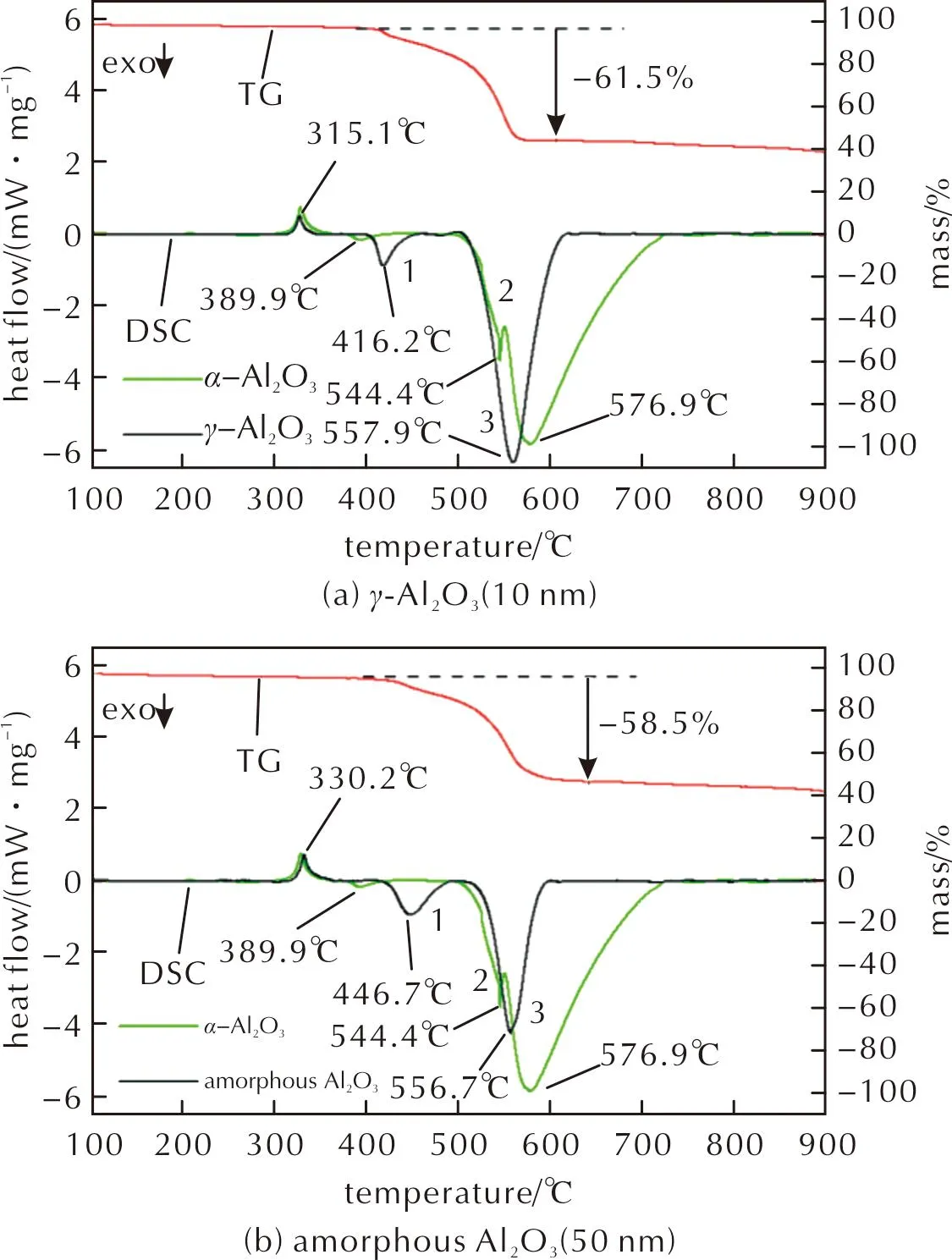
图10 不同晶型Al2O3/PTFE(1μm)的热分析曲线Fig.10 Thermal analysis curves of different crystalline phases of Al2O3/PTFE (1μm)
不同晶型Al2O3/PTFE的DSC曲线中均存在两个明显的放热峰(峰1和峰3),而α-Al2O3还存在一个放热峰2,由于α-Al2O3的峰2和峰3的峰值温度仅相差32.5℃,认为两处放热峰发生的是同样的放热反应。不同晶型Al2O3/PTFE的放热峰1和3之间的峰值温度差不同,其中无定形Al2O3/PTFE的温度差最小,α-Al2O3/PTFE的温度差最大。通过对放热峰曲线进行积分,得到了α-Al2O3/PTFE、γ-Al2O3/PTFE和无定形Al2O3/PTFE的峰1的单位放热量分别为3.24、17.45和32.28J/g,峰2、3的单位总放热量(若曲线中无峰2,则总放热量在数值上等同于峰3放热量)分别为552.0、294.8和140.58J/g,无定形Al2O3/PTFE在峰1处具有最大的放热量,而α-Al2O3/PTFE在峰3处具有最大的总放热量。根据2.3.1节内容,峰1发生的是AlF3的生成反应,无定形Al2O3/PTFE在此处具有较高的放热量,表明有较多的无定形Al2O3在该温度下与PTFE发生放热反应,反应程度较高;而峰3发生的是AlF3的生成和晶型转变,无定形Al2O3/PTFE的峰3放热量低,表明在该阶段AlF3的生成量较少且晶型转变受到了一定的阻碍,使得参与晶型转变的AlF3含量较少。结合2.3.1节结果,由于α-Al2O3的粒径(50nm)大于γ-Al2O3(10nm),而与无定形Al2O3粒径(50nm)相同,但在峰3处单位总放热量大于后两者,同时峰1和峰2的峰值温度均较低,因此α-Al2O3更易与PTFE发生放热反应,并能集中放出更多热量。结合图3无定形Al2O3的微观形貌图,考虑可能是由于无定形Al2O3颗粒的团聚较严重,使得反应生成的AlF3也存在团聚情况,导致最终只有包裹在外部的少量AlF3发生了晶型转变。
在TG曲线中,α-Al2O3/PTFE的质量损失相对较少,说明α-Al2O3与PTFE的反应程度相对较高。
考虑到无定形Al2O3在升温过程中可能存在晶型转变,因此在相同条件下对无定形Al2O3进行了热分析,结果如图11所示。TG曲线中,升温过程的质量损失是由Al2O3表面吸附的水分蒸发导致的。DSC曲线显示,无定形Al2O3只在723.3℃存在一个弱放热峰,根据Al2O3的相变温度[23]分析,该放热峰是由γ-Al2O3转变成δ-Al2O3导致的,由于放热量很小,因此Al2O3的晶型转变并不会影响Al2O3与PTFE的反应放热量。
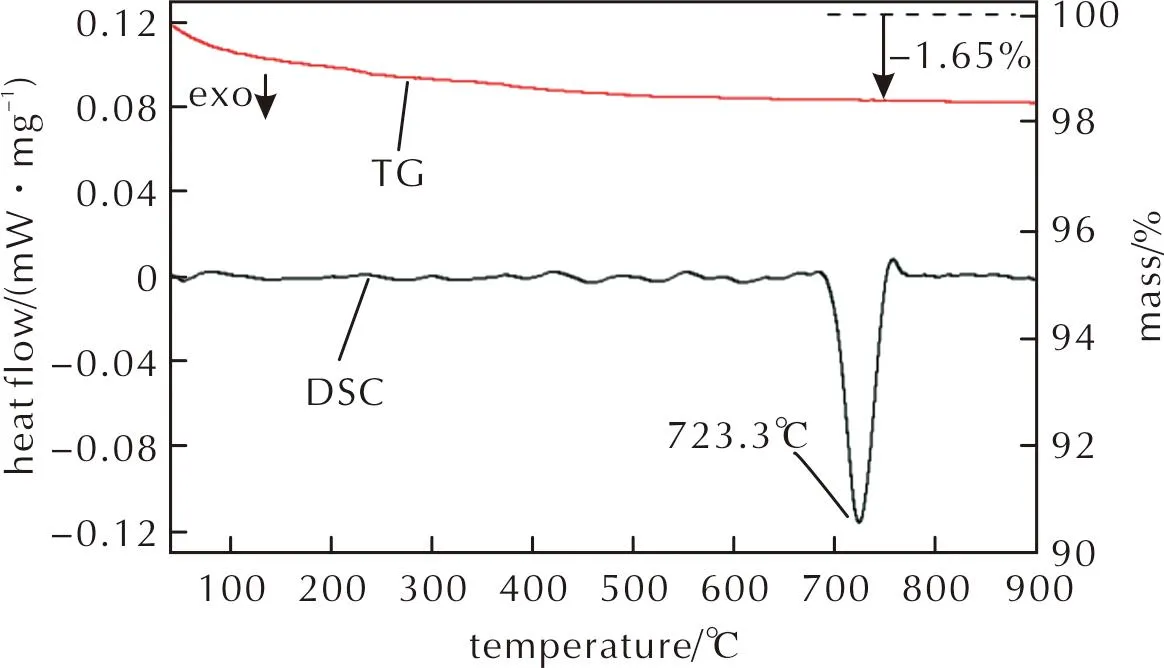
图11 无定形Al2O3的TG-DSC曲线Fig.11 TG-DSC curves of the amorphous Al2O3
综合上述结果,在3种晶型Al2O3中,与PTFE的反应程度从高到低依次为α-Al2O3、无定形Al2O3和γ-Al2O3,放热反应的总放热量从高到低依次为α-Al2O3、γ-Al2O3和无定形Al2O3。无定形Al2O3由于颗粒间的团聚使得最终参与晶型转变的AlF3相对较少,从而导致最终放热量较低。
2.5 升温速率对Al2O3/PTFE热化学反应特性的影响
2.5.1 升温速率的影响
图12给出了在不同升温速率下α-Al2O3(30nm)/PTFE(1μm)的热化学反应结果,并将升温速率为20K/min对应的DSC曲线合并在图中进行对比。
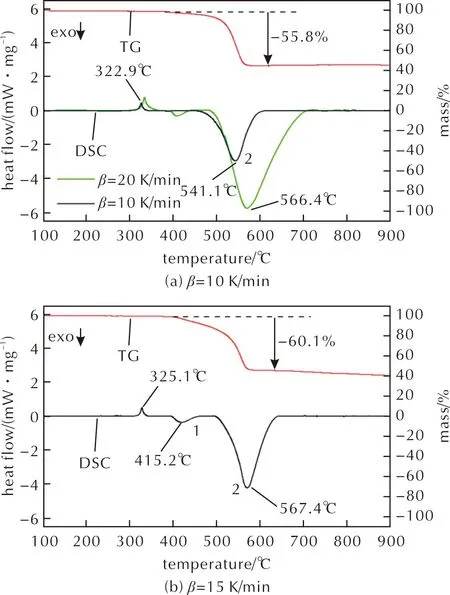
图12 不同升温速率下α-Al2O3(30nm)/PTFE(1μm)的热分析曲线Fig.12 Thermal analysis curves of α-Al2O3 (30nm)/PTFE (1μm) at different heating rates
在DSC曲线中,随着升温速率改变,PTFE的熔化吸热峰值温度没有明显变化。当升温速率为10K/min时,在541.1℃出现一个明显的放热峰,升温速率为15K/min时,该放热峰的峰值温度升高至567.4℃,并稳定在该温度附近。当升温速率为15K/min和20K/min时,在400~420℃区间出现了一个小的放热峰,且该放热峰的峰值温度随着升温速率升高而降低。随升温速率增大,峰2放热量逐渐增大。峰1是由AlF3的生成反应导致的,升温速率的增加导致该反应开始的温度降低;峰2是由AlF3的生成反应和AlF3的晶型转变共同引起的,升温速率的增大对该放热峰的起始温度影响较小,但放热量增大。
在TG曲线中,升温速率为10、15和20K/min的Al2O3/PTFE材料质量损失分别为-55.8%、-60.1%和-61.1%,3种体系质量损失量随升温速率的加快而增加,符合理论规律。其中升温速率为10K/min的Al2O3/PTFE材料质量损失最少,理论上反应程度最高。
通过对放热峰曲线进行积分,得到升温速率为10、15、20K/min条件下Al2O3/PTFE材料的主反应放热峰(峰2)的单位放热量分别为170.0、251.2和572.6J/g。
2.5.2 Al2O3/PTFE主反应活化能
固态热化学反应动力学一般遵循如下公式:
(1)
式中:α为转化率;T为热力学温度;A为指前因子;β为升温速率(dT/dt);f(α)为反应机理函数;Ea为反应活化能;R为通用气体常数,8.314J/(mol·K)-1。
反应活化能Ea通常可由Ozawa法[24]、Flynn法[25]和Starink法[26]计算得到。由于Starink法可以在不考虑f(α)的情况下计算活化能,比其他两种方法准确率更高,本研究采用Starink法计算反应的活化能。
Starink法的计算公式为:
(2)
根据Starink法计算得到Al2O3/PTFE复合体系主反应活化能Ea约为45.0kJ/mol。Hobosyan等[18]计算得到Al2O3/PTFE在升温速率大于150K/min条件下的反应活化能为21kJ/mol。本研究结果与文献存在较大差异的原因可能为:(1)Hobosyan等[18]实验中使用的Al2O3粒径为150μm,远大于本研究采用的粒径(30nm);(2)Al2O3/PTFE反应的放热峰主要由Al2O3与PTFE反应生成AlF3和AlF3的晶型转变两部分组成,而在快速加热条件下,晶型转变在动力学上十分缓慢,因此,Hobosyan等[18]在高升温速率下计算得到的更可能是AlF3生成反应的活化能,从而低于本研究结果。
3 结 论
(1)Al2O3会延迟PTFE熔化的起始温度,不同粒径和晶型的Al2O3对温度延迟的影响程度相近。
(2)Al2O3/PTFE的热化学反应主要包括AlF3的生成反应和AlF3的晶型转变。Al2O3和PTFE的粒径越小,二者越容易发生放热反应,使得AlF3生成反应和晶型转变的温度越接近,最终反应放热越集中,放热量越大。Al2O3与PTFE之间的粒径差减小,反应程度增大。综合两者影响,本研究中50nm的Al2O3和1μm的PTFE热化学反应性能最佳。
(3)在3种晶型的Al2O3中,与PTFE的反应程度从高到低依次为无定形Al2O3、α-Al2O3和γ-Al2O3,放热量从高到低依次为α-Al2O3、γ-Al2O3和无定形Al2O3。
(4)Al2O3/PTFE的热化学反应具有典型动力学特征,随升温速率增大,反应主放热峰的峰值温度不断升高,反应程度则随升温速率增大而降低。升温速率的提高会阻碍AlF3生成反应的进行,导致材料的反应程度降低,但同时一定程度上可以促进AlF3的晶型转变,使得最终的反应放热量增大。计算得到主反应活化能为45.0kJ/mol。

