蛹虫草菌株胞外发酵液抗氧化能力评价及优良菌株筛选
张疏雨,李剑梅,谢存一,柴林山,朱万芹
(辽宁省微生物科学研究院,辽宁朝阳 122000)
蛹虫草(Cordycepsmilitaris)又名北冬虫夏草,分类学上属于子囊菌亚门(Ascomycotina)、核菌纲(Pyreno⁃myce⁃tes)、球壳菌目(Sphaeriales)、麦角菌科(Clavicipti⁃aceae)、虫草属(Cordyceps)[1⁃2]。蛹虫草广泛分布于世界各地,在我国吉林、辽宁、河北、陕西、甘肃、安徽、山东、湖北、湖南、四川、贵州、福建、广东、广西、云南等地均有发现[3],其主要化学成分有蛋白质、氨基酸、糖类、有机酸、生物碱、甾醇及酚类、无机元素和超氧化物歧化酶(superoxide dismutase,SOD)等,不仅具有极高的营养价值,而且具有抗癌、抗氧化、镇定安眠、抗炎、治疗心脑血管疾病等功效,已被国家科技部批注为新资源食品,极具营养保健食品的开发潜力[4⁃8]。目前,关于蛹虫草子实体产量优化、活性成分含量优化、菌丝体收率提升等方面的研究已获得一些成果[9⁃10],特别是通过液体发酵法培养蛹虫草菌丝体及发酵液,不仅周期短、条件简单、产量高,而且有利于活性成分含量提升及目的组分的提取,已经成为了蛹虫草的研究热点[11⁃12]。
研究表明,蛹虫草无性型液体发酵代谢产物及其发酵制品的水和乙醇提取物具有较强的抗氧化活性,其抗氧化能力与其对机体内自由基的清除密切相关,是抗氧化食品、保健品、化妆品原料的良好来源[13⁃15],培养高抗氧化功能的蛹虫草产品,可为蛹虫草的开发利用提供新的商业市场。然而,蛹虫草无性型液体发酵代谢产物产量及其抗氧化活性的高低在很大程度上取决于蛹虫草菌种的生理生化活力,因而生产上迫切需要建立高抗氧化能力的蛹虫草优良菌种评价筛选方法。目前,食用菌菌种的评价方法主要有分子生物学评价、试验评价以及生理生化评价方法[16]。尽管蛹虫草可以实现人工栽培,但生长周期长,通过结实性实验来检测蛹虫草菌种质量费时费力;通过生理生化方法评价、鉴定蛹虫草菌种具有实用、经济、稳定等优点,是较为切实可行的方法之一。为筛选出抗氧化综合能力强、高活力、生物学转化率高的优良菌株,本试验以10 株蛹虫草菌株为研究对象,以菌株生长活力、发酵液胞外酶活力、抗氧化能力为指标,在相关性分析的基础上建立线性回归方程,确定定向筛选模型,创新确定有效评价蛹虫草菌株抗氧化综合能力的方法,并通过结实性试验中的蛹虫草生物学转化率、子实体形态、虫草素含量、生长周期等指标对模型进行可行性验证分析,以期为蛹虫草的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
供试蛹虫草菌株共10 株,种属均为蛹虫草(Cordycepsmilitaris)。供试菌株编号、品种及来源如表1所示。
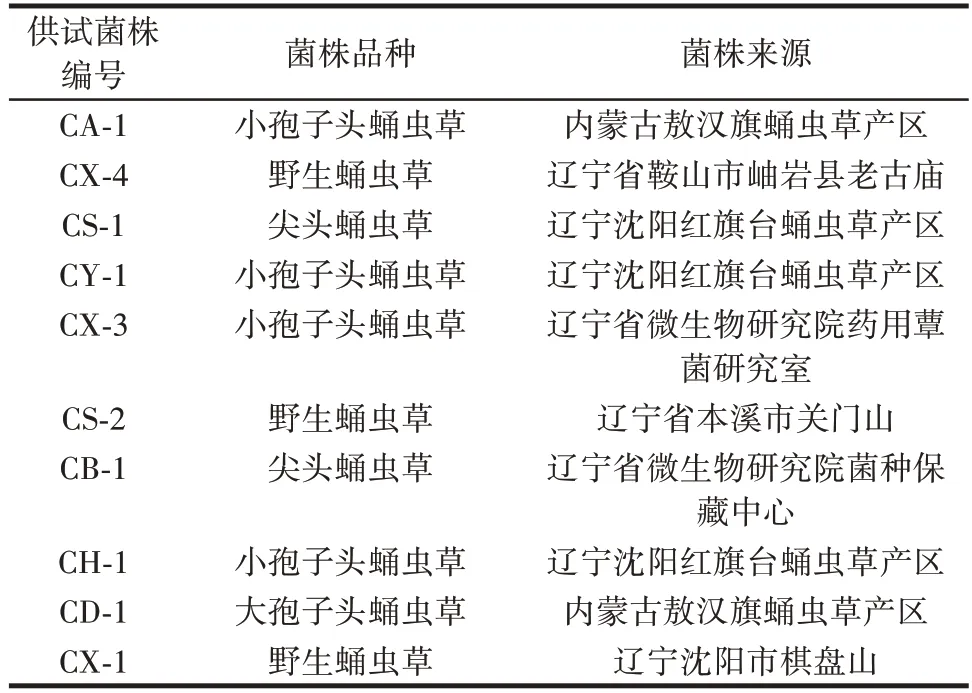
表1 蛹虫草供试菌株Table 1 Tested strains of Cordyceps militaris
1.1.2 培养基
PDA 平板培养基:马铃薯200 g,葡萄糖20 g,蛋白胨10 g,KH2PO43 g,MgSO41.5 g,维生素B110 mg,琼脂15 g,pH 值自然,水1 000 mL。121 ℃高温高压灭菌保持30 min。
液体摇瓶培养基:马铃薯200 g,葡萄糖20 g,蛋白胨10 g,KH2PO43 g,MgSO41.5 g,维生素B110 mg,pH 值自然,水1 000 mL。121 ℃高温高压灭菌保持30 min。
栽培培养基所需营养液:MgSO41.0 g,KH2PO42.0 g,维生素B15 mg,配制成1 000 mL 溶液,备用。
麦粒培养基:650 mL 罐头瓶,每瓶装小麦粒35 g,麦粒∶营养液=1∶1.7(g/mL)。用聚乙烯膜包裹瓶口,再用橡皮筋扎紧,于121 ℃下灭菌1 h,冷却,备用。
1.1.3 试剂
虫草素标准品、乙酸钠缓冲液(pH5.8,0.1 mol/L):上海源叶生物科技有限公司;乙醇、葡萄糖、蛋白胨、硫酸镁、络氨酸、磷酸二氢钾、可溶性淀粉(分析纯):北京奥博星生物技术有限责任公司;3,5 二硝基水杨酸(3,5⁃dinitrosalicylic acid,DNS)显色剂(分析纯):厦门海标科技有限公司;乙腈(色谱纯):天津星马克科技发展有限公司;总抗氧化能力(total antioxidant capacity,T⁃AOC)测定试剂盒、1,1⁃二苯基⁃2⁃三硝基苯肼(1,1⁃di⁃phenyl⁃2⁃picrylhydrazyl,DPPH)自由基清除能力测定试剂盒、羟自由基清除能力测定试剂盒、超氧阴离子自由基清除能力试剂盒、2,2′⁃联氮⁃双⁃3⁃乙基苯并噻唑啉⁃6⁃磺酸[2,2′⁃azino⁃bis(3⁃ethylbenzothiazoline⁃6⁃sulfonic acid),ABTS]、磷酸缓冲盐溶液(phosphate buffer sa⁃line,PBS):苏州格锐思生物科技有限公司。
1.2 仪器与设备
BHC⁃1300IIA/B2 生物安全柜:上海力申科学仪器有限公司;SPH⁃2102 立式双层大容量恒温培养摇床:上海世平实验设备有限公司;BCD⁃649WADV 冰箱:青岛海尔股份有限公司;SPX⁃4501 生化培养箱:中仪国科(北京)科技有限公司;LDZX⁃75KBS 立式压力蒸汽灭菌器:上海申安医疗器械厂;2695 高效液相色谱仪、2489 二极管阵列检测器:沃特世科技(上海)有限公司;USUXA42508 C18 色谱柱(5µm,4.6 mm×250 mm):安捷伦科技(上海)有限公司;KQ⁃50DA 型数控超声波清洗器:昆山市超声仪器有限公司;723N 可见分光光度计:上海仪电分析仪器有限公司;HH⁃2 数显恒温水浴锅:常州市江南实验仪器厂。
1.3 方法
1.3.1 菌丝生长速度的测定
制备PDA 平板培养基(培养皿直径90 mm),用打孔器取直径6 mm 的相同菌龄菌丝块,接种于PDA 培养基中部,置于(18±1)℃黑暗培养,十字交叉法划线,当菌落直径达到2 cm 时,在菌落边缘画线作为菌丝生长起始线,当生长最快的菌株即将长满PDA 平板时取出所有的培养皿,在菌落边沿画终止线,用游标卡尺测量起始线与终止线之间的距离(不同方向测3 次,取平均值,精确到0.02 mm),将此距离除以培养时间(d)即为菌丝平均生长速度。记录菌丝长势及转色后色泽,每个处理3 次重复。
1.3.2 发酵生物量的测定
液体摇瓶发酵:250 mL 锥形瓶中倒入100 mL 液体培养基,121 ℃高温高压灭菌30 min,冷却备用;用打孔器取直径6 mm 的平板培养基中相同菌龄菌丝块,接种量为每瓶接种3 块菌丝块,于18 ℃、140 r/min条件下振荡培养5~6 d,待长势最好的菌株发酵菌球丰富、黏稠后停止培养,用多层纱布过滤,滤液备用,用蒸馏水将沉淀清洗3 次后,收集菌丝体,置于烘箱烘干(55 ℃)至恒重,称重。每个处理3 个重复。
1.3.3 供试样品液前处理
将1.3.2 中供试菌株发酵液的备用滤液于4 ℃、8 000 ×g离心10 min,取上清液移入新的离心管,0.22 µm 微孔滤膜过滤,得到胞外样品液,用于胞外酶活力、抗氧化活性的测定。
1.3.4 β⁃葡萄糖苷酶活力测定
参照张曦文等[17]的测定方法,以葡萄糖的质量浓度为横坐标,以对应的吸光度为纵坐标绘制标准曲线,求得线性回归方程为Y=1.091 1X-0.034 8(R2=0.996 1)。于540 nm 处分别测定不同供试菌株胞外样品液的吸光度,按照标准曲线方程计算胞外样品液中葡萄糖的质量浓度,并计算酶活力。酶活单位规定为每秒钟生成1 mmol/mL 的葡萄糖为一个酶活单位(U)。
1.3.5 蛋白酶活力测定
参照肇莹等[18]的测定方法,以酪氨酸浓度为横坐标,以对应的吸光度为纵坐标绘制标准曲线,求得线性回归方程为Y=1.336 4X+0.007 3(R2=0.999 8)。于680 nm处分别测定不同供试菌株胞外样品液的吸光度,按照标准曲线方程计算胞外样品液中酪氨酸的质量浓度,并计算酶活力。酶活单位规定为1.0 mL 培养液中的酶量每秒钟作用于底物释放出酪氨酸的质量(µg)为1 个活力单位(U)。
1.3.6 淀粉酶活力测定
试管中加入1.5 mL 的0.5% 可溶性淀粉溶液(用pH5.8,0.1 mol/L 乙酸钠缓冲液配制)作为底物,加入0.5 mL 胞外样品液,混匀,38 ℃恒温水浴保温30 min,取出后立即加入DNS 试剂1.5 mL,沸水浴5 min,冷却后用蒸馏水定容至10 mL,混匀,于540 nm 处测吸光度。以煮沸10 min 的粗酶液作对照。以每毫升样品中的酶量与底物反应每分钟内改变0.01 个OD 值为一个活力单位(U)。淀粉酶标准曲线方程:Y=1.110 7X+0.075 2(R2=0.998 8)。
1.3.7 抗氧化能力测定
1.3.7.1 总抗氧化能力测定
参考试剂盒使用说明,利用总抗氧化能力(T⁃AOC)测定试剂盒(ABTS 法)对供试样品液进行总抗氧化能力的测定,按照公式(1)计算供试样品液总抗氧化能力(T,µmol Trolox/mL)。
式中:A测定为样品ABTS 的吸光度;A对照为样品与PBS 混合液吸光度;A空白为ABTS 工作液与PBS 混合液的吸光度;D表示样品的稀释倍数。
1.3.7.2 DPPH 自由基清除率测定
参考试剂盒使用说明,利用DPPH 自由基清除能力测定试剂盒对供试样品液进行DPPH 自由基清除率的测定。按照公式(3)计算供试样品液的DPPH 自由基清除率(D,%)。
式中:A测定为样品与DPPH 混合液吸光度;A对照为样品与无水乙醇混合液吸光度;A空白为DPPH 与无水乙醇混合液吸光度。
1.3.7.3 超氧阴离子自由基清除率测定
参考试剂盒使用说明,利用超氧阴离子自由基清除能力试剂盒进行超氧阴离子自由基清除率的测定,按照公式(4)计算供试样品的超氧阴离子自由基清除率(S,%)。
式中:A测定为测定管的吸光度;A对照为对照管的吸光度;A空白为空白管的吸光度。
1.3.7.4 羟自由基清除率测定
参考试剂盒使用说明,利用羟自由基清除能力测定试剂盒进行羟自由基清除率的测定,按照公式(5)计算供试样品的羟自由基清除率(H,%)。
式中:A测定为测定管的吸光度;A对照为对照管的吸光度;A空白为空白管的吸光度。
1.3.8 模型的验证
对10 株蛹虫草供试菌株进行小麦基质人工培养[19],并对菌株主要农艺性状进行评价。将蛹虫草液体菌种按照8 mL/瓶接种于麦粒培养基中,栽培条件:菌丝生长阶段18 ℃避光培养8~10 d,待菌丝长满基质后进行原基诱导培养,培养条件为300 lx 光照24 h、温度20 ℃、空气相对湿度不低于60%、二氧化碳浓度0.5%,当培养至20 d 左右,菌丝由白色变成均匀的橘黄色,且形成针尖状原基时,用灭菌后的接种针在封口膜上扎眼通气(一般扎2 排孔,每排扎3 个直径约2 mm的小孔即可),进入子实体培养阶段,当培养60 d 左右时,采收子实体,记录子实体性状,计算生物学转化率、菌种生长周期,测定虫草素含量。
1.3.9 虫草素含量测定
参考NY/T 2116—2012《虫草制品中虫草素和腺苷的测定高效液相色谱法》[20]测定蛹虫草子实体提取液中虫草素含量。色谱条件:柱温35 ℃;流动相,5%乙腈,95%水;流速1.0 mL/min;检测时长18 min;紫外检测波长260 nm;进样量10µL。
标准曲线制作:称取虫草素标准品10 mg,去离子水溶解,用流动相定容至100 mL 摇匀,配成浓度为100µg/mL 虫草素准品储备液,4 ℃储存备用。准确吸取虫草素标准储备液0.25、0.50、1.25、2.50、5.00、12.50 mL于25 mL 容量瓶中,用去离子水定容,摇匀,浓度为1.00、2.00、5.00、10.00、20.00、50.00 µg/mL,0.22 µm 微孔滤膜过滤。每个浓度的标准品溶液重复进样3 次,得到相应峰面积,计算平均值。以虫草素的浓度为横坐标,相应的峰面积为纵坐标,得到虫草素标准曲线y=34 479x+10 846(R2=0.998 3)。
样品中虫草素含量测定:将供试蛹虫草子实体于55 ℃干燥至恒重,粉碎,过80 目筛,分析天平准确称取(0.50±0.01)g 于刻度管中,按照液料比20︰1(mL/g)加入70% 乙醇,在60 ℃条件下超声提取3 h,70% 乙醇定容至25 mL,混匀,经0.22 µm 微孔滤膜过滤,得到蛹虫草子实体提取液,按照上述高效液相色谱法分析,重复进样3 次,得到相应峰面积,计算平均值,并带入到标准曲线中计算虫草素含量。
1.4 数据分析处理
所有结果用平均值±标准差表示。采用Excel 软件进行数据统计和分析。采用SPSS 19.0 软件对数据进行相关性分析,以P<0.05 表示差异显著,以P<0.01表示差异极显著。
2 结果与分析
2.1 菌株生长活力
2.1.1 菌株生长特性及发酵生物量
供试蛹虫草菌株菌丝生长速度和发酵生物量结果见图1,菌株的菌落形态见图2。

图1 蛹虫草菌株的菌丝生长速度和发酵生物量Fig.1 Mycelial growth rate and fermentation biomass of Cordyceps militaris strain

图2 蛹虫草菌株的菌落形态Fig.2 Colony morphology of Cordyceps militaris strain
由图1 可知,10 株蛹虫草供试菌株菌丝生长速度相差较大,其中CH⁃1、CA⁃1 明显快于其他菌株,菌丝生长速度为其他菌株的2 倍多,其次为CX⁃4、CY⁃1、CB⁃1、CX⁃3、CS⁃1,而CS⁃2、CX⁃1、CD⁃1 长速最慢;从发酵生物量看,CH⁃1、CA⁃1 要高于其他8 株菌株,其次为CX⁃4、CB⁃1、CS⁃2、CX⁃3、CX⁃1、CY⁃1、CD⁃1,CS⁃1 发酵生物量最低。由图2 可知,在菌落状态方面,转色前,10 株供试菌株菌丝致密,呈绒毛状,菌落颜色为白色,转色后,除菌株CS⁃2、CX⁃1、CD⁃1 菌落形态为稀疏浅黄色外,其他7 株菌株菌落颜色为黄色至橘黄色,其中CX⁃4、CY⁃1、CB⁃1、CS⁃1、CX⁃3 菌落为黄色,CH⁃1、CA⁃1菌落为橘黄色,菌丝致密绒毛状,长势较好。综合以上分析初步得到菌株CH⁃1、CA⁃1 在菌丝生长速度、菌落状态、发酵生物量方面明显优于其他菌株。
2.1.2 菌株胞外酶活力
食用菌在生长发育过程中产生胞外酶,食用菌胞外酶可以将天然谷物、木料等培养料中的糖类、蛋白质等大分子转化成利于吸收的小分子物质,为其菌丝生长、原基分化、子实体生长发育提供营养物质[21]。10 株供试菌株胞外酶活力见图3。
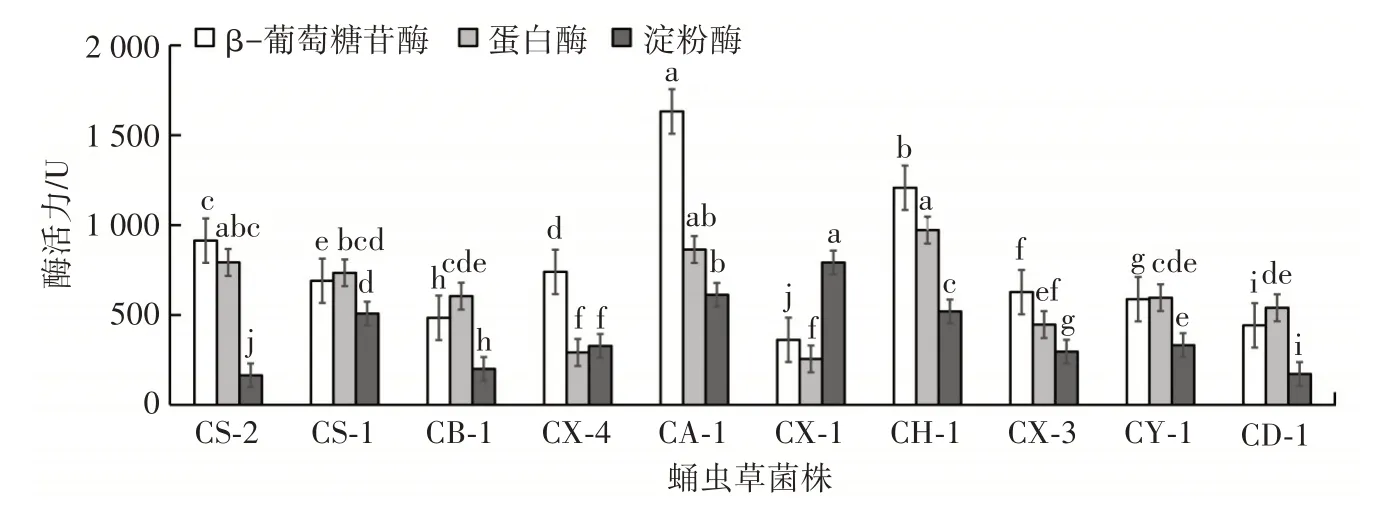
图3 供试菌株胞外酶活力Fig.3 Extracellular enzyme activity of tested strains
由图3 可知,供试10 株菌株发酵液胞外酶活力差异较大,CA⁃1 的β⁃葡萄糖苷酶酶活力明显高于其他菌株,CH⁃1、CS⁃2、CX⁃4、CS⁃1、CX⁃3、CY⁃1、CB⁃1 次之,CD⁃1、CX⁃1 最低;CH⁃1 蛋白酶活力最高,CA⁃1、CS⁃2、CS⁃1、CB⁃1、CY⁃1、CD⁃1、CX⁃3 次之,CX⁃4、CX⁃1 活性最低;CX⁃1 淀粉酶活性最强,CA⁃1、CH⁃1、CS⁃1、CY⁃1、CX⁃4、CX⁃3、CB⁃1、CD⁃1、CS⁃2 活性依次降低。
2.2 菌株抗氧化能力
10 株供试蛹虫草菌株胞外样品液羟自由基清除率、超氧阴离子自由基清除率、DPPH 自由基清除率和总抗氧化能力结果见图4。

图4 供试菌株抗氧化能力Fig.4 Antioxidant activity of tested strains
由图4 可知,CH⁃1 的羟自由基清除率超过了60%,明显高于其他菌株;CA⁃1 的超氧阴离子自由基清除率最高,其次是CH⁃1、CD⁃1、CS⁃1;CX⁃4、CS⁃2 的DPPH 自由基清除率较高,CB⁃1、CH⁃1 次之;总抗氧化能力方面,CH⁃1、CA⁃1、CY⁃1 表现出了一定的优势。
2.3 抗氧化综合能力与生长活力指标的相关性分析及模型建立
隶属函数是用于表征模糊集合的数学工具,为了能够更简单直观的表达供试蛹虫草菌株的抗氧化综合能力,对羟自由基清除率、超氧阴离子自由基清除率、DPPH 自由基清除率和总抗氧化能力采用隶属函数值法进行赋值计算,得到平均隶属函数值,结果见表2。隶属函数值的范围为0~1,数值越大说明该菌株的抗氧化综合能力越高。这里定义平均隶属函数值代表蛹虫草菌株抗氧化综合能力。

表2 供试菌株隶属函数值计算表Table 2 Calculation of membership function value of tested strains
使用SPSS 软件对10 株蛹虫草菌株的菌丝生长速度、摇瓶发酵生物量、胞外酶活力和抗氧化综合能力进行相关性分析,结果见表3。
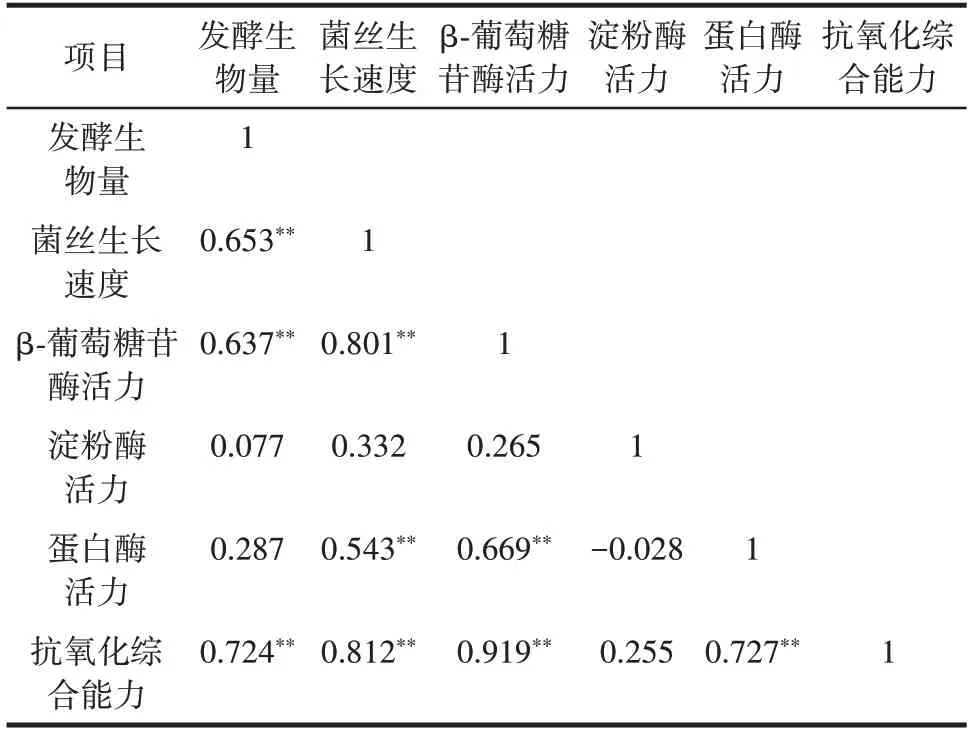
表3 蛹虫草10 菌株指标相关性分析Table 3 Correlation analysis of indicators of Cordyceps militaris strain 10
由表3 可知,抗氧化综合能力与发酵生物量、菌丝生长速度、β⁃葡萄糖苷酶活力、蛋白酶活力呈极显著正相关(P<0.01),发酵生物量与菌丝生长速度、β⁃葡萄糖苷酶活力呈极显著正相关(P<0.01),菌丝生长速度与β⁃葡萄糖苷酶活力、蛋白酶活力呈极显著正相关(P<0.01),β⁃葡萄糖苷酶活力与蛋白酶活力呈极显著正相关(P<0.01),淀粉酶活力与各活性指标有一定相关性。
为了进一步阐明10 个蛹虫草菌株抗氧化综合能力与发酵生物量、菌丝生长速度、β⁃葡萄糖苷酶活力、蛋白酶活力之间的内在联系,采用多元线性回归方法分析各解释变量的影响程度,决定具有代表性的指标对抗氧化综合能力的解释水平。以抗氧化综合能力作为因变量,以发酵生物量、菌丝生长速度、β⁃葡萄糖苷酶活力、蛋白酶活力为自变量,建立多元线性数学模型,模型公式如公式(6)所示。
式中:BY为蛹虫草菌株抗氧化综合能力;BFER为发酵生物量,g/100 mL;BCMD为菌丝平均生长速度,cm/d;BGLU为β⁃葡萄糖苷酶活力,U;BPRO为蛋白酶活力,U;A0为常数;A1、A2、A3、A4为变量系数。
运用SPSS 19.0 软件进行多元线性回归分析,结果见表4。

表4 多元线性回归分析Table 4 Multiple linear regression analysis
由表4 显著性分析可知,菌丝平均生长速度、发酵生物量、蛋白酶活力、β⁃葡萄糖苷酶活力对蛹虫草菌株抗氧化综合能力的贡献程度依次递减,这些变量具有一定的统计学意义。根据回归模型,可以得到蛹虫草菌株抗氧化综合能力与发酵生物量、菌丝平均生长速度、β⁃葡萄糖苷酶活力、蛋白酶活力的数学模型,线性方程如公式(7)所示。
所有的指标中对蛹虫草菌株抗氧化综合能力贡献最大的是菌丝平均生长速度,其次分别是发酵生物量、蛋白酶活力、β⁃葡萄糖苷酶活力。因此,可以根据此模型来快速筛选出具有高抗氧化综合能力的蛹虫草菌株:即通过比较菌丝的平均生长速度及生长状况,初步筛选出菌丝生长快、致密、颜色鲜黄的菌株,然后通过比较菌株的摇瓶生物量,筛选出发酵生物量较高的菌株,最后测定菌株的蛋白酶活力、β⁃葡萄糖苷酶酶活力,从而筛选出具有高抗氧化综合能力的蛹虫草菌株。
2.4 模型的验证
对10 株蛹虫草供试菌株进行小麦基质人工培养,并对菌株主要农艺性状进行评价,验证栽培优势菌株与模型选择的优势菌株是否一致。10 株蛹虫草菌株子实体生物学性状和外观见表5 和图5。

图5 10 株蛹虫草菌株子实体生长图Fig.5 Growth of fruiting bodies of 10 Cordyceps militaris strains

表5 菌株子实体生物学性状Table 5 Biological characteristics of fruiting bodies of strains
由表5、图5 可知,菌株CH⁃1 与CA⁃1 子实体形成能力强、农艺性状优良,子实体生物转化率达到90%以上,CS⁃1、CS⁃2、CX⁃3、CX⁃4 子实体生物学转化率达到50% 以上,CB⁃1、CD⁃1、CX⁃1、CY⁃1 菌株较差,子实体生物转化率在50%以下;蛹虫草CH⁃1、CA⁃1 菌株虫草素含量较野生菌株(CX⁃4、CS⁃2、CX⁃1)高60%左右,菌株生长周期短10 d 左右,综合子实体性状、生物转化率等指标,蛹虫草CH⁃1、CA⁃1 菌株为优势菌株,与模型选择的菌株一致,表明抗氧化综合能力高的菌株子实体农艺性状也较好,说明模型具有一定可行性。
3 讨论与结论
随着社会经济发展水平的提高,国内外市场对蛹虫草的需求量急剧增加。研究表明,蛹虫草发酵菌丝体也具有良好的生物活性,所以采用液体发酵技术大规模生产蛹虫草菌丝体是满足国内外市场需求的有效途径,而发酵获得的蛹虫草菌丝体的产量及其抗氧化能力的高低在很大程度上决定了蛹虫草菌种的优劣[21]。菌种优劣的评价通常采取出菇试验来进行,但由于受多种因素影响,导致出菇试验评价结果不稳定,并且实验成本较高,周期比较长。目前,已有一些可以方便快捷评价菌种质量的相关报道:宋好倩[22]研究发现淀粉酶与蛹虫草子实体的生长呈正相关,纤维素酶和淀粉酶活性在转色期达到峰值;杨欢东[23]研究发现异硫氰酸烯丙酯(allyl⁃isothiocyanate,AITC)处理能够有效保持SOD 酶活较高活性,提高铁离子抗氧化能力(Ferric ion reducing antioxidant power,FRAP)值、DPPH自由基清除能力和ABTS 阳离子自由基清除能力;刘淑琴等[24]研究发现蛹虫草子实体的产量与液体菌种的氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)酶活力呈正相关。
虽然相关研究对于蛹虫草菌种质量评价具有重要意义,但从总体上来讲,研究方法相对单一,难以综合反映蛹虫草菌株的生长活性和抗氧化活性的问题。本研究通过测定蛹虫草菌株的菌丝生长活力、相关酶活及清除自由基等指标,对10 株供试菌株进行较为全面的评价,得到相关性分析结果:抗氧化综合能力与发酵生物量、菌丝生长速度、β⁃葡萄糖苷酶活力、蛋白酶活力呈极显著正相关(P<0.01);发酵生物量与菌丝生长速度、β⁃葡萄糖苷酶活力呈极显著正相关(P<0.01);菌丝生长速度与β⁃葡萄糖苷酶活力、蛋白酶活力呈极显著正相关(P<0.01);β⁃葡萄糖苷酶活力与蛋白酶活力呈极显著正相关(P<0.01);这些生理生化指标可以作为蛹虫草优良菌株筛选的重要指标。采用相关数据分析软件建立得到了蛹虫草菌株抗氧化综合能力与发酵生物量、菌丝平均生长速度、β⁃葡萄糖苷酶活力、蛋白酶活力的数学模型,可以根据此模型来快速筛选出具有高抗氧化综合能力的蛹虫草菌株,克服了以往蛹虫草菌株活力评价相关报道的单一性,通过结实性实验对结果进一步验证,表明抗氧化综合能力高的菌株具有很好的子实体农艺性状和生物转化率,说明模型具有一定可行性,也为蛹虫草优良菌种选育提供了一定的参考。

