宫颈鳞状细胞癌中hsa_circ_0007905的表达意义及对生长的影响*
钱婷婷 王 绪 严雪冰 王成海
1 扬州大学医学院病理学教研室,江苏省扬州市 225009; 2 江苏省太仓市中医医院病理科
宫颈癌是妇科常见恶性肿瘤,严重威胁女性的健康。引起宫颈癌预后不良的因素较多,主要因素是肿瘤的广泛转移和复发[1]。而宫颈鳞状细胞癌(Cervical squamous cell carcinoma,CSCC)是宫颈癌中最常见的病理类型。因此,有必要探究CSCC恶化进展的潜在机制,寻找治疗CSCC的新靶点。
环状RNA(circualar-RNA,circRNA)是一种闭环型非编码RNA分子,对microRNA(miRNA、miR)具有调节作用[2]。因其闭环结构和稳定表达的特点而有明显的优势,可作为开发CSCC的新临床诊断标志物。miRNA是一类由内源性单链非编码RNA,长度约为22个核苷酸[3]。CircRNA主要通过竞争性内源性RNA(ceRNA)机制发挥作用,即作为miRNA的“分子海绵”,与miRNA竞争性结合,从而减少游离miRNA对下游靶基因转录的干扰,达到调节基因表达的目的[4]。研究表明许多癌症中circRNA的异常表达,与癌症的发生和发展有关[5-7]。Huang等[8]通过人类circRNA表达谱测序分析了CSCC和配对癌旁宫颈组织的circRNA表达情况,结果发现并验证了hsa_cir_0000745、hsa_ccirc_0084927、hsa_2circ_0002762、hsa_circ_0075341、hsa_circ_0007905 在CSCC中表达水平升高,但文中并没有对hsa_circ_0007905的作用进行相关研究。因此本文通过进一步研究hsa_circ_0007905在CSCC组织中的表达情况、临床意义及对生长的影响,为CSCC的临床诊断和治疗提供潜在的依据。
1 材料和方法
1.1 资料和样本 选取2020年1月—2022年12月在扬州大学附属医院和太仓市中医医院接受宫颈癌手术切除的71例患者为研究对象,年龄38~65岁,中位年龄54岁。纳入标准:(1)临床资料、病理资料无缺失者;(2)经病理确诊为宫颈鳞状细胞癌患者;(3)术前未接受放疗、化疗、免疫治疗等抗肿瘤治疗者;(4)对本研究知情同意者。排除标准:(1)合并其他部位恶性肿瘤者;(2)合并有脑转移者;(3)心、肝、肾功能不全者;(4)自身免疫性疾病、感染性疾病患者。收集71例配对的CSCC组织和邻近正常组织及相关病理资料。本实验经扬州大学医学院伦理委员会批准,且患者签署知情同意书。
1.2 质粒和细胞 hsa_circ_0007905 mimic(模拟物)和si-circ_0007905(抑制物)质粒合成于湖南丰晖生物科技有限公司。宫颈癌的两个细胞株HeLa细胞、C33A细胞和人正常子宫颈上皮细胞HcerEpic均购买于中国科学院上海细胞生物库。上述所有细胞均在含10%胎牛血清的DMEM培养基(HyClone 公司)里孵育,培养基中添加1%的青霉素—链霉素(Invitrogen公司)。通过Lipofectamine 2000细胞转染试剂盒将hsa_circ_0007905 mimic和si-circ_0007905质粒转染至宫颈癌细胞株,并将细胞置于37℃、5%CO2的潮湿培养箱中培养。
1.3 实时荧光定量PCR实验 首先通过 Trizol法提取CSCC组织总RNA,检测RNA浓度;然后进行cDNA的反转录合成,反应体系:总RNA 1μg+mRQ Buffer(2×) 5μl+mRQ Enzyme 1.25μl+无酶水补至10μl,PCR仪扩增获得cDNA产物。qRT-PCR实验通过Premix Ex TaqTMⅡ试剂盒进行操作,反应体系:SYBR预混料Ex Taq Ⅱ 10μl+ROX Reference Dye Ⅱ(50×)0.4μl+上游引物(10mmol/L) 0.4μl+下游引物(10mmol/L) 0.4μl+ CDNA模板1.6μl+DEPC水7.2μl,合计20μl。在Applied Biosystems 7500 R-T PCR system进行qRT-PCR实验:(1)预变性:94℃ 5min。(2)PCR反应:重复:94℃ 30s至55℃ 30s至70℃ 30s,共40个循环,94℃ 1min 至 55℃ 30s至95℃ 30s。引物序列如下所示:hsa_circ_0007905上游:5’-GGTGCTGAAGAACATGTCCC-3’,hsa_circ_0007905下游:GCTAATGCCTGCACAGATGA;GAPDH上游:5’-ACCTGGACCTGGACCTGGACT-3’, GAPDH下游:5’-ACCTGGACCTGGACCTGGGAT-3’。
1.4 CCK-8细胞增殖活性实验 将宫颈癌细胞悬浮于96孔板的孔洞里,每个孔洞加入5×103个细胞,实验设置3个复孔。将宫颈癌细胞置入5%CO2、37℃的培养箱里中培养,直至细胞铺满整个孔底。每个孔中加入CCK-8溶液10μl并与细胞混匀,然后放置细胞培养箱中孵育4h。使用酶标仪于450nm处检测光密度(OD)值,分析过表达或敲低hsa_circ_0007905表达对宫颈细胞增殖活性的影响。
1.5 裸鼠皮下移植瘤模型 实验组(30只)和对照组(30只)的BALB/C-nu/nu裸鼠来源于扬州大学动物实验中心。裸鼠为8周龄,重量23~27g,饲养在SPF级动物培养箱里。在第4天后于裸鼠右侧腋腹壁的皮下接种宫颈癌细胞5×106个细胞左右。接种后每天监测裸鼠生活状态及其皮下瘤组织的生长情况。50d后迅速拉颈处死裸鼠,完整剥离瘤体,对肿瘤体积大小和重量进行测量,并给予拍照。移植瘤做相关实验。动物实验已获得扬州大学动物实验伦理委员会批准。
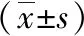
2 结果
2.1 宫颈癌中hsa_circ_0007905的表达 在71对CSCC和癌旁正常组织以及宫颈癌细胞(HeLa、C33A)和人正常子宫颈上皮细胞HcerEpic 通过qRT-PCR检测了hsa_circ_0007905的表达情况,结果如图1所示,hsa_circ_0007905在71例CSCC组织的表达水平(3.437±0.173)较癌旁正常组织(1.502±0.065)明显更高(t=10.48,P=0.000 1<0.05);hsa_circ_0007905在宫颈癌细胞HeLa(4.533±0.546)、C33A(6.333±0.291)的表达水平较人正常子宫颈上皮细胞HcerEpic(1.600±0.173)明显更高(t=5.124、13.99,P<0.05)。
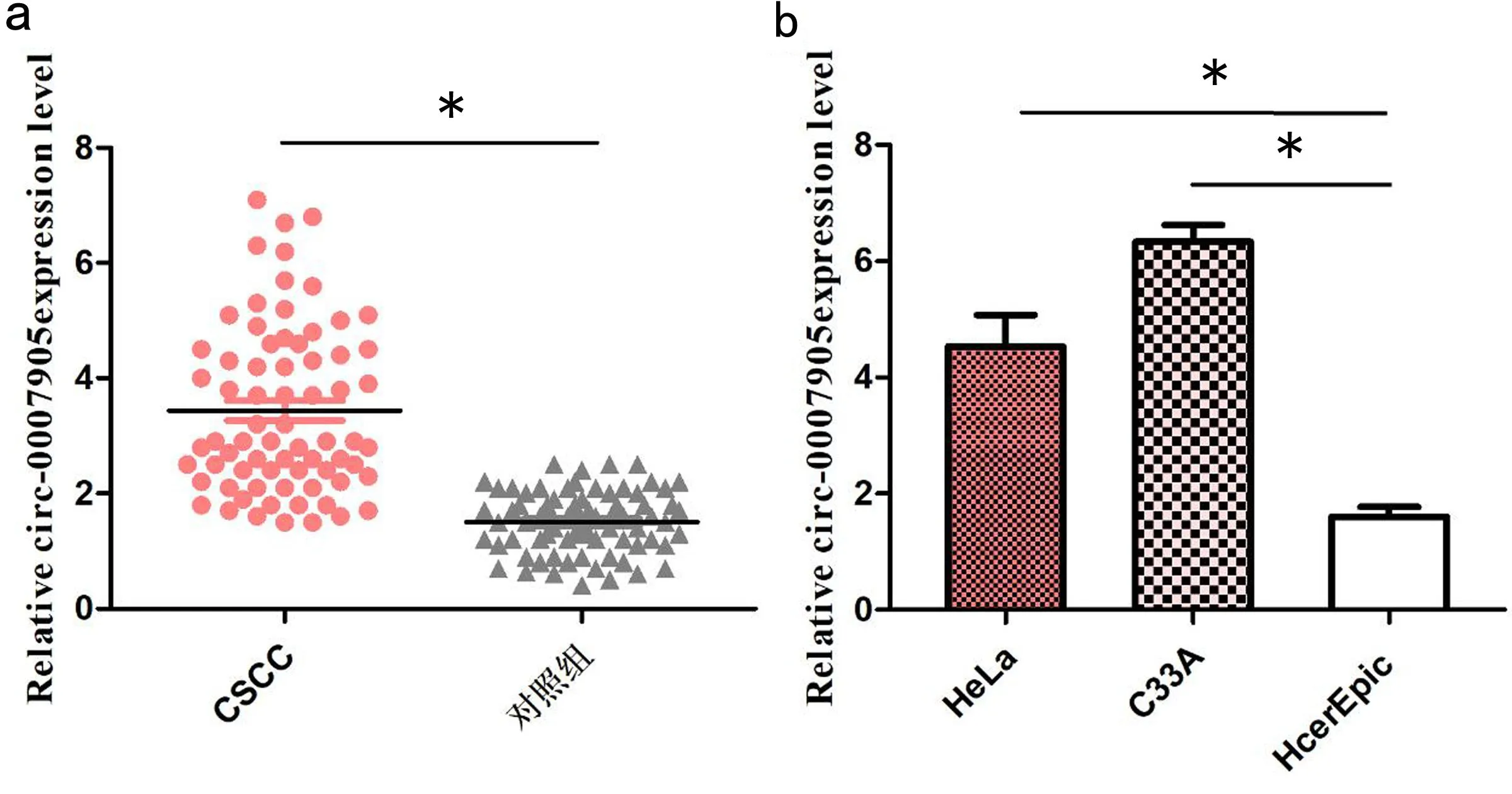
图1 qRT-PCR检测宫颈癌中hsa_circ_0007905的表达水平
2.2 CSCC中hsa_circ_0007905的表达及其临床病理意义 首先将病例按hsa_circ_0007905表达水平高低分为两组:高表达组(表达水平高于对照组)和低表达组(表达水平≤对照组)。实验结果如表1所示,高表达组例数为56例,低表达组例数为15例。通过统计得出hsa_circ_0007905的表达与CSCC的肿瘤大小和分化程度密切相关 (P均<0.05),即表达水平越高,肿瘤越大而且分化程度越低,恶性程度越高;而与患者年龄、HPV感染、淋巴结转移和TNM分期之间无相关性(P均>0.05)。这一结果提示高表达的hsa_circ_0007905参与了CSCC细胞的生长和分化过程。
表1 CSCC组织中hsa_circ_0007905的表达及其意义
2.3 hsa_circ_0007905增强宫颈癌细胞的增殖活性 上述实验提示hsa_circ_0007905与CSCC的肿瘤大小密切相关,因此我们进一步通过CCK-8实验研究hsa_circ_0007905对宫颈癌细胞C33A增殖活性的影响。实验结果如表2、图2所示,过表达hsa_circ_0007905促进了宫颈癌C33A细胞的增殖活性,而降低hsa_circ_0007905表达则抑制了C33A细胞的增殖活性,两组间差异均有统计学意义(P均<0.05)。
表2 hsa_circ_0007905对C33A增殖活性的影响
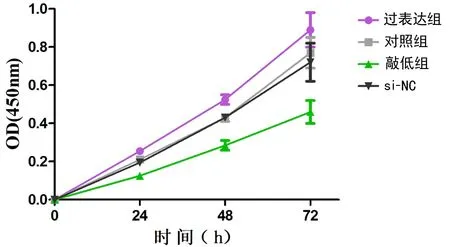
图2 CCK8实验检测 hsa_circ_0007905对C33A增殖活性的影响
2.4 hsa_circ_0007905对裸鼠皮下移植瘤生长的影响 为了进一步研究hsa_circ_0007905在宫颈癌生长增殖中的作用,笔者建立了裸鼠皮下移植瘤模型。因hsa_circ_0007905在CSCC组织中呈现高表达水平,故本次实验检测降低hsa_circ_0007905表达对荷瘤的影响。通过裸鼠皮下注射降低hsa_circ_0007905表达的C33A细胞,实验结果如图3所示,敲低组的肿瘤体积和重量明显小于对照组,两组差异有统计学意义(P均<0.05)。该结果进一步表明hsa_circ_0007905可明显促进宫颈癌的增殖和生长。
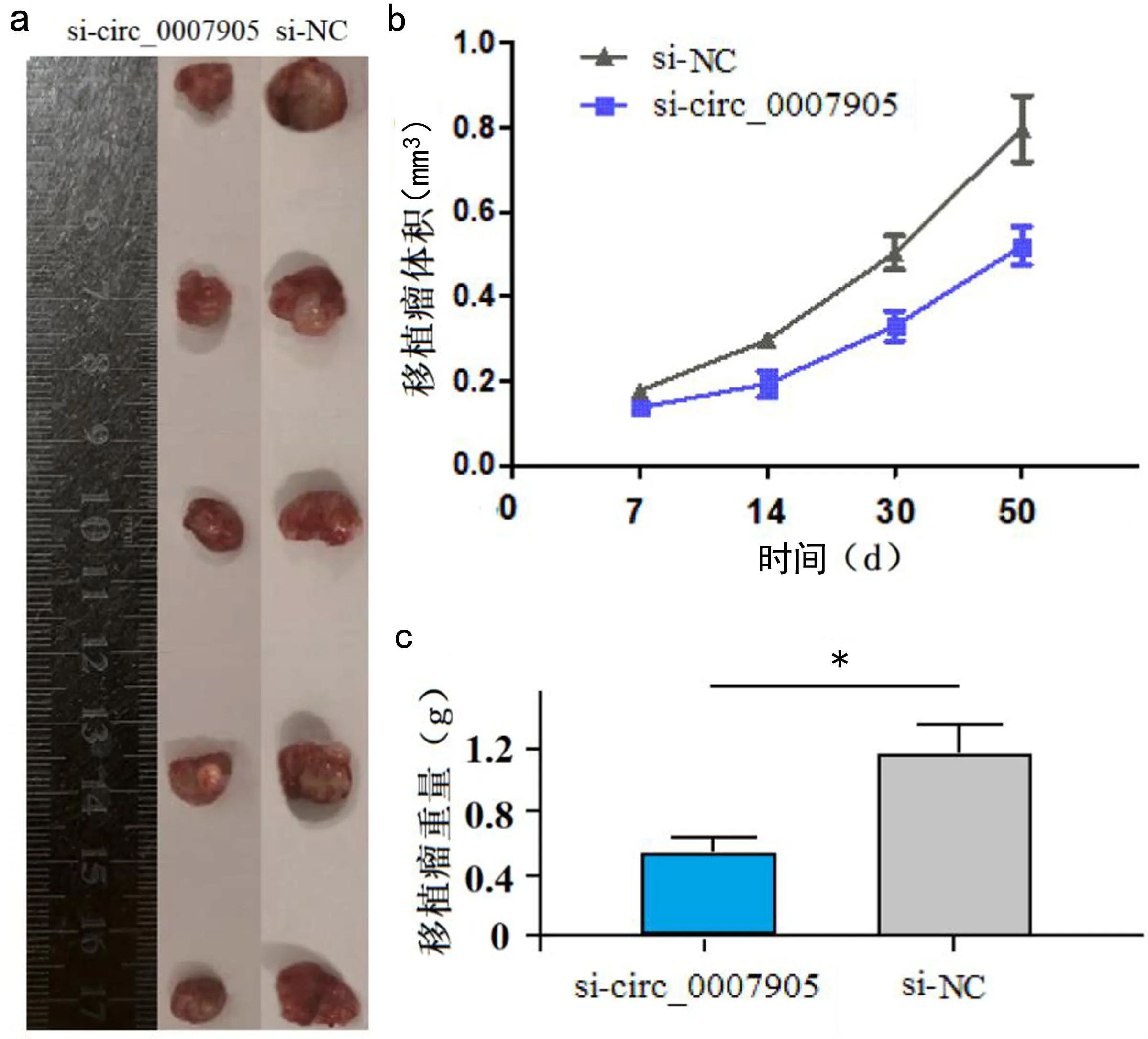
图3 降低hsa_circ_0007905表达对皮下移植瘤生长的影响
3 讨论
子宫颈癌是来源于宫颈鳞柱交界处的鳞状细胞及柱状细胞的恶性肿瘤。宫颈癌好发于中老年女性患者,近年来宫颈癌发病有年轻化的趋势。在中国,宫颈癌的死亡率占女性恶性肿瘤的第二位,也占全部癌症死亡率的第四位[9-10]。近年来,随着早癌筛查中宫颈细胞学检测的开展,宫颈的早期病变能被早发现、早诊断和早治疗,但CSCC患者预后仍然不佳,主要原因是CSCC具体发生发展的分子机制还未被彻底阐明,因此寻找CSCC的诊治靶点以及研究其发生发展机理变得尤为重要。
circRNA是一种单链共价封闭的非编码RNA,由前体信使核糖核酸通过非经典剪接产生,并在生物物种中广泛表达[11]。circRNAs可能作为转录调节剂、miRNA海绵或蛋白诱饵在癌症进展中发挥作用[12-13]。近年来诸多的证据表明circRNAs参与了宫颈癌的发生发展过程,既有促进宫颈癌的circRNAs,又有抑制宫颈癌的circRNAs;例如,circCCDC134在细胞核中募集p65,并作为miR-503-5p海绵调节细胞质中MYB的表达,最终刺激HIF1A转录,促进宫颈癌细胞的生长和转移[14]。circRNA_101996在宫颈癌中过度表达,上调的circRNA_101996显著促进宫颈癌的细胞增殖、细胞周期进展和细胞迁移,机制上circRNA_101996通过与miR-1236-3p结合并降低其表达,从而通过miR-1236-3p/TRIM37轴加速了宫颈癌症的发展,为宫颈癌的诊断和治疗提供了新的见解[15]。circRNA_0000285在宫颈癌组织中的表达水平显著高于邻近正常组织。此外,敲除circRNA_0000285后宫颈癌细胞的生长和迁移能力受到显著抑制。FUS的表达水平与circRNA_0000285在宫颈癌组织中的表达呈正相关circRNA_0000285通过促进FUS的表达而发挥促癌作用[16]。circLMO1水平在宫颈癌症组织中下调,并与FIGO分期相关。在功能上circLMO3的缺失则促进了子宫颈癌症细胞的增殖和侵袭。从机制上,circLMO1通过吸收miR-4192来抑制靶基因ACSL4,从而作为竞争性内源性RNA(ceRNA)发挥作用,有望成为宫颈癌症临床治疗的生物标志物[17]。circRNA_101308在宫颈癌组织中显著下调并作为肿瘤抑制因子[18],过表达circRNA_101308能抑制宫颈癌细胞增殖、侵袭和迁移。在宫颈癌细胞中发现MiR-26a-5p、MiR-196a-5p,MiR-196b-5p、MiR-335-3p和MiR-1307-3p被circRNA_101308吸收,此研究为宫颈癌的临床治疗提供了新的方向。circ_VPRBP在宫颈癌症组织和细胞中表达下调,且过度表达circ_VRRBP抑制Caski和C33A细胞的增殖并促进其凋亡。circ_VPRBP通过调控miR-93-5p/FRMD6轴抑制宫颈癌细胞的增殖、迁移和侵袭,促进细胞凋亡[19]。
Huang等[8]通过人类circRNA表达谱测序分析了CSCC和配对癌旁宫颈组织的circRNA表达情况,结果发现hsa_cir_0000745、hsa_ccirc_0084927、hsa_2circ_0002762、hsa_circ_0075341、hsa_circ_0007905 在CSCC中表达水平升高,但本研究并未对hsa_circ_0007905的作用进行相关研究。本研究通过在82例CSCC中进行了qRT-PCR实验证实了hsa_circ_0007905表达水平升高,初步说明了hsa_circ_0007905作为circRNA的一员,在CSCC的发生发展中发挥了重要的作用。
hsa_circ_0007905定位于1号染色体180953812-180962561基因区间,共391个核苷酸,又名circSTX6。目前除了Huang等[8]的研究,文献中也发现一篇关于hsa_circ_0007905的研究,在胰腺导管上皮癌中circSTX6表达水平上调,通过吸收miR-449b-5p来调节非肌肉肌球蛋白重链9(MYH9)的表达促进了肿瘤的增殖和转移[20]。本文研究同样发现在CSCC中表达水平上调,进一步说明了hsa_circ_0007905在癌症中发挥促癌基因的作用。在分析hsa_circ_0007905表达与CSCC临床病理参数的关系发现,hsa_circ_0007905的表达与CSCC的肿瘤大小和分化程度密切相关,而与患者年龄、HPV感染、淋巴结转移和TNM分期之间无相关性(P均>0.05)。表明高表达的hsa_circ_0007905参与了宫颈癌细胞的生长和分化过程,hsa_circ_0007905表达水平越高,肿瘤就越大而且分化程度越低,恶性程度越高,最终能影响CSCC的进展和预后。TNM分期中的T代表原发肿瘤的大小和浸润深度,但本研究结果显示hsa_circ_0007905表达与CSCC的TNM分期无关,可能是因为本研究划分的肿瘤直径大小与TNM分期原发肿瘤大小不一致且本研究标本数量偏少有关。
进一步功能性研究发现过表达hsa_circ_0007905后,细胞的增殖活性升高;降低hsa_circ_0007905表达后,细胞的增殖活性下降,再次提示hsa_circ_0007905促进CSCC细胞的增殖活性,参与了CSCC细胞的生长过程。在裸鼠体内移植瘤实验中,敲低hsa_circ_0007905表达后肿瘤生长缓慢,体积较小,瘤体重量也较轻。该实验结果同样验证了hsa_circ_0007905能促进CSCC细胞的增殖和生长。
综上所述,hsa_circ_0007905在CSCC组织中表达水平上调,与肿瘤的分化程度和大小密切相关;hsa_circ_0007905是一个新的促进宫颈癌细胞的生长增殖的癌基因,本研究为未来靶向治疗CSCC提供有力的实验依据。

