右美托咪定通过SIRT3去乙酰化TFAM对HK-2细胞缺血再灌注损伤的影响*
胡 晨 刘玉丽
广东省惠州市中心人民医院 516001
缺血再灌注损伤(Schemia-reperfusion injury,IRI)是造成急性肾损伤(Acute kidney injury,AKI)的常见原因,也是肾脏手术围术期常见并发症,严重可出现多系统综合征,危及患者的生命安全,是亟待解决的临床问题[2]。围术期的AKI以IRI为主要表现,其机制与炎症反应、氧化应激等诱导的线粒体损伤有关[2]。右美托咪定(Dexmedetomidine,Dex)是一种高选择性的α2肾上腺素能受体激动剂,能减小IRI诱发的线粒体损伤,而线粒体是细胞器中调节功能的重要物质,也是IR造成的氧化应激损伤靶点[3]。沉默信息调节因子2相关酶(Silence information regulator 2 homolog,SIRTs)被证实在细胞功能的调控和抗氧化防御中有重要作用,其中SIRT3被证明存在于线粒体中,可介导线粒体蛋白去乙酰化而减轻线粒体损伤[4]。线粒体转录因子A(Transcription factor A,TFAM)能调控线粒体DNA的拷贝数和转录活性并参与细胞凋亡[5]。目前关于Dex能否通过SIRT3去乙酰化TFAM影响肾小管上皮细胞(HK-2)的IRI有待于进一步研究,故本研究探讨其相关机制,旨为AKI的机制研究及防治提供参考。
1 材料与方法
1.1 细胞与试剂 人HK-2细胞株(中科院上海细胞库),盐酸右美托咪定注射液(扬子江药业集团有限公司,国药准字H20183219,2ml∶0.2mg),SIRT3抑制剂(3-TYP,大连美仑生物技术有限公司),RPMI 1640培养基(北京诺为生物技术有限公司),胰蛋白酶(美国Biosciences),10%胎牛血清、细胞用青/链霉素(美国Sigma公司),BCA试剂盒(武汉艾迪康生物科技有限公司)、RIPA蛋白裂解液(北京索宝来科技有限公司),细胞计数试剂盒(CCK-8)、NAD+/NADH检测试剂盒(上海碧云天生物技术有限公司),活性氧(ROS)检测试剂盒(上海酶联生物科技),MitoTracker Red CMXRos线粒体红色荧光探针、质粒小提试剂盒(武汉赛默飞世尔科技中国),线粒体膜电位检测试剂盒(JC-1,abcam中国),Protein A/G免疫磁珠(美国Med Chem Express公司),反转录试剂盒(海联迈生物工程有限公司),IL-6、IL-8、IL-10酶联免疫试剂盒(武汉生工生物工程有限公司)。兔抗SIRT3、TFAM单克隆抗、辣根过氧化酶标记的IgG抗体(美国Santa Cruz公司),Tanon凝胶成像系统(北京原平皓生物技术)。
1.2 IRI细胞模型建立 细胞复苏后培养于含10%胎牛血清的RPMI 1640培养基,于常规条件下(5%CO2、37℃)培养,细胞单层贴壁生长铺满培养瓶后,胰酶消化重悬继续培养传代。取对数生长期细胞,制备2×105个/孔单细胞悬液,接种于6孔板中,以无血清的培养基培养,于37℃、5%CO2、1%O2、94%N2环境中培养,24h后更换正常完全培养基,常规条件继续培养2h复氧,建立IRI细胞模型。
1.3 细胞培养及分组 将细胞分为对照组(常规培养)、缺血/灌注(I/R)组、Dex组、3-TYP组及Dex+3-TYP组。Dex组、3-TYP组及Dex+3-TYP组在I/R制备前分别给予0.015nmol/L的Dex、50μmol/L 3-TYP孵育2h及0.015nmol/L Dex+50μmol/L 3-TYP共同孵育2h;I/R组及对照组在建模前加入等量生理盐水处理,对照组不予以I/R制备。
1.4 细胞活力检测 对数生长期HK-2细胞消化重悬,以2×104/ml接种于96孔板,100μl/孔,按照对应分组处理24h、48h后,更换为CCK-8溶液(10%)浓度,继续孵育2h后以酶标仪检测A450nm的光密度值(OD),OD值越高表示细胞活性越强。
1.5 炎症因子检测 各组干预24h后细胞,收集上清液,以ELISA试剂盒检测IL-6、IL-8、IL-10表达水平,严格按照试剂盒说明书操作,检测A450nm的OD值,根据标准曲线计算各组细胞炎症因子水平。
1.6 线粒体损伤情况检测 (1)线粒体ROS表达情况:干预24h后细胞以线粒体提取试剂盒提取线粒体,加入NAD+/NADH工作液5μmol/L,37℃孵育10min,使用酶标仪检测荧光强度,以对照组为标准差在荧光显微镜下观察细胞荧光强度。(2)线粒体膜电位(Mitochondrial membrane potential,MMP)测定:各组细胞经PBS洗涤后重悬,与工作浓度为5μmol/L的JC-1共孵育15min(37℃),在荧光显微镜下观察,以红色与绿色荧光比值衡量线粒体去极化程度。以对照组为标准化,观察比值。比值越高表明线粒体去极化降低MMP增加,反之则去极化增加,膜电位下降。(3)线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)开放程度:各组细胞加入1ml的染色工作液混合均匀,37℃震荡孵育10min,以mPTP荧光检测试剂盒及酶标仪检测(激发波长488nm、发射波长530nm)的荧光强度,荧光强度下降表明mPTP开放,增加表明mPTP被抑制。(4)线粒体DNA(mtDNA)检测:收集各组干预24h细胞,DNA提取试剂盒分离DNA,NAD+/NADH确定mtDNA数量,以β-actin为内参基因,进行实时荧光定量PCR反应,引物序列:mtDNA-F:ACCGCTAACGCCTTAAGCATACT,mtDNA-R:CCGATCGGACATGFCACCCGTTA,根据试剂盒说明书设置反应体系及扩增条件,以内参基因与目的基因样本Ct均值得出mtDNA拷贝数量变化率。
1.7 Western Blot(WB)检测SIRT3表达及TFAM的去乙酰化 各组细胞提取蛋白经裂解液裂解后,4℃情况下12 000r/min离心5min,留取上层血清,经抗赖氨酸乙酰化抗体孵育,蛋白G免疫磁珠沉淀免疫复合物,洗涤后,95℃加热变性。经BCA试剂盒检测蛋白浓度,SDS-PAGE电泳分离,经半干转膜法将蛋白转移至PVDF膜,TBST溶液洗膜后室温封闭,加入TFAM一抗稀释液(1∶1 000),4℃孵育过夜,加入二抗(1∶5 000)室温孵育1h,ECL显影,凝胶成像系统测定蛋白条带灰度值。SIRT3检测,取蛋白经裂解液裂解后,取上清,检测蛋白浓度,其余方法同TFAM检测。
1.8 Co-IP验证SIRT3与TFAM相互作用 对照组、3-TYP组与Dex细胞提取的总蛋白按照Protein A/G免疫磁珠进行蛋白提纯,取30μl磁珠加入SIRT3及IgG一抗,充分混合后室温孵育1h,清洗富集磁珠,蛋白样本与磁珠充分混合,4℃孵育过夜,清洗磁珠,8 000r/min离心30s,自然沉淀2min,弃上清,以20倍磁珠体积的TBS溶液清洗沉积物,弃上清,经0.1mmol/L甘氨酸清洗磁珠,弃上清加入上样缓冲液,水浴变性10min行WB检测。
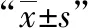
2 结果
2.1 细胞活力比较 与对照组比较,I/R组、Dex组、3-TYP组和Dex+3-TYP组24/48h的OD值均下降(P<0.05);与I/R组比较,Dex组和Dex+3-TYP组24/48h的OD值均升高,3-TYP组则下降(P<0.05);与Dex组比较,3-TYP组和Dex+3-TYP组24/48h的OD值均下降(P<0.05);与3-TYP组比较,Dex+3-TYP组24/48h的OD值均升高(P<0.05)。见表1。
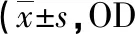
表1 各组细胞活力比较值)
2.2 细胞炎症因子水平比较 与对照组比较,I/R组、Dex组、3-TYP组和Dex+3-TYP组IL-6、IL-8水平均升高,IL-10水平均下降(P<0.05)。与I/R组比较,Dex组和Dex+3-TYP组IL-6、IL-8水平均下降,3-TYP组IL-6、IL-8则升高;Dex组和Dex+3-TYP组的IL-10水平均升高,3-TYP组IL-10则下降(P<0.05)。与Dex组比较,3-TYP组和Dex+3-TYP组IL-6、IL-8水平均升高,IL-10水平均下降(P<0.05)。与3-TYP组比较,Dex+3-TYP组IL-6、IL-8水平均下降,IL-10水平升高(P<0.05)。见表2。
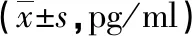
表2 各组细胞炎症因子水平比较
2.3 线粒损伤指标比较 与对照组比较,I/R组、Dex组、3-TYP组和Dex+3-TYP组ROS水平升高,MMP、mPTP及mtDNA均下降(P<0.05)。与I/R组比较,Dex组和Dex+3-TYP组ROS水平均下降,MMP、mPTP及mtDNA均升高;3-TYP组的ROS水平升高,MMP、mPTP及mtDNA则下降(P<0.05)。与Dex组比较,3-TYP组和Dex+3-TYP组ROS水平均升高,MMP、mPTP及mtDNA均下降(P<0.05)。与3-TYP组比较,Dex+3-TYP组ROS水平下降,MMP、mPTP及mtDNA升高(P<0.05)。见表3。
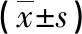
表3 各组线粒损伤指标比较
2.4 SIRT3表达及TFAM乙酰化水平比较 与对照组比较,其余各组SIRT3蛋白表达水平均降低,TFAM乙酰化水平均升高(P<0.05)。与I/R组比较,Dex组与Dex+3-TYP组的SIRT3蛋白表达水平升高,TFAM乙酰化水平下降;3-TYP组的SIRT3蛋白表达水平下降,TFAM乙酰化水平升高(P<0.05)。与Dex组比较,3-TYP组与Dex+3-TYP组的SIRT3蛋白表达水平均下降,TFAM乙酰化水平均升高(P<0.05)。与3-TYP组比较,Dex+3-TYP组的SIRT3蛋白表达水平升高,TFAM乙酰化水平下降(P<0.05)。见表4。
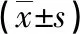
表4 各组细胞SIRT3表达及TFAM乙酰化水平比较
2.5 SIRT3与TFAM的结合情况 IP SIRT3蛋白条带显示,使用SIRT3进行沉淀试验,SIRT3与TFAM均被沉淀,证实SIRT3与TFAM之间存在相互作用。见图1。
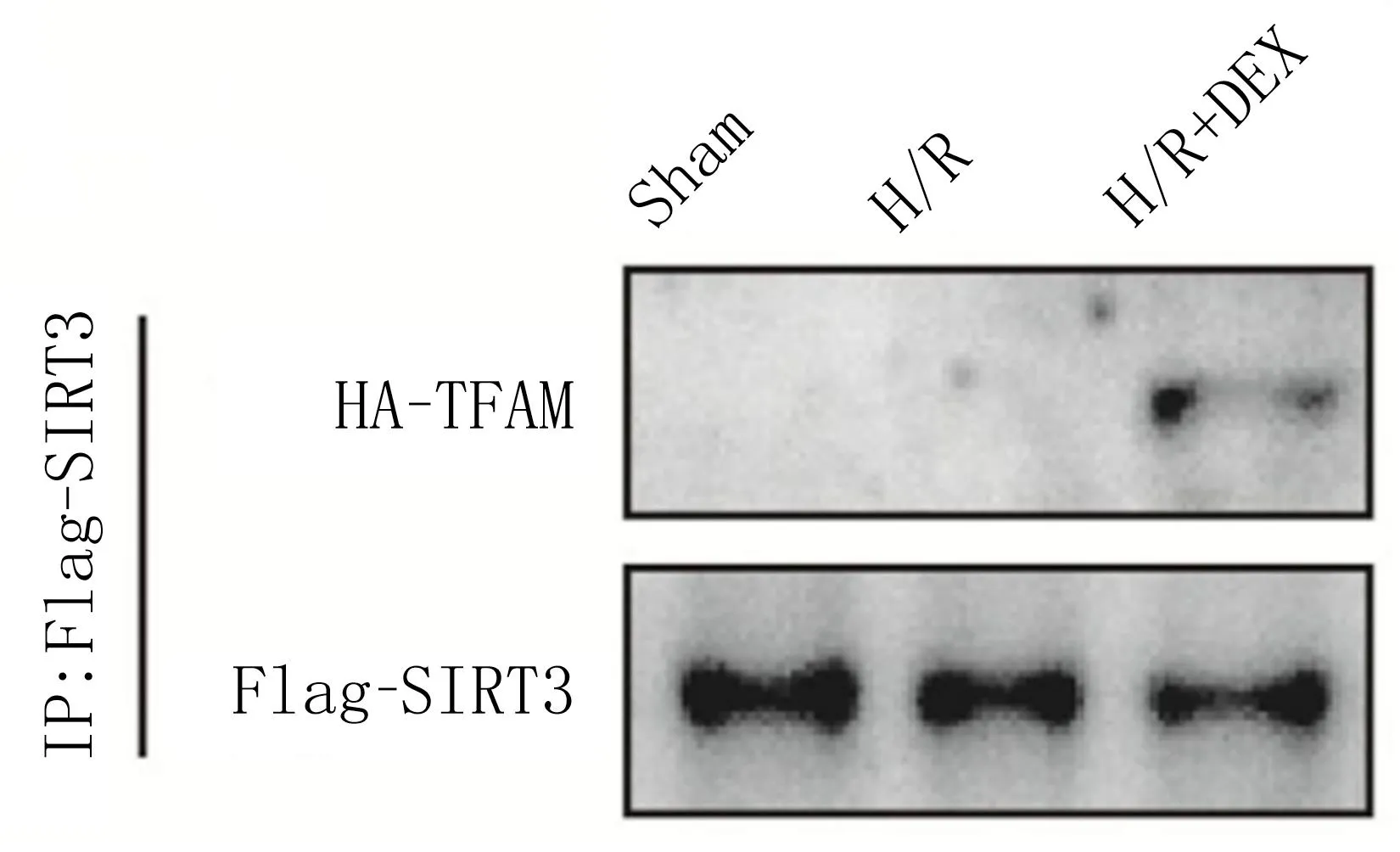
图1 Co-IP检测SIRT3和TFAM的物理相互作用
3 讨论
AKI除可在短期内造成高死亡率外,还被认为是慢性肾脏病发展的重要危险因素,其机制涉及肾小管、微血管及炎症的不同信号通路和分子[6]。线粒体功能障碍在IRI引起的AKI发生发展中有关键作用[7]。线粒体是高速动态的细胞器,丰富的线粒体能够产生足够的腺嘌呤核苷三磷酸维持肾脏生理功能[8],因此减轻肾脏细胞线粒体功能障碍是IRI及AKI治疗的研究热点。
本研究结果显示,干预后的各组OD值、IL-10水平,线粒体MMP、mPTP及mtDNA较对照组下降,线粒体ROS水平及IL-6、IL-8水平较对照组升高,而3-TYP干预后的变化更为明显,经Dex干预后的OD值、IL-10水平,线粒体MMP、mPTP及mtDNA则升高,线粒体ROS水平及IL-6、IL-8水平下降,Dex+3-TYP组变化介于I/R组与Dex组之间,说明Dex可增加IRI的HK-2细胞活性,抑制炎症及氧化应激损伤,改善线粒体功能。Dex是临床常用的镇静、止痛类药物,有调节免疫、抗感染、抗氧化应激及抑制交感神经的作用[9]。肾IRI时发生剧烈的氧化应激损伤,使内皮细胞生成前列腺素E2及一氧化氮,细胞内抗氧化酶活性下降,ROS增多,而ROS可促进前列腺素、白三烯等物质的合成,增加IL-6、IL-8等炎症介质的释放,抗炎因子IL-10水平降低,加重细胞损伤[10]。杨昊天等[11]研究发现,Dex具有抗氧化作用,能减轻急性氧化应激肾损伤模型大鼠的氧化应激指标水平,改善肾损伤,在应激综合征中具有潜在的治疗作用。宋云飞等[12]则证实Dex能减轻APP/PS1小鼠海马区炎性因子的分泌,抑制细胞凋亡。吴华兵[13]研究中亦发现Dex能抑制缺氧/复氧条件下心肌细胞PTEN诱导激酶1/E3泛素连接酶通路介导的线粒体自噬,减轻氧化应激损伤。上述研究证实了Dex在抗氧化应激、抗炎及改善线粒体功能方面的作用,与本研究结果具有同质性。
SIRT3是主要的线粒体乙酰转移酶,能调节线粒体的稳态、代谢、基因转录、应激反应和基因组的稳定性,参与机体各种生理病理过程。研究发现,Sirt3缺陷型小鼠的寿命短于野生型,这可能与缺乏Sirt3调节的心脏线粒体功能障碍和造血干细胞中的ROS稳态失调引起的心力衰竭有关[14]。Si等[15]则认为Dex减轻肾IRI需要Sirt3的激活。TFAM是位于人和小鼠10号染色体长臂21区上的高迁移率蛋白,能与线粒体DNA上的轻链启动子和高呼吸活性的细胞上游识别位点特异性结合刺激转录,调控mtDNA拷贝数并影响线粒体功能。TFAM的乙酰化使TFAM的基因表达及蛋白质活性被抑制,影响TFAM对线粒体功能的调控作用。本研究结果中,干预后的各组SIRT3蛋白表达水平较对照组降低,TFAM乙酰化水平较对照组升高,3-TYP干预后的细胞变化最明显,而Dex干预后SIRT3蛋白表达水平则有所升高,TFAM乙酰化水平下降,Dex+3-TYP组变化介于I/R组与Dex组之间,Co-IP检测SIRT3和TFAM存在物理相互作用,结果提示Dex可通过SIRT3去乙酰化减轻HK-2细胞的IRI。
综上所述,Dex能减轻HK-2细胞的IRI,提高细胞活性,抑制炎症,改善线粒体功能,其机制可能与SIRT3去乙酰化TFAM有关。

