地舒单抗在大鼠脆性骨折愈合中的疗效观察*
庄洵荣 吴文华 庄雪瑜 郑剑锋 何立江
福建医科大学附属第二医院脊柱骨科,福建省泉州市 362000
骨质疏松症是一种以骨矿物质含量减少和骨密度降低为特征的全身性疾病,随着骨骼脆性增加,容易发生脆性骨折,是中老年多发病[1]。它被认为是引起老年骨折的最主要原因,此类骨折患者因本身骨质疏松疾病特点,骨折多呈粉碎性,愈合慢,且因骨强度降低更易导致内固定松动及再骨折,不仅大大降低了患者的生活质量,而且具有极高的致残率和致死率[2]。随着我国社会的老年化,对于骨质疏松相关性骨折的防治是现今研究的重点领域。
抗骨质疏松药物种类繁多,地舒单抗(denosumab)是一种针对破骨细胞的全人源单克隆抗体,其通过与核因子-κB受体活化因子配体(RANKL)相耦合,有效阻碍RANKL与其受体RANK结合,抑制破骨细胞的生成与活化,进而减少骨的吸收,提高骨的密度[3]。地舒单抗作为全球迄今唯一获得批准上市的单克隆抗体类药物,为老年骨质疏松疾病的治疗提供了新的解决方案。虽然地舒单抗在抗骨质疏松症治疗方面具有确切疗效,但近年来随着对该类患者的骨微结构和质量进行深入研究,人们发现相较于传统的双膦酸盐类抗骨质疏松药物,地舒单抗具有更低的骨重塑率,部分病例甚至发生非典型股骨骨折的并发症。因此,对于合并骨质疏松症的骨折患者使用地舒单抗,其有效抑制破骨细胞同时是否会影响新生骨重建,进而对骨折恢复过程造成干扰目前尚存在争议[4]。本实验意在建立骨质疏松骨折的大鼠模型,探讨地舒单抗在骨质疏松骨折愈合中的作用,为临床应用提供参考。
1 材料与方法
1.1 材料 (1)实验动物:60只健康的6月龄无特定病原体(SPF级)雌性SD大鼠,体重(278.19±15.33)g,购自北京华阜康生物科技股份有限公司[SCXK (京) 2019-0008]。实验前所有大鼠均适应性喂养1周,实验动物于泉州医学高等专科学校动物实验中心分组笼养[SYXK(闽)2016-0001],随机分为A、B、C三组,每组20只。按实验动物的3R使用原则给予照护,专人喂养,自由饮水,饲养温度控制在(26±1)°C,实验过程中每周称重并记录。(2)药物与仪器:实验药物地舒单抗(普罗力)购自美国Amgen制药有限公司;DR数字化X线摄影系统购自荷兰飞利浦公司;双能X线骨密度测定仪购自美国HOLOGIC公司;光学显微镜购自德国莱卡公司;万能力学实验机购自美国Bose公司。
1.2 建立骨质疏松骨折模型 10%水合氯醛按300mg/kg剂量对大鼠腹腔内注射麻醉,大鼠取俯卧位,以脊柱两侧各约1cm髂骨脊上2cm为术野中心,去毛后消毒铺巾,B、C两组大鼠切除双侧卵巢,A组大鼠切除等量脂肪团块。手术当天肌注80万单位青霉素。4周后,双能X线骨密度测定仪检查骨密度,确定成功制备B、C两组大鼠骨质疏松动物模型。三组大鼠分别在初次手术后第5周,同样方式麻醉大鼠,以左股骨处为手术切口,截骨钳截断股骨,克氏针固定断端,手术当日肌注80万单位青霉素。B组大鼠依照实验动物体重剂量折算系数法,手术当日按375mg/kg剂量皮下注射地舒单抗。
1.3 实验检测指标 三组大鼠骨折术后第3、6周分别各随机挑选10只处死,股骨标本经DR数字化摄影机拍照观察骨折愈合情况;同时X线骨密度测定仪测量标本骨密度值变化;万能力学实验机采用四点弯曲力学检测方法,控制应力方向,加载速度2mm/min,记录压力—位移曲线并计算最大载荷及最大载荷回复率;最后标本切片经处理后常规脱蜡,苏木精—伊红染液进行染色,观察骨痂处骨小梁、软骨细胞及骨基质等显微形态学变化。
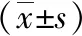
2 结果
2.1 三组大鼠骨折模型骨密度比较 各时点骨密度(BMD)结果显示,骨折建模术后第3周时,B组BMD(0.119±0.010)与C组(0.109±0.011)相当,两组间差异无统计学意义(P>0.05),但两组BMD数值均低于A组(0.176±0.010) (P<0.05)。骨折术后第6周时,三组大鼠BMD较术后第3周时有明显增加,但表现为A组(0.221±0.029)>B组(0.197±0.024)>C组(0.174±0.021),三组间差异有统计学意义(P<0.05)。见图1。
图1 各组大鼠骨折模型骨密度对比
2.2 三组大鼠最大载荷值、最大载荷回复率比较 力学测试结果显示,三组各数值在骨折建模术后第3周时均降低,但随着时间推移而回升,骨折建模术后第6周时各组数值均高于术后第3周。骨折建模术后3周、6周时股骨最大载荷和最大载荷回复率由大到小依次为:A组>B组>C组,差异均有统计学意义(P<0.05)。见表1。
表1 各组大鼠最大载荷值、最大载荷回复率力学对比
2.3 影像学变化 术后第6周各组大鼠均实现骨折愈合,股骨骨折处骨痂生长,但A、B组较C组骨膜反应深,骨小梁更浓密,骨痂体积肥厚,密度增深,断端局部骨痂密度更接近骨皮质密度。见图2。
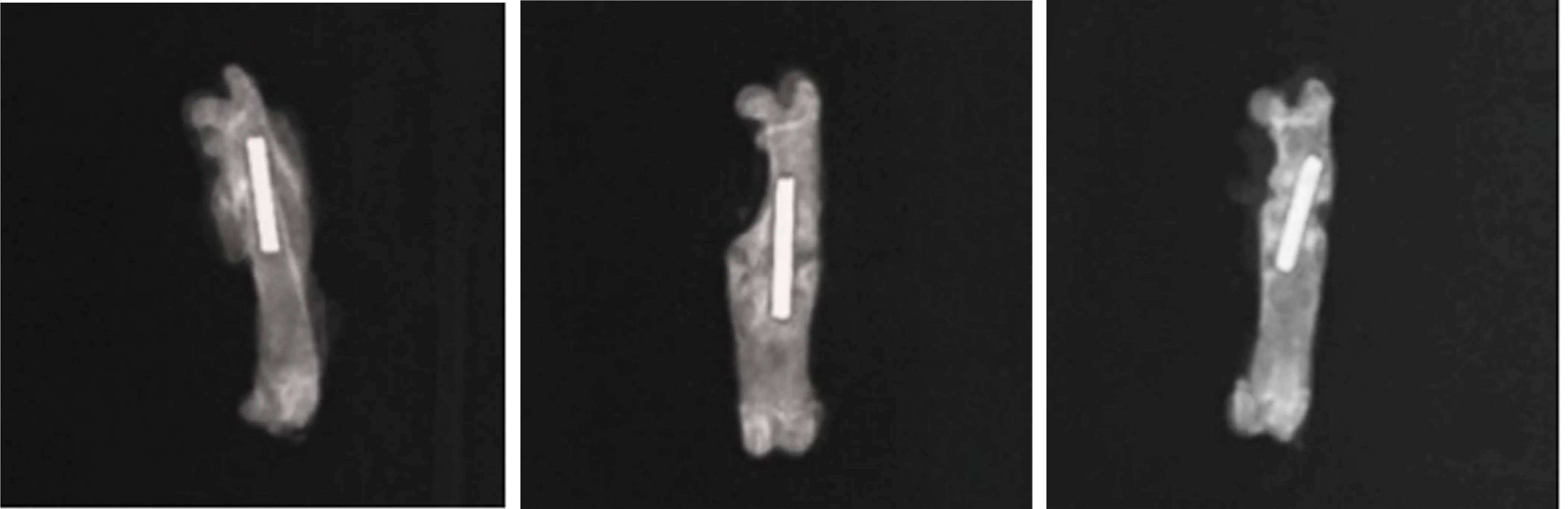
A组 B组 C组
2.4 组织病理学变化 术后第6周时,A、B组较C组骨皮质更厚实,骨小梁连续性更好且更密集,骨小梁附近成骨细胞与骨细胞数量更多、密度更高。见图3。
3 讨论
骨质疏松症是最常见的老年慢性进展性疾病,由于骨矿物质含量丢失导致骨骼脆性增加,此类患者极易因为骨的强度降低发生骨折,伴发的骨质疏松症相关性骨折不仅大大降低了患者的生活质量,而且骨折手术容易发生骨内固定物松动、骨折骨愈合和再次骨折,尽快提高患者的骨矿物质密度和骨强度,促进骨折愈合,避免二次骨折尤其重要[5]。
药物治疗是治疗骨质疏松症的重要途径,地舒单抗作为目前新获批上市的、活性最强的、可用于人体治疗的RANKL抑制类药物,其与同样作为抗骨吸收药的双膦酸盐类药物作用机制却大不相同,它对骨矿物质没有亲和力,而是通过结合和抑制RANKL达到降低破骨细胞分化与增殖的目的,已有研究表明其比双膦酸盐类药物能更高效地提高患者骨密度[6-7]。此外地舒单抗起效不存在平台期,没有“药物假期”的现象,长期使用可以持续提高全身骨密度[8]。针对大多数主要临床研究仅面向绝经后女性骨质疏松治疗,Jeong等人[9]分析了地诺单抗对男性骨质疏松患者的影响,这是亚洲地区人群首批此类研究,研究结果表明与女性疗效相当,地诺单抗也有效地增加了骨质疏松症男性回顾性队列腰椎和髋部的骨矿物质密度,包括那些初次治疗即使用地舒单抗的患者和最初使用双膦酸盐而后改用地舒单抗的患者。但需要注意的是地舒单抗抑制骨转换具有可逆性,且停药具有反弹效应,即停药可能导致骨转换增加和骨密度迅速下降,导致多发性椎骨骨折的潜在高风险。目前地舒单抗停药后序贯治疗的理想方案仍在探寻中[10]。
人体骨折愈合骨修复重建时,骨转换过程是成骨细胞与破骨细胞相互偶联的动态变化过程,除了成骨细胞在骨折愈合过程中发挥主要作用,破骨细胞在骨组织的塑形重建中亦发挥重要功能,两者相辅相成,在骨痂形成同时又避免骨痂过度生长影响骨骼重建和骨折愈合[11]。地舒单抗治疗骨质疏松症效果肯定,但在骨质疏松骨折患者应用该类药物,其抑制破骨细胞的药理作用是否会干扰骨折愈合过程中的新生骨重建和塑形,进而对骨折愈合造成影响目前相关研究尚少,国外仅有小规模临床研究表明,老年骨质疏松症患者全髋关节置换术后2周内应用地舒单抗治疗,1年后假体周围骨量较安慰剂组增加[12]。本次对卵巢切除骨质疏松模型大鼠股骨骨折术后应用地舒单抗的实验发现,应用地舒单抗组大鼠股骨骨折处骨愈合良好,未发生骨折延迟愈合,地舒单抗抑制破骨细胞的同时,对成骨细胞的生物活性功能无明显干扰。骨折术后第3周时,B组与C组大鼠的BMD差异无统计学意义,但两组BMD数值均低于A组大鼠BMD值(P<0.05),证明了合并有骨质疏松的骨折病例,其骨折处骨密度含量较正常骨折病例为低。骨折术后第6周时,三组大鼠间BMD由高至低依次为:A组>B组>C组,各组间差异均有统计学意义,此外三组大鼠的最大载荷和最大载荷回复率也呈现同样的差异(P<0.05),同时X线影像学观察结果显示C组大鼠骨折处的骨痂较其他两组来说骨痂相对体积更狭小,骨小梁显得疏松,局部骨密度显影低。组织病理切片可观察到其他两组较C组骨皮质更厚实,骨小梁连续性更好且更密集,骨细胞数量更多和密度更高。实验结果表明,骨质疏松脆性骨折愈合中使用地舒单抗,在骨折愈合期可以明显提高骨密度,增加骨骼应力强度,这得益于单克隆抗体能以高度亲和力与RANKL结合,阻断其与受体RANK的相互作用,抑制破骨细胞的生成与活性,从而减少骨吸收、增加骨量、改善骨强度的作用机理有关[13]。此外无大鼠拒食等其他不良事件发生,表明地舒单抗对RANKL的结合同时具有高度特异性,目前研究未发现其与TNF家族的其他成员(如TNF-α、TNF-β等)相结合而导致相应不良反应,具有较高的药物安全性[14-16]。
作为国内批准上市不久的单克隆抗体药物,地舒单抗在本次应用研究中未对实验动物的骨折愈合造成不利影响,而且在骨折治愈期,实验组表现出更好的骨密度和更佳的骨强度,表明地舒单抗对增强骨折愈合能力,预防内固定松动和发生二次骨折具有一定作用。当然本实验也有不足之处:首先本实验为大鼠卵巢去势切除模仿绝经后的骨质疏松骨折模型,实验动物无法配合术后制动,而自由活动可能在一定程度上会对骨折愈合造成影响。其次,停用地舒单抗可能会导致机体骨密度丢失和骨吸收增加同步发生,进而提高发生骨折的风险[17],因此对该药物如何确定理想的停药时间及停药后的合理序贯治疗,需要进一步研究并制定最佳的策略。

