低蛋白饲料补充必需氨基酸对异育银鲫生长、氨基酸转运和mTOR信号通路相关基因的影响
何林岳 刘昊昆韩 冬朱晓鸣金俊琰杨云霞解绶启
(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉 430072;2.中国科学院大学,北京 100049)
蛋白质是对于鱼类生长最为关键的营养因子[1],鱼类的蛋白质需求量普遍高于畜禽动物[2],饲料蛋白水平过高带来高昂成本的同时,还容易加剧养殖水体水质恶化[3]。蛋白质进入鱼体,在消化酶的作用下被水解为氨基酸进行消化吸收,故鱼类实际上没有特定的蛋白质需求,而是对组成蛋白质的氨基酸的需求[4],水产饲料中氨基酸的平衡及含量,尤其是必需氨基酸的平衡及含量直接影响到鱼类生长、肌肉蛋白质沉积、蛋白质利用效率及养殖水环境氮排放[5]。随着晶体氨基酸生产技术的成熟,在饲料中添加适量晶体氨基酸,不仅能够减少蛋白原料的用量,降低饲料成本,还能促进生长、改善鱼体健康状况等[6],最近有研究指出,斑点叉尾鮰(Ietalurus Punetaus)饲料蛋白水平由32%降至26%并额外补充赖氨酸和组氨酸至平衡,能够维持鱼体正常生长水平[7];在布氏鲳鲹(Trachinotus blochii)饲料中补充赖氨酸和蛋氨酸可以降低其蛋白需求,提高鱼体生长性能[8]。
必需氨基酸除了构成蛋白质以外,还作为信号分子参与机体蛋白质代谢等多种生物学过程[9]。雷帕霉素靶蛋白(Mechanistic Target of Rapamycin,mTOR)被认为是调节哺乳动物和鱼类细胞生长及蛋白质翻译起始的关键控制元件[10,11],必需氨基酸可以激活mTOR复合物1,然后上调下游核糖体蛋白S6激酶1(Ribosomal protein S6 kinase 1,S6K1),并抑制真核翻译因子4E结合蛋白2(4E-binding protein 2,4EBP2)和真核翻译起始因子4E(Eukaryotic translation initiation factor 4E,eIF4E)的表达水平[12—15]。有研究指出,极低蛋白饮食会抑制小鼠下丘脑mTOR信号通路从而导致体重下降[16];在团头鲂(Megalobrama amblycephala)的饲料中添加适量精氨酸可以刺激mTOR的表达从而促进鱼体生长[17];对鳜(Siniperca chuatsi)进行脑室注射亮氨酸也能够刺激mTOR信号传导[18]。
异育银鲫(Carassius gibelio)是我国重要的经济性淡水养殖鱼类,2021年全国总产量高达278万吨[19]。异育银鲫“中科5号”(Carassius gibeliovar.CAS V)是利用银鲫特有的异精雌核生殖培育出的子代,较“中科3号”生长更快且更耐受低营养饲料(低蛋白和低鱼粉)[20],具有重要的经济价值和社会效益。目前对异育银鲫必需氨基酸需求量已有所研究,本实验基于必需氨基酸需求量以异育银鲫“中科5号”幼鱼为研究对象,探究低蛋白饲料中补充必需氨基酸对异育银鲫生长、消化及蛋白合成的影响。
1 材料与方法
1.1 实验饲料
本实验制备了3种等能(18% kJ/g)半纯化饲料,分别为对照组(粗蛋白含量35%)、低蛋白组(粗蛋白含量28%)和补充必需氨基酸组(粗蛋白含量28%)。饲料以酪蛋白和谷朊粉为主要蛋白源,玉米淀粉为碳水化合物源,鱼油和豆油等比例混合为脂肪源,参照异育银鲫的必需氨基酸需求量添加晶体氨基酸。对所有原料进行研磨粉碎,混合均匀后过100目筛网加水调配,用制粒机(SLP-45,渔业机械设备研究所,中国上海)制备成2 mm粒径的颗粒饲料,于65℃烘箱烘干后放置4℃冷库中保存备用。饲料配方如表1所示,其中,饲料的必需氨基酸组成见表2。
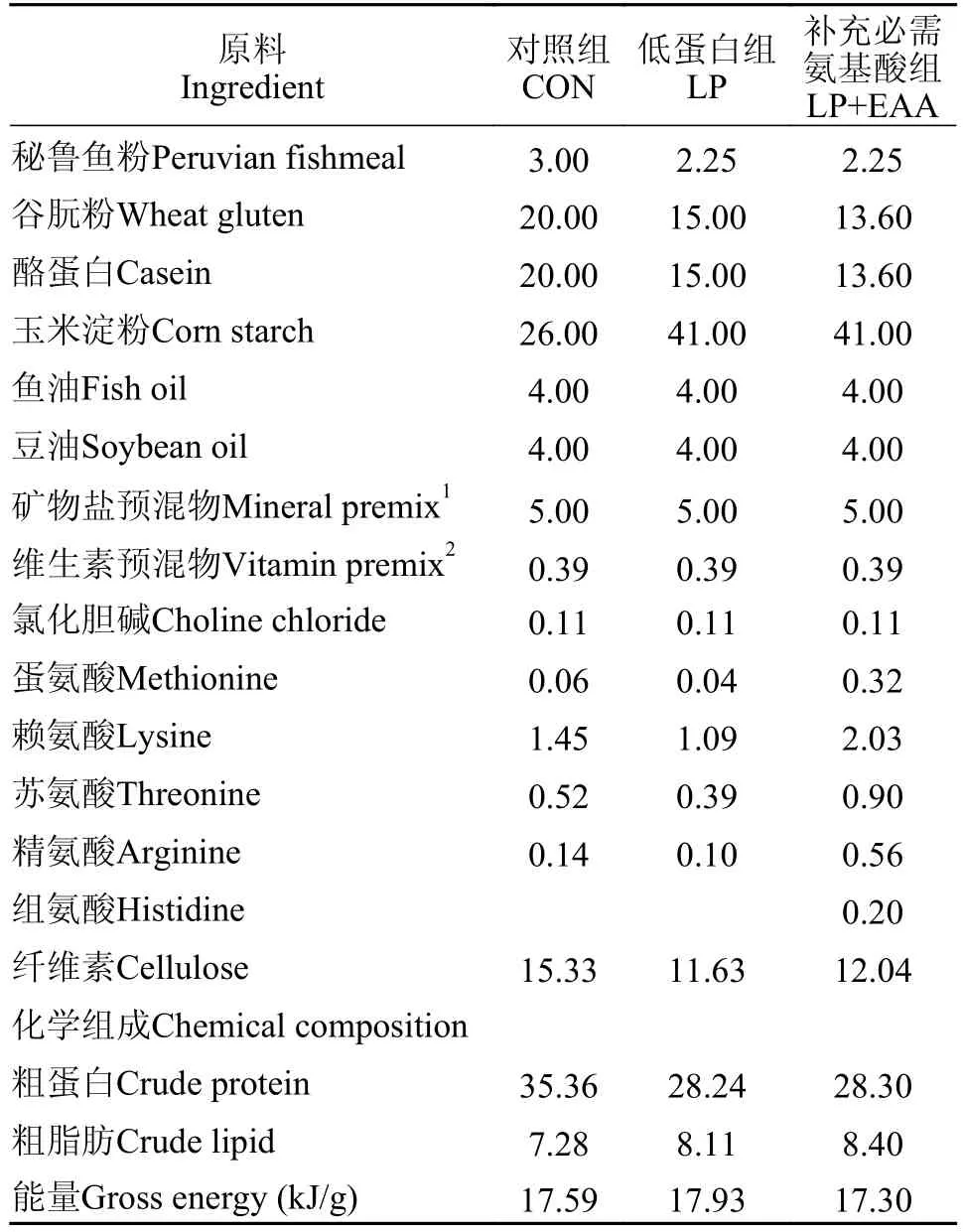
表1 实验饲料配方和化学组成(%干物质)Tab.1 Formulation and chemical composition of experimental diets (% dry matter)
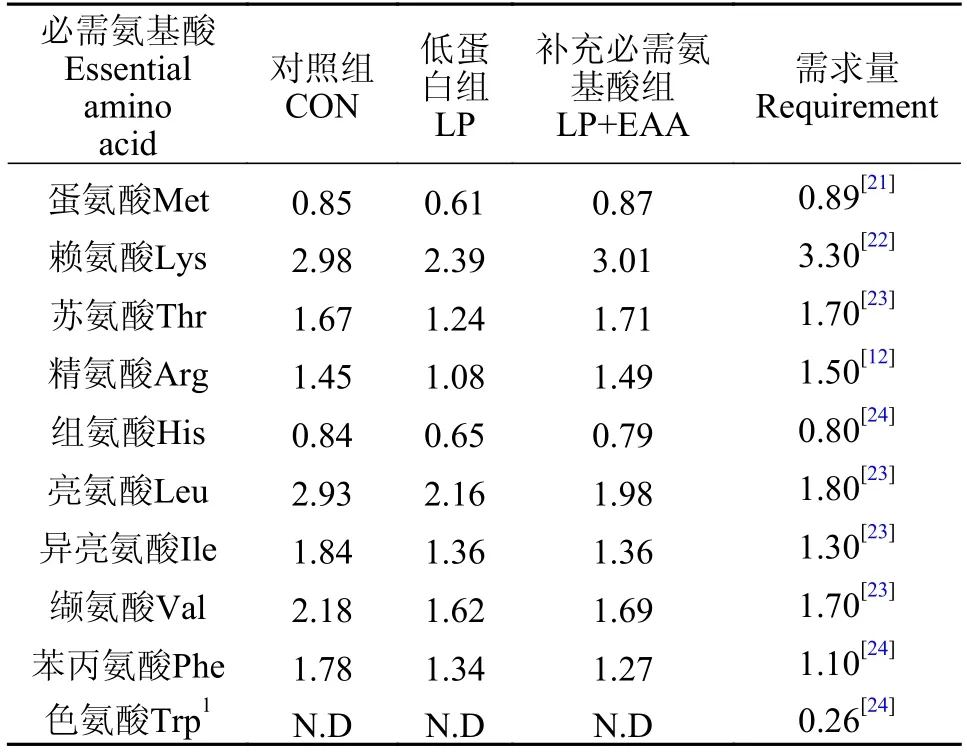
表2 饲料必需氨基酸组成(%干重)Tab.2 Essential amino acid composition of diets (% dry matter)
1.2 实验鱼及饲养管理
实验鱼来自中国科学院水生生物研究所官桥渔场,实验地点为湖北省荆州市石首市老河长江四大家鱼原种场,养殖系统为室外池塘网箱(2 m×2 m×2 m)。正式养殖实验前将鱼在网箱中驯养2周以确保实验鱼对养殖系统的适应。实验开始前对实验鱼进行饥饿24h处理。实验包括3个处理组,每组3个重复,随机选取540尾鱼规格均匀、体质健康的鱼[初重(12.71±0.11) g]称总重后放入网箱,每个网箱60尾鱼,共9个网箱。每日7:00、12:00和18:00进行饱食投喂。在实验期间,每晚20:00至次日清晨7:00使用沉水式充气管道进行连续充气增氧,特殊情况如阴雨天气时,额外在其他时间开启充氧。每天进行水质监测管理,在整个实验期间,水温为(33±2)℃,水体溶氧>6 mg/L,氨氮<0.1 mg/L,养殖实验周期为50d。
1.3 样品采集
用麻醉剂MS-222(60 mg/L,Sigma,USA)将实验鱼麻醉后进行计数并称总重,然后取样。实验开始前,随机选取3组鱼,每组4尾,作为初样,在实验结束时,每个网箱随机选取2尾鱼抹干称重后作为末样,共同储存于-20℃冰箱中,用于测定全鱼体成分。每个网箱取3尾鱼进行体长和体重的测量,并解剖肝脏和内脏团称重用于计算肝体比、脏体比和肥满度。再在每个网箱随机取2尾鱼用肝素钠(浓度0.2%)抗凝剂浸润过的注射器进行尾静脉采血,然后于4℃下3000 r/min离心10min后,取出上清液血浆分装于200 μL的PCR管中,储存于-80℃冰箱用于血浆生化指标分析。同时,将抽完血的2尾鱼在冰浴条件下进行解剖,取出肝脏、肠道和肌肉组织,置于液氮中速冻然后放于-80℃冰箱保存备用。
1.4 样品分析
首先对用于体成分分析的实验鱼样品进行预处理: 将称重后的实验鱼放于高压蒸汽灭菌锅(ES-315,Tomy Kogyo Co.,Japan)中120℃下蒸煮20min,冷却后捣碎,在70℃烘箱中烘干,称重,最后用粉碎机将其粉碎用于后续体成分分析。
饲料、全鱼、肝脏和背肌样品的水分、蛋白质、脂肪和灰分的测定均根据(AOAC,2003)标准方法进行。干物质通过失重法在烘箱(电热恒温干燥箱,精宏,中国上海)中105℃烘干至恒重进行测定;灰分通过失重法在马弗炉(中国湖北英山县建立电炉制造厂)中550℃下煅烧后进行测定;粗蛋白采用凯式定氮仪(2300,Kjeltec Analyzer Unit,FOSS Tecator,Sweden)进行测定;全鱼粗脂肪采用索氏抽提仪(Soxtec System HT6,Tecator,Hoganas,Sweden)进行抽提测定,肝脏和背肌脂肪采用氯仿甲醇抽提法进行测定;饲料氨基酸含量采用茚三酮柱后衍生法,样品用约10 mL 6 mol/L的浓盐酸在110℃下水解24h后,滤纸过滤并定容至50 mL,取1 mL滤液于氮吹仪60℃下氮吹干脱酸,再加入12 mL去离子水,经氨基酸全自动分析仪(A300,membraPure,Germany)上机检测(色氨酸水解过程被破坏,未检测)。
血浆葡萄糖和总蛋白含量采用南京建成生物工程研究所的试剂盒(A154-1-1和A045-2-2)进行检测;血浆和肝脏谷草转氨酶和谷丙转氨酶活性也采用南京建成生物工程研究所试剂盒(C010-2-1和C009-2-1)进行测定;肠道消化酶糜蛋白酶、胰蛋白酶、淀粉酶及脂肪酶等活性采用南京建成生物工程研究所的试剂盒(A080-3-1、A080-2-2、C016-1-1和A054-1-1)进行检测。
基因实时荧光定量PCR相关引物序列见表3。肠道、肝脏和背肌组织样品中总RNA提取采用TRIzol试剂(Invitrogen,USA)依据说明书推荐的方法进行,然后使用1.0%琼脂糖电泳检测总RNA的完整性,NanoDrop®ND-2000(NanoDrop Technologies,USA)测定样品RNA纯度和浓度。接着用M-MLV First-Strand Synthesis Kit(Invitrogen,USA)推荐方法进行反转录,总反应体系为20 μL。用Light Cycle480Ⅱ系统(Roche Diagnostics,Switzerland)及SYBR®Green I Master Mix(Roche Diagnostics,USA)荧光染色试剂进行RT-PCR实时荧光定量检测。反应体系为: 3 μL SYBR®Green PCR Master Mix,2 μL cDNA,0.24 μL Primer F,0.24 μL Primer R和0.52 μL PCR water,共计6 μL。选用β-actin和ef1α作为内参基因,预实验确定扩增效率,用内参和目的基因做标准曲线。计算公式如下:

表3 实时荧光定量PCR引物序列Tab.3 Primers sequence of quantitative RT-PCR (qPCR)
式中,E目标基因为目标基因的扩增效率,E内参基因为内参基因β-actin和ef1α的扩增效率,Ct为Threshold cycle,临界循环数,即荧光阈值与扩增曲线相交,交点所对应的循环数。
1.5 数据处理与分析
本实验所有数据均使用SPSS 21.0进行统计分析,采用均值±标准误的形式(mean±SE,n=6)。实验结果首先进行方差齐性检验,然后进行单因素方差分析(One-way ANOVA),并进行Duncan’s多重比较分析,统计显著性设置为P<0.05。
2 结果
2.1 生长性能和形体指标
如表4所示,低蛋白饲料中补充必需氨基酸对异育银鲫“中科5号”的终末体重、摄食率、特定生长率、饲料效率、蛋白质效率和氮沉积率均有显著影响(P<0.05),其中LP+EAA组摄食率显著低于LP组,且蛋白质效率和氮沉积率最高,相较于LP组特定生长率和饲料效率显著提高(P<0.05);肥满度和肝体比各组间无显著差异(P>0.05),脏体比在LP+EAA组达到最高,且与CON组和LP组差异显著(P<0.05)。
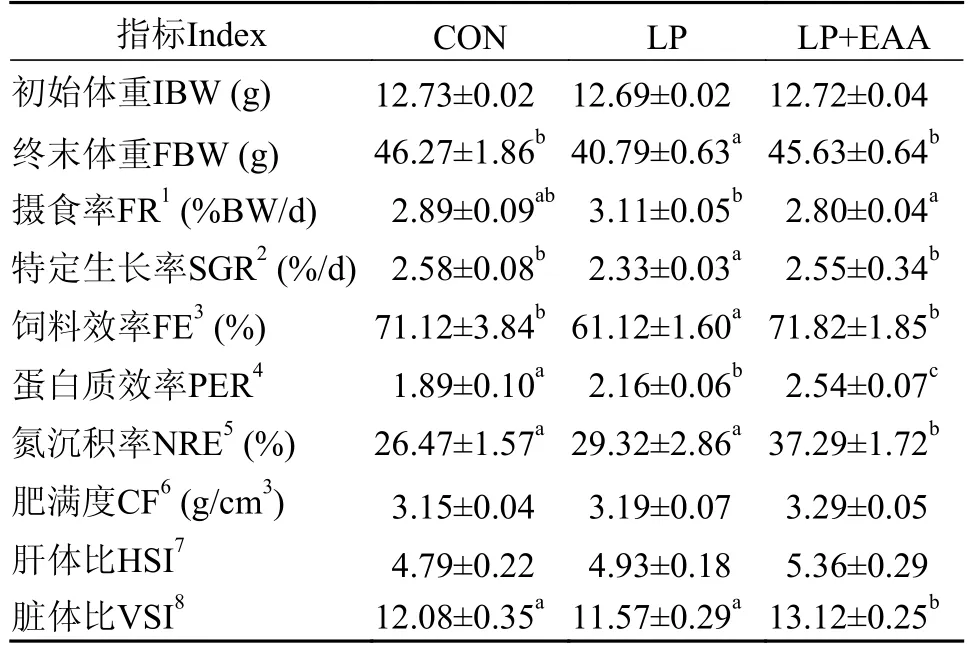
表4 低蛋白饲料补充必需氨基酸对异育银鲫生长性能和形体指标的影响Tab.4 Effects of low protein diets supplement with essential amino acids on the growth performance and morphological indexes of gibel carp
2.2 全鱼体成分及背肌肝脏组分
如表5所示,低蛋白饲料补充必需氨基酸对异育银鲫幼鱼全鱼体组成、背肌组分和肝脏脂肪含量均无显著影响(P>0.05),肝脏蛋白含量在LP组达到最低,且与CON组和LP+EAA组差异显著(P<0.05)。
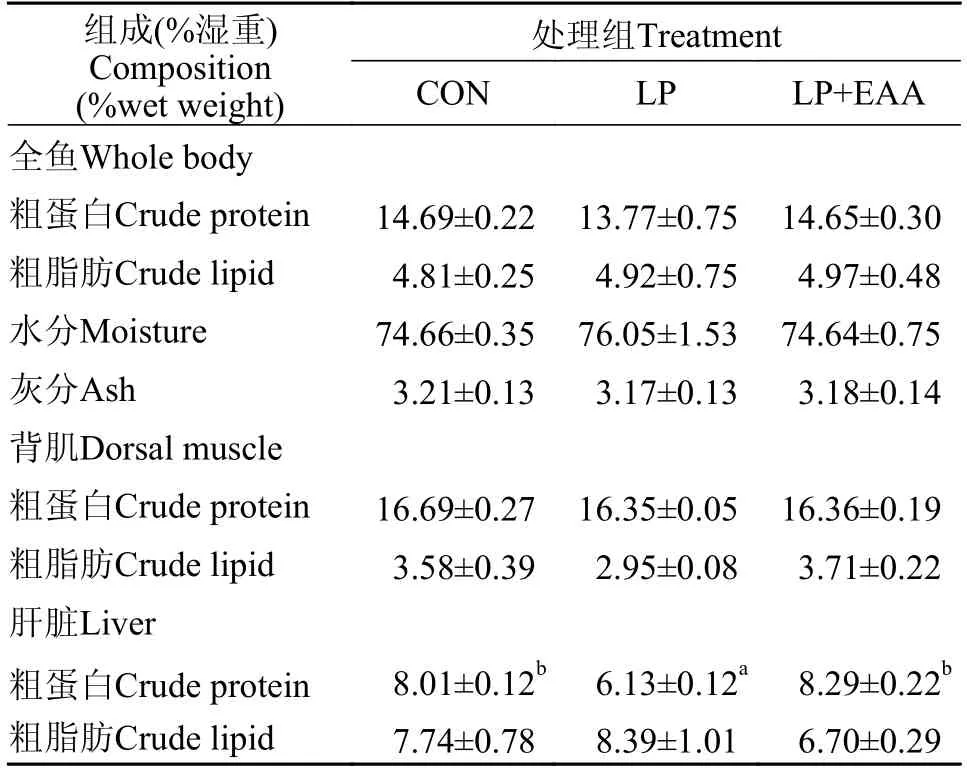
表5 低蛋白饲料补充必需氨基酸对异育银鲫全鱼、背肌和肝脏组分的影响Tab.5 Effects of low protein diets supplement with essential amino acids on composition of whole body,dorsal muscle and liver in gibel carp
2.3 血浆和肝脏生化指标
如表6所示,低蛋白饲料补充必需氨基酸对异育银鲫幼鱼血浆的血糖、谷草转氨酶和谷丙转氨酶活性无显著影响(P>0.05),LP+EAA组的总蛋白含量显著高于LP组(P<0.05);肝脏中的谷草转氨酶在LP+EAA组达到最高。且与LP组和CON组差异显著(P<0.05),而谷丙转氨酶活性各组间无显著差异(P>0.05)。

表6 低蛋白饲料补充必需氨基酸对异育银鲫血浆、肝脏和肠道生化组成的影响Tab.6 Effects of low protein diets supplement with essential amino acids on plasma,liver and intestine biochemical composition of gibel carp
2.4 肠道消化酶活性
如表6所示,LP+EAA组的胰蛋白酶活性与CON组无显著差异(P>0.05)且均显著高于LP组(P<0.05);LP组和LP+EAA组的淀粉酶活性显著高于CON组(P<0.05);糜蛋白酶和脂肪酶活性在各组间无显著差异(P>0.05)。
2.5 氨基酸转运体相关基因相对表达量
如图1所示,低蛋白饲料中补充必需氨基酸对pept1无显著影响(P>0.05),cat2和b0at1在LP组达到最低,且与CON组和LP+EAA组差异显著(P<0.05),asct2和b0,+at在LP+EAA组的表达与CON组无显著差异(P>0.05)。
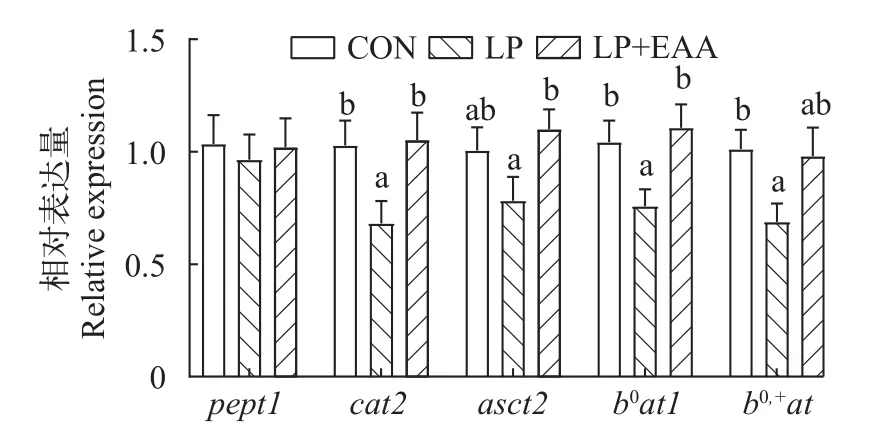
图1 低蛋白饲料补充必需氨基酸对异育银鲫肠道氨基酸转运载体pept1、cat2、asct2、b0at1和b0,+at相对表达量的影响Fig.1 Effects of low protein diets supplement with essential amino acids on the relative expression of the intestinal amino acid transporterspept1,cat2,asct2,b0at1andb0,+atin gibel carp
2.6 肝脏和背肌mTOR信号通路相关基因相对表达量
如图2和图3所示,在肝脏中,LP组的tor相对表达量显著低于CON组(P<0.05),而LP+EAA组与CON组该基因的表达量无显著差异(P>0.05),LP+EAA组s6k1的表达量显著高于LP组(P<0.05),且与CON组无显著差异(P>0.05),而4ebp2和eif4e的表达呈相反的趋势,但在各组间无显著差异(P>0.05);在背肌中,LP+EAA组tor的相对表达量显著高于LP组(P<0.05),eif4e的基因表达量在CON组和LP+EAA组间无显著差异,而LP组显著低于CON组(P<0.05),补充必需氨基酸对异育银鲫背肌的s6k1和4ebp2的相对表达量无显著影响(P>0.05)。

图2 低蛋白饲料补充必需氨基酸对异育银鲫肝脏tor、s6k1、4ebp2和eif4e相对表达量的影响Fig.2 Effects of low protein diets supplement with essential amino acid on the relative expression oftor,s6k1,4ebp2andeif4ein the liver of gibel carp
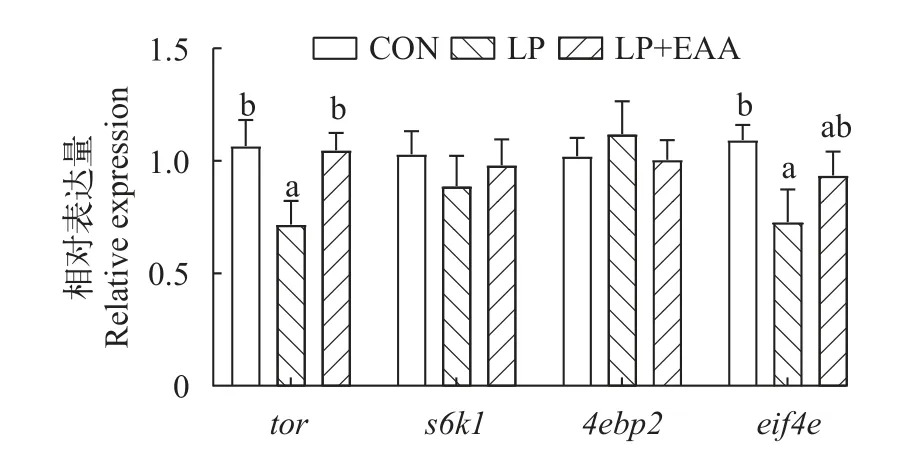
图3 低蛋白饲料补充必需氨基酸对异育银鲫背肌中tor、s6k1、4ebp2和eif4e相对表达量的影响Fig.3 Effects of low protein diets supplement with essential amino acid on the relative expression oftor,s6k1,4ebp2andeif4ein the dorsal muscle of gibel carp
3 讨论
3.1 低蛋白饲料补充必需氨基酸对异育银鲫生长性能的影响
蛋白质之所以成为水产动物饲料中最关键的营养成分,与其在鱼类生长性能和生理反应中的重要作用是分不开的[25,26]。已有许多研究证明,单纯地降低水产饲料的蛋白水平而不补充氨基酸会导致养殖鱼类正常生长发育受阻、饲料利用降低、鱼体蛋白沉积和免疫力下降等一系列负面效应[27—29]。本研究结果表明,降低异育银鲫“中科5号”幼鱼饲料7个百分点的蛋白水平(从35%到28%),向其补充平衡但不足量的必需氨基酸仍然无法满足鱼体生长需要,而补充至需求量的必需氨基酸则在一定程度上弥补了降低饲料蛋白可能造成的生长性能下降,这与大口黑鲈(Micropterus salmoides)[6]、布氏鲳鲹(Trachinotus blochii)[8]和虹鳟(Oncorhynchus mykiss)[30]中结果较为相似。对于形体指标来说,本研究结果显示添加必需氨基酸提高了异育银鲫脏体比,但肝体比无显著变化,这与Salem等[7]在斑点叉尾鮰(Ietalurus Punetaus)上的研究结果相似,但与陈乃松等[31]在大口黑鲈和谭芳芳等[32]在草鱼(Ctenopharyngodon idellus)中的大部分研究结果不一致,以往的研究大都表明在低氨基酸含量的饲料中补充晶体必需氨基酸能够降低肝体比和脏体比以改善鱼类形体指标。这可能是由于实验鱼食性的不同所导致的,斑点叉尾鮰和异育银鲫同属杂食性鱼类,对低蛋白饲料相较于肉食性和草食性鱼类可能更为耐受,从而肝脏未受到损伤。
3.2 低蛋白饲料补充必需氨基酸对异育银鲫血浆和肝脏生化指标的影响
鱼类血浆生化指标能够在一定程度上反映鱼体健康、生理和代谢状况[33]。在本研究中,补充必需氨基酸组的血浆总蛋白含量最高,这与布氏鲳鲹[8]中的结果相似,补充蛋氨酸和赖氨酸能够显著提高血浆中总蛋白的含量。血浆中的总蛋白是鱼类身体健康的标志,血浆蛋白越高在一定程度上表明鱼体免疫力越好[34]。谷草转氨酶和谷丙转氨酶是动物体肝脏中重要的氨基转移酶,它们可以促进谷氨酸与丙酮酸和谷氨酸与草酰乙酸之间的转氨作用,肝脏中转氨酶的活性可以在一定程度上反映蛋白质的代谢状况。但是当机体处于低营养状态时,肝脏会出现损伤这两种酶会大量释放到血浆中,血浆转氨酶水平可作为评价肝脏健康状况的指标[35,36]。在本研究中,肝脏中的谷草转氨酶活性在必需氨基酸添加组达到最高,表明必需氨基酸的添加能够在一定程度上提高转氨酶活性来促进氨基酸转氨作用,与刘梦梅等[37]对草鱼低蛋白饲料补充赖氨酸的结果相似;而血浆中的谷草转氨酶和谷丙转氨酶的活性各组间无显著差异,表明本实验的低蛋白饲料可能未对异育银鲫肝脏造成损伤,这与杨贺舒等[38]在杂交黄颡鱼(Pelteobagrus fulvidraco♀×Pelteobagrus vachelli♂)中的实验结果相一致,说明异育银鲫“中科5号”有着较好的低蛋白饲料耐受能力。
3.3 低蛋白饲料补充必需氨基酸对异育银鲫肠道消化吸收的影响
对于异育银鲫这种无胃鱼来说,肠道在消化吸收过程中是十分重要的器官,而消化吸收能力又与鱼体生长、发育和增重关系十分密切。鱼类消化吸收能力与消化酶活性相关,蛋白质利用效率也会受到消化酶活性影响。在本研究中,胰蛋白酶的活性在补充必需氨基酸组达到最高,这可能是由于晶体必需氨基酸100%的真实消化率[39],使得饲料中的结合蛋白也能够更有效地作为胰蛋白酶的底物,从而刺激胰蛋白酶活性的提高[40];脂肪酶活性在各处理组间无显著差异,这可能是由于饲料中恒定的脂肪含量[41];淀粉酶活性在低蛋白组和补充必需氨基酸组显著升高,这可能是由于低蛋白饲料中含有大量碳水化合物[40]。
蛋白质被消化酶水解后的产物是小肽和氨基酸,它们必须通过肠道上皮被转运到靶器官,这一过程则需要氨基酸转运体的参与[42,43]。pept1是一种关键的肠道转运蛋白,可以转运400多种二肽和8000多种三肽[44];cat2是一种阳离子氨基酸转运蛋白,b0,+at是一种碱性氨基酸转运蛋白,主要转运碱性必需氨基酸(赖氨酸、精氨酸和组氨酸)[45];asct2是一种中性氨基酸转运系统,能够转运大部分中性必需氨基酸(蛋氨酸、苏氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸和色氨酸)[46];b0at1是一种中性碱性氨基酸转运系统,赖氨酸主要就由其转运[47],它的作用是作为反转运体将亮氨酸交换为赖氨酸,因此赖氨酸的吸收与亮氨酸的外排耦合。在本研究中,必需氨基酸的添加上调了cat2、asct2和b0at1的表达量,一定程度上促进了氨基酸的吸收转运。
3.4 低蛋白饲料补充必需氨基酸对异育银鲫mTOR信号通路的影响
蛋白质在鱼体中沉积主要是通过刺激mTOR信号通路来实现的[48],mTOR信号通路在营养感知和能量调控方面起着重要作用[10,11],是鱼类[49]和哺乳动物[50]体内蛋白合成的关键代谢通路。在mTOR信号通路中,mTOR复合体1的下游有两个位点,分别为s6k1和4ebp2。在通常情况下,鱼类处于低营养状况(如: 低蛋白饲料)时,mTOR信号通路会被抑制[51],导致鱼体蛋白合成受阻。本研究发现,低蛋白饲料中添加必需氨基酸上调了肝脏tor和s6k1的mRNA水平,肝脏蛋白含量同样也显著上升,说明添加必需氨基酸可以通过刺激mTOR/S6K1信号通路从而促进肝脏蛋白合成;在异育银鲫背肌中,添加必需氨基酸显著上调了tor和eif4e的表达,但4ebp2和s6k1无显著变化,这可能是背肌中蛋白含量未显著上升的原因,与Zou等[10]在异育银鲫中的研究结果相似,饲料中添加亮氨酸提高了肝脏蛋白而非肌肉蛋白。
4 结论
在异育银鲫“中科5号”低蛋白饲料(蛋白水平由35%降至28%)中,只补充晶体必需氨基酸至必需氨基酸比例的平衡会造成鱼体生长性能下降,但向其补充晶体必需氨基酸至需求量后,能够通过促进鱼体消化、氨基酸转运及mTOR信号通路相关基因表达显著提高鱼体生长性能。因此,向低蛋白饲料中补充必需氨基酸至需求量被认为是可行的,可为优化异育银鲫饲料配方作理论参考。

