hsa_circ_0011946 靶向miR-767-3p 调控宫颈癌细胞增殖、迁移和侵袭
李文亚,谢 程,彭 莉 (. 长江大学附属仙桃市第一人民医院妇产科,湖北 仙桃 433000;. 长江大学附属仙桃市第一人民医院肾内科,湖北 仙桃 433000)
宫颈癌是女性最严重的恶性癌症之一,具有较高的浸润性和病死率[1]。因此,阐明宫颈癌进展的机制,寻找新的、有效的治疗靶点至关重要。环状RNA(circular RNA,circRNA)是具有共价闭合环的RNA 分子,其有竞争内源性RNA 活性,即circRNA 可与微小RNA(microRNA,miRNA)识别元件结合发挥miRNA 抑制作用,从而提高靶mRNA 的表达[2]。circRNA 表达改变与宫颈癌进展密切相关,再加上其发育阶段特异性表达模式,circRNA 被认为是宫颈癌治疗的理想靶点[3-4]。研究显示,hsa_circ_0011946在乳腺癌中的表达异常上调,敲减hsa_circ_0011946可明显降低乳腺癌细胞迁移和侵袭能力[5]。miRNA是重要的转录后调控因子,其表达失调参与肿瘤细胞多个恶性进程[6-7]。miR-767-3p可诱导胶质瘤细胞甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)mRNA降解,增强其对替莫唑胺的敏感性[8]。肺腺癌中miR-767-3p 表达下调,过表达miR-767-3p 可抑制肺腺癌细胞的增殖、迁移和侵袭[9]。靶基因预测显示,miR-767-3p是hsa_circ_0011946的潜在靶点。但hsa_circ_0011946、miR-767-3p在宫颈癌中的表达和功能,以及hsa_circ_0011946 是否通过靶向miR-767-3p 调控宫颈癌进展目前尚不清楚。因此,本研究旨在揭示hsa_circ_0011946靶向miR-767-3p在宫颈癌进展中的作用,以期为宫颈癌的治疗提供有效靶点。
1 材料与方法
1.1 材料
1.1.1 组织来源 收集2017 年5 月至2019 年5 月我院收治的43 例宫颈癌患者的癌组织和癌旁正常组织。患者年龄45~73 岁,中位年龄57 岁,均未接受放疗、化疗、免疫治疗等抗肿瘤治疗。组织标本离体后保存在-80 ℃冰箱备用。本研究经我院医学伦理委员会审核批准(XTYYKY2017006),患者及家属均对本研究知情同意。
1.1.2 细胞和试剂 人宫颈上皮永生化细胞H8(批号:QS-H283)购自旗赛生物科技(武汉)有限公司;宫颈癌SiHa 细胞(批号:CL-0210)、HeLa 细胞(批号:CL-0101)、Caski 细胞(批号:CL-0048)及MEM 培养基(批号:PM150410P)、青链霉素双抗(批号:PB180120)、胎牛血清(批号:164210)购自武汉普诺赛生命科技公司;PrimeScript 逆转录试剂盒(批号:RR037A)、SYBR Premix Ex Taq 试剂盒(批号:DRR041A)购自大连TaKaRa 公司;miScript 逆转录试剂盒(批号:218161)、miScript SYBR Green PCR 试剂盒(批号:218073)购自德国Qiagen 公司;si-hsa_circ_0011946、si-NC、miR-767-3p、pcDNA、pcDNA-hsa_circ_0011946、anti-miR-NC、anti-miR-767-3p、miR-NC、重组荧光素酶报告质粒购自上海生工生物公司;CCK-8、NP-40 缓冲液购自上海碧云天生物公司;MMP-2 兔多抗(批号:AF0234)、MMP-9 兔多抗(批号:AF5234)、β-actin兔单抗(批号:AF5003)、辣根过氧化物酶标记山羊抗兔IgG(批号:A0208)购自上海碧云天生物公司。
1.2 RT-qPCR检测hsa_circ_0011946、miR-767-3p表达
使用TRIzol 试剂从H8 细胞、SiHa 细胞、HeLa 细胞、Caski 细胞及癌组织和癌旁正常组织中提取总RNA,分别用PrimeScript 逆转录试剂盒、miScript 逆转录试剂盒合成circRNA、miRNA 的cDNA,分别用SYBR Premix Ex Taq 试剂盒、miScript SYBR Green PCR试剂盒对上述cDNA 进行RT-qPCR。PCR 反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环40 次。U6 为miR-767-3p 的内参,β-actin 为hsa_circ_0011946 的内参,采用2-ΔΔCt法分析hsa_circ_0011946、miR-767-3p的表达水平。miR-767-3p上游引物5'-TCCATTTGTTTTGATGATGGACT-3',下游引物5'-CTCAACTGGTGTCGTGGAGTC-3';U6 上游引物5'-CTCGCTTCGGCAGCACAT-3',下游引物5'-AAC GCTTCACGAATTTGCGT-3';hsa_circ_0011946 上游引物5'-GCTGGTGTTCCTTGACTGGA-3',下游引物5'-C ACTGTAGCAAACCAGCATTTCT-3';β-actin 上游引物5'-GTCCACCGCAAATGCTTCTA-3',下游引物5'-TGC TGTCACCTTCACCGTTC-3'。
1.3 细胞培养和分组
SiHa 细胞接种含1%青链霉素双抗、10%胎牛血清的MEM 培养基,并在37 ℃、含5%CO2的培养箱中孵育。用胰蛋白酶消化80%融合的SiHa细胞,1∶3传代。取第3 代对数期SiHa 细胞以2×104个/孔接种至96 孔板,用 Lipofectamine 2000 将 si-NC、si-hsa_circ_0011946、 miR-NC、 miR-767-3p、 pcDNA、 pcDNAhsa_circ_0011946、anti-miR-NC+si-hsa_circ_0011946、anti-miR-767-3p+si-hsa_circ_0011946 分别转染50%融合的SiHa 细胞,分别作为si-NC 组、si-hsa_circ_0011946 组、miR-NC 组、miR-767-3p 组、pcDNA 组、pcDNA-hsa_circ_0011946 组、anti-miR-NC+si-hsa_circ_0011946 组、anti-miR-767-3p+si-hsa_circ_0011946 组。未转染的SiHa细胞作为NC组。转染48 h后,收集SiHa细胞,RT-qPCR 检测hsa_circ_0011946、miR-767-3p 的表达以验证转染效果,随后进行后续实验。
1.4 CCK-8法检测细胞活力
将转染48 h 后的SiHa 细胞以5×103个/孔接种至96孔板,细胞贴壁后每孔添加10 µL CCK-8试剂,37 ℃孵育2 h。酶标仪在450 nm 波长处测定吸光度(absorbance,A)值以表示细胞活力。
1.5 平板克隆形成实验检测细胞克隆数
将转染48 h 后的SiHa 细胞以5×102个/孔接种至6 孔板,培养约12 d 至出现肉眼可见细胞克隆。4%多聚甲醛固定1 h,然后用0.1%结晶紫溶液染色。显微镜下计数大于50个细胞的克隆数。
1.6 Transwell法检测细胞迁移和侵袭数
将转染48 h 后的SiHa 细胞重悬于无血清培养基中,调整细胞密度为1×106/mL。Transwell 上室添加100 µL 细胞悬液,下室添加600 µL 完全培养基,然后在培养箱中孵育24 h。用棉签除去膜上表面的细胞,膜下表面的细胞为迁移细胞。用4%多聚甲醛固定迁移细胞,0.1%结晶紫溶液染色后,显微镜下对迁移细胞进行拍照。选取5个随机视野细胞数的均值表示各组细胞迁移数。侵袭数测定时先用0.5 mg/mL 的基质胶包被Transwell上室膜,其余步骤同迁移测定。
1.7 Western blot检测MMP-2、MMP-9蛋白表达
用NP-40 缓冲液提取蛋白并测定浓度。将50 µg蛋白样品在100 V 下用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,并转移到硝酸纤维素膜(200 mA,80 min)。膜封闭后,除去封闭液,添加MMP-2(1∶1 000)、MMP-9(1∶1 500)、β-actin(1∶1 500)一抗,4 ℃摇床孵育2 h,然后与辣根过氧化物酶标记二抗(山羊抗兔IgG,1∶2 000)在37 ℃下孵育1 h。用化学发光试剂盒进行显色反应。以Image J 软件测得的目的条带和β-actin灰度值的比值表示蛋白表达水平。
1.8 双荧光素酶报告基因实验
circular RNA interactome 预测miR-767-3p 与hsa_circ_0011946 的结合位点。将含miR-767-3p 结合位点的hsa_circ_0011946 野生序列或不含预测位点的突变序列分别克隆到pmirGLO 质粒,构建WThsa_circ_0011946 和MUT-hsa_circ_0011946 重组荧光素酶报告质粒。用Lipofectamine 2000将WT-hsa_circ_0011946 或MUT-hsa_circ_0011946 分别与miR-767-3p mimics、miR-NC 共转染至SiHa 细胞,用双荧光素酶报告基因系统测定转染48 h后的相对荧光素酶活性。
1.9 统计学方法
采用SPSS 22.0 软件进行统计学分析,呈正态分布的数据以均数±标准差()表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌组织及癌旁正常组织中hsa_circ_0011946和miR-767-3p表达
宫颈癌组织中hsa_circ_0011946 表达水平显著高于癌旁正常组织(P<0.05),miR-767-3p 表达水平显著低于癌旁正常组织(P<0.05),见图1。

图1 宫颈癌组织及癌旁正常组织中hsa_circ_0011946 和miR-767-3p表达
2.2 不同细胞系中hsa_circ_0011946和miR-767-3p的表达
与H8 细胞比较,宫颈癌细胞系(SiHa、HeLa、Caski)中hsa_circ_0011946 表达水平显著升高(P<0.05),miR-767-3p 表达水平显著降低(P<0.05),见图2。选择表达差异较大的SiHa 细胞进行后续实验。

图2 宫颈癌细胞系中hsa_circ_0011946和miR-767-3p的表达情况
2.3 干扰hsa_circ_0011946 表达抑制宫颈癌SiHa 细胞增殖、迁移和侵袭
与NC 组比较,si-hsa_circ_0011946 组SiHa 细胞hsa_circ_0011946 表达水平、A 值、克隆数、迁移数、侵袭数及MMP-2、MMP-9蛋白表达水平显著降低/减少(P<0.05),见图3、表1。
表1 干扰hsa_circ_0011946表达抑制宫颈癌SiHa细胞增殖、迁移和侵袭()
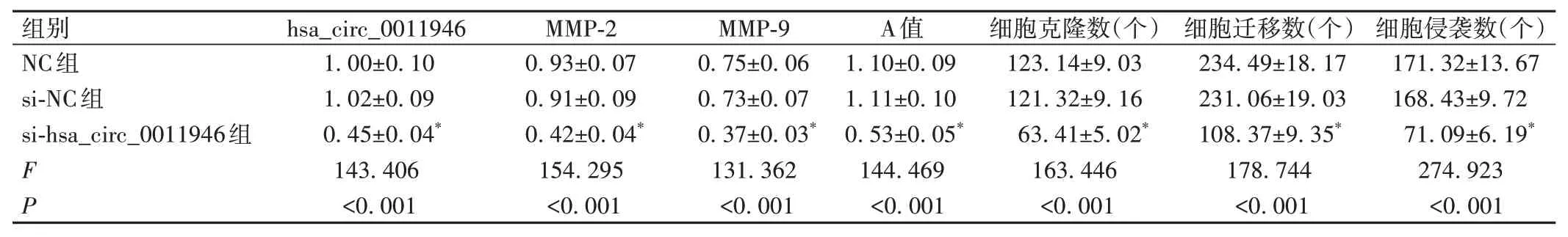
表1 干扰hsa_circ_0011946表达抑制宫颈癌SiHa细胞增殖、迁移和侵袭()
*:与NC组比较,P<0.05
?

图3 干扰hsa_circ_0011946表达对宫颈癌SiHa细胞克隆及蛋白表达的影响
2.4 过表达miR-767-3p 抑制宫颈癌SiHa 细胞增殖、迁移和侵袭
与miR-NC 组比较,miR-767-3p 组SiHa 细胞miR-767-3p 表达水平显著升高(P<0.05),细胞A 值、克隆数、迁移数、侵袭数及MMP-2、MMP-9 蛋白表达水平显著降低/减少(P<0.05),见图4、表2。
表2 过表达miR-767-3p抑制SiHa宫颈癌细胞增殖、迁移和侵袭()

表2 过表达miR-767-3p抑制SiHa宫颈癌细胞增殖、迁移和侵袭()
?
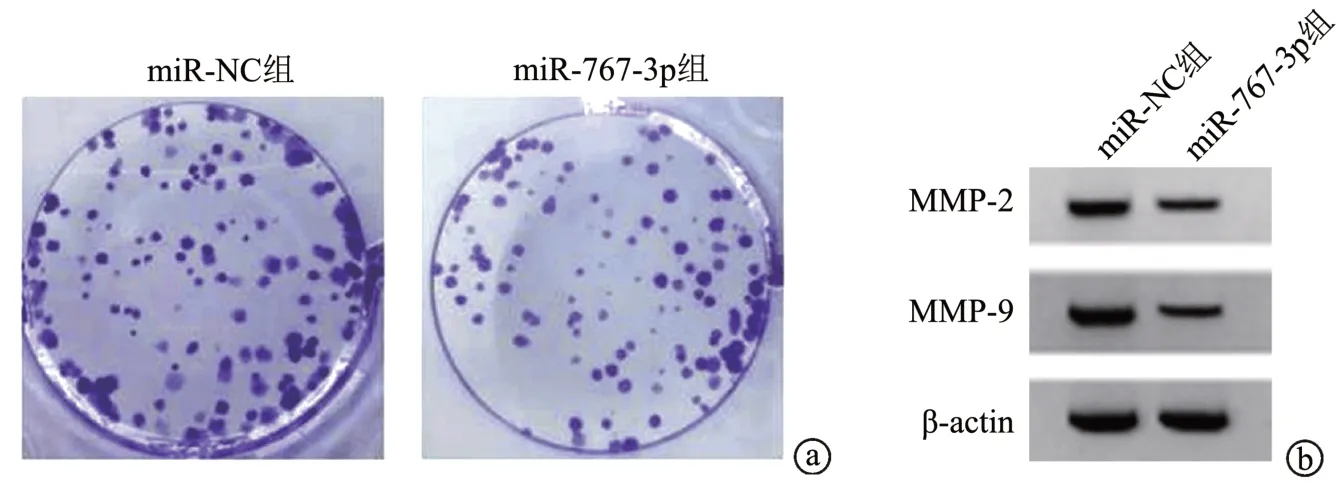
图4 过表达miR-767-3p对宫颈癌SiHa细胞克隆及蛋白表达的影响
2.5 hsa_circ_0011946靶向调控miR-767-3p的表达
circular RNA interactome 预测到miR-767-3p 和hsa_circ_0011946 存在特异性结合序列(图5)。与miR-NC 组比较,miR-767-3p 组WT-hsa_circ_0011946的SiHa 细胞相对荧光素酶活性降低(P<0.05);而MUT-hsa_circ_0011946 的SiHa 细胞相对荧光素酶活性差异无统计学意义(P<0.05),见图6。pcDNAhsa_circ_0011946 组SiHa 细胞hsa_circ_0011946 表达水平显著高于pcDNA 组(P<0.05),miR-767-3p表达水平显著低于pcDNA 组(P<0.05);si-hsa_circ_0011946组SiHa 细胞hsa_circ_0011946 表达水平显著低于si-NC 组(P<0.05),miR-767-3p 表达水平显著高于si-NC组(P<0.05),见图7。

图5 miR-767-3p与hsa_circ_0011946的结合位点
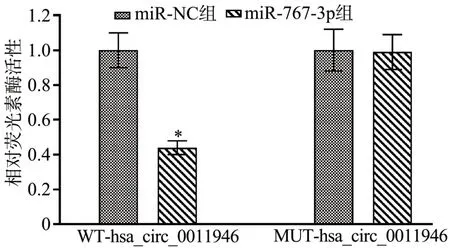
图6 双荧光素酶报告基因检测实验
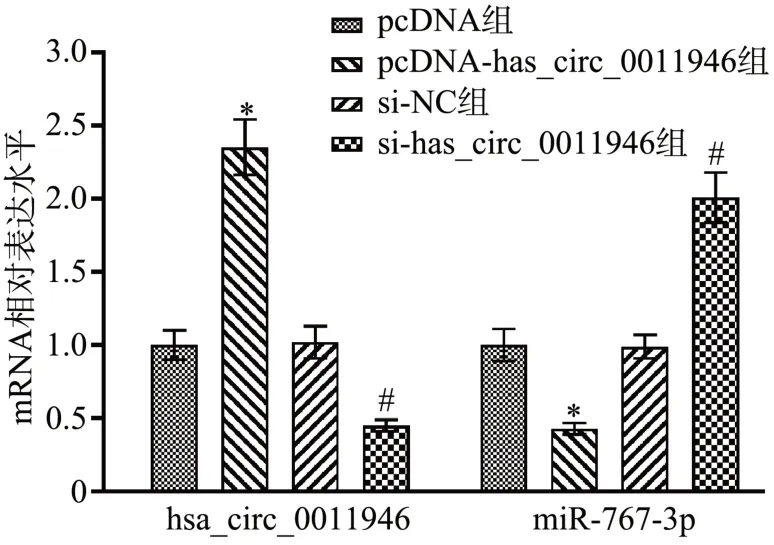
图7 RT-qPCR检测hsa_circ_0011946、miR-767-3p的表达
2.6 抑制miR-767-3p表达逆转干扰hsa_circ_0011946表达对SiHa细胞增殖、迁移和侵袭的影响
与anti-miR-NC+si-hsa_circ_0011946 组比较,anti-miR-767-3p+si-hsa_circ_0011946 组SiHa 细胞miR-767-3p 表达水平显著降低(P<0.05),细胞A 值、克隆数、迁移数、侵袭数及MMP-2、MMP-9 蛋白表达水平显著升高/增加(P<0.05),见图8、表3。
表3 抑制miR-767-3p表达逆转干扰hsa_circ_0011946表达对SiHa细胞增殖、迁移和侵袭的影响()
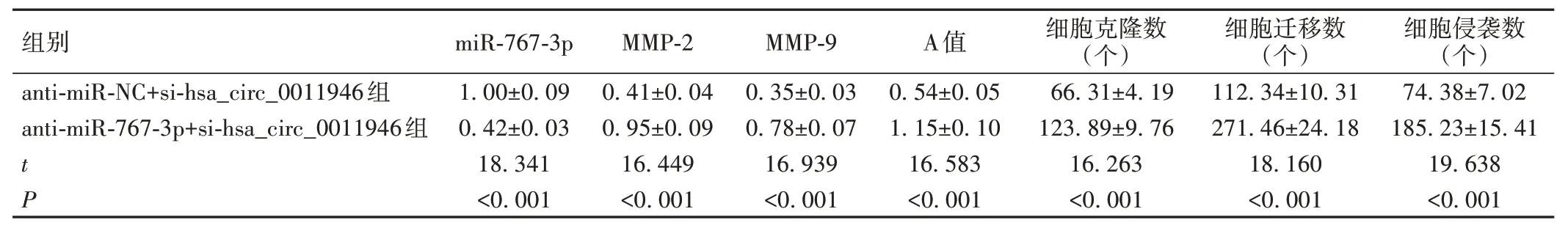
表3 抑制miR-767-3p表达逆转干扰hsa_circ_0011946表达对SiHa细胞增殖、迁移和侵袭的影响()
?

图8 抑制miR-767-3p表达逆转干扰hsa_circ_0011946对SiHa细胞克隆及蛋白表达的影响
3 讨论
circRNA 已被证实参与调控多种生物过程,在宫颈癌发生发展中发挥关键作用。如宫颈癌临床标本中circ_0000388 表达上调,且与FIGO 分期、淋巴结转移和浸润深度相关,circ_0000388 高表达可显著增强宫颈癌细胞的增殖和转移能力[10]。circRNA8924 通过抑制miR-518d-5p/519-5p 活性促进宫颈癌细胞恶性生物学行为[11]。过表达circEYA1 可降低宫颈癌细胞活力,促进细胞凋亡,抑制异种移植瘤生长[12]。circMTO1通过调控miR-6893 促进宫颈癌的发生和化疗耐药性[13]。本研究发现,hsa_circ_0011946在宫颈癌组织及细胞中表达显著升高,表明hsa_circ_0011946 可能参与宫颈癌的进展。hsa_circ_0011946 已被证实参与肝细胞癌的进展,其表达与肝细胞癌的淋巴转移相关,敲除hsa_circ_0011946 可抑制肝细胞癌细胞的迁移和侵袭,提示hsa_circ_0011946 在肝细胞癌中发挥致癌作用[14]。本研究结果显示,干扰hsa_circ_0011946表达可抑制SiHa 细胞增殖、迁移和侵袭,这与既往研究[5,14]报道的hsa_circ_0011946 在其他肿瘤细胞中的作用相吻合。MMP-2、MMP-9 是降解基底膜、细胞外基质的主要蛋白酶,为细胞迁移和侵袭提供有利条件[15-16]。研究证实,沉默circ-0000212 可通过抑制MMP-2 和MMP-9 蛋白表达降低宫颈癌细胞的侵袭和迁移能力[17]。本研究干扰hsa_circ_0011946 表达后,MMP-2和MMP-9 蛋白表达显著降低,进一步证实干扰hsa_circ_0011946 表达对宫颈癌细胞迁移和侵袭的抑制作用。
研究表明,circRNA 在宫颈癌中的功能与调控miRNA 表达有关,如circ_0000515 可通过靶向miR-326 抑制宫颈癌细胞凋亡和自噬,诱导细胞增殖和侵袭[18]。本研究中双荧光素酶检测和RT-qPCR 证实,miR-767-3p 是hsa_circ_0011946 的特异性靶点。miR-767-3p 已被报道在非小细胞肺癌中表达下调,敲减circ_0018818通过上调miR-767-3p表达抑制非小细胞肺癌细胞的增殖和侵袭,并阻碍上皮-间质转化过程[19]。此外,miR-767-3p 还介导敲减hsa_circ_0000673对肝癌细胞恶性行为的抑制作用[20]。本研究发现,宫颈癌组织和细胞中miR-767-3p 表达水平显著下降,过表达miR-767-3p 可下调MMP-2、MMP-9 蛋白表达,抑制SiHa 细胞增殖、迁移和侵袭。hsa_circ_0011946 对miR-767-3p 具有负调控作用,且过表达miR-767-3p 与干扰hsa_circ_0000673 的抗肿瘤作用一致,故本研究推测宫颈癌中可能存在hsa_circ_0011946/miR-767-3p调控途径。为进一步证实干扰hsa_circ_0011946 的作用依赖于miR-767-3p 表达上调,本研究将si-hsa_circ_0011946 和anti-miR-767-3p 共转染至SiHa 细胞,结果显示,抑制miR-767-3p 表达可显著削弱干扰hsa_circ_0011946对SiHa细胞的抗增殖、抗迁移和抗侵袭作用,进一步证实了hsa_circ_0011946 靶向miR-767-3p 促进SiHa细胞的恶性生物学行为。
综上,宫颈癌中hsa_circ_0011946 呈高表达,miR-767-3p 呈低表达。干扰hsa_circ_0011946 通过靶向上调miR-767-3p 抑制宫颈癌细胞增殖、迁移和侵袭。因此,hsa_circ_0011946/miR-767-3p 途径可能是抑制宫颈癌进展的潜在有效靶点。