连接蛋白2和FGF23在房颤介导心肌病兔心房组织中的表达
郭 爽,李树仁,赵 美,郝 潇
1.河北医科大学 研究生学院,河北 石家庄 050011;2.河北省人民医院 心内科,河北 石家庄 050057
房颤介导心肌病(atrial fibrillation mediated cardiomyopathy,AMC)指由于阵发或持续性心房颤动(atrial fibrillation,AF)引起的心房或心室的扩张、收缩与舒张功能受损,最终发展为心力衰竭(heart failure,HF),当恢复窦性心律或心室率得到严格控制时,心脏扩大与心衰能够迅速、甚至完全逆转[1]。临床中AMC的发病率并不低,早期诊断干预可以明显改善患者预后。AMC病理过程中发生不同程度的的电重构和结构重构[2]。
连接蛋白2(junctophilin2,JP2)是介导细胞膜上的L型钙通道(L-type calcium channel,LTCC)与内质网(sarcoplasmic reticulum,SR)上的兰尼碱受体(ryanodine receptor2,RyR2)的相互作用的一种连接蛋白,使LTCC与SR保持稳定的距离,促进兴奋-收缩耦联的发生[3]。JP2在不同病因的心肌病(如扩张性心肌病,缺血性心肌病)中均表达下降[4-5],但目前还没有研究其在心律失常性心肌病中的表达情况。成纤维生长因子23(fibroblast growth factor 23,FGF23)则在AF和HF的纤维化过程中发挥着重要作用,FGF23通过增加活性氧并随后激活STAT3和SMAD3信号转导,诱导房颤患者的心房纤维化[6]。

A.before pacing; B.after establishment of AMC model
因此通过构建AMC实验模型,探讨电重构蛋白—JP2与结构重构蛋白—FGF23表达水平的变化,探究AMC的机制,可为临床AMC的早期诊断与治疗提供方向。
1 材料与方法
1.1 材料
1.1.1 动物:普通级雄性新西兰大白兔(河北省望都县彤辉养殖有限公司),体质量2.5~3 kg,许可证号[SCXK(冀)2016-002]。实验动物均于河北省人民医院临床医学研究中心动物室单笼饲养,室温(17±3)℃,摄水摄食不限。本研究经过河北省人民医院动物伦理委员会审查(2023科研伦审第40号)。
1.1.2 主要试剂:水合氯醛和青霉素钠(华北制药有限公司),山羊抗兔二抗、山羊抗鼠二抗、FGF23 抗体和JP2抗体(Bioss)、兔FGF23试剂盒和兔连接蛋白2 ELISA试剂盒(江苏晶美生物技术有限公司)、总RNA提取试剂盒(天根生化科技有限公司,DP439)。
1.2 方法
1.2.1 兔的分组及处理:将兔分为对照组(control)和房颤介导心肌病模型组,4周后射血分数下降≤10%者纳入AF组,射血分数下降>10%者纳入AMC组。通过左心房电极快速起搏法构建房颤介导心肌病动物模型,起搏器起搏模式为AOO,起搏频率600 beats/min,刺激时程(0.25±0.01)ms,输出电压≥5 V,每日描记标准肢体导联心电图以确保起搏器正常工作,当记录到房颤心电图,持续时间≥1 min,即认为房颤建模成功。对照组只植入起搏器但不起搏。
1.2.2 超声心动图检查:分别于手术前后对各组动物行超声心动图检查,测定左心房内径(left atrial diameter,LAD),左室射血分数(left ventricular ejection fraction,LVEF),左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end systolic diameter,LVESD)、主动脉、室间隔、左室后壁、右心房内径(right atrial diameter,RAD)、右心室内径(right ventricular diameter,RVD)等超声指标。以上各测量值均取连续3次测量的平均值(图1)。
1.2.3 RT-qPCR检测各组目的基因的mRNA转录:用石蜡包埋组织切片总RNA提取试剂进行样本RNA提取,反转录合成cDNA,以cDNA为模板进行PCR扩增,扩增条件:95 ℃ 30 s 预变性,95 ℃ 5 s变性,60 ℃ 40 s退火延伸,40个循环,目的基因引物序列:FGF23上游引物5′-CAGAGCCTATCCCA ATGCCTC-3′,FGF23下游引物5′-GGCACTGTAGAT GGTCTGATGG-3′,JP2上游引物5′-ACTCTGGCTC CTGGAACTTTG-3′,JP2下游引物5′-GCGCCCCTTG GTCTCTATG-3′。实验重复3次,根据Ct值,按照2-△△Ct相对定量计算公式计算出各样品的目的基因相对定量结果。
1.2.4 Western Blot检测心肌组织蛋白表达:使用RIPA细胞裂解液提取蛋白,采用BCA法测定蛋白浓度,根据上样量进行浓度调平,100 ℃煮沸10 min进行蛋白变性,将蛋白上样并进行SDS-PAGE凝胶电泳,转移至PVDF膜上进行转膜,TBST洗涤1次5 min,5%脱脂奶粉室温封闭2 h,在脱色摇床上孵育一抗,一抗孵育条件:FGF23抗体(1∶1 000,4 ℃过夜),JP2抗体(1∶1 000,4 ℃过夜),ACTB抗体(1∶5 000,4 ℃过夜)。TBST洗膜3次,各10 min,室温孵育二抗1 h,TBST洗膜3 次,各45 min,ECL法显影成像,用凝胶图象处理系统分析目标条带的吸光度值。
1.2.5 ELISA检测血清JP2、FGF23水平:从各组兔耳缘静脉取血3~4 mL,离心后取血清冻存于-80 ℃冰箱中保存,根据兔FGF23 ELISA试剂盒和兔JP2 ELISA试剂盒的操作步骤检测血清JP2、FGF23水平。
1.3 统计学分析

2 结果
2.1 超声心动图比较
与对照组相比,AMC 组LAD、RAD、RVD增加,LVEF降低,与AF组相比,AMC组LVEF降低,主动脉和RVD增加(表1)。
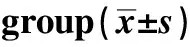
表1 各组超声心动图指标Table 1 Echocardiographic indexes in each
2.2 各组JP2、FGF23基因转录变化
与对照组相比,AF组FGF23和JP2目的基因的mRNA转录增加(P<0.001),AMC组JP2 mRNA转录降低(P<0.001)。与AF组相比,AMC组FGF23和JP2目的基因的mRNA转录降低(图2)。

*P<0.05 compared with control group;# P<0.05 compared with AF group.
2.3 各组JP2、FGF23蛋白表达变化
与对照组相比,AF组FGF23(P<0.001)和JP2(P<0.01)的表达明显增加,AMC组JP2表达明显降低(P<0.001)。与AF组相比,AMC组FGF23和JP2表达下降(图3,4)。

图3 Western blot检测表达心肌组织蛋白Fig 3 Western blot assay of protein expression in myocardial tissues

*P<0.05 compared with control group;# P<0.05 compared with AF group.
2.4 各组血浆JP2、FGF23水平变化
与对照组相比,AF组FGF23和JP2血浆浓度升高,AMC组FGF23水平升高。与AF组相比,AMC组FGF23和JP2血浆浓度偏低(表2)。
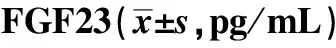
表2 血浆JP2、FGF23浓度Table 2 Serum concentration of JP2 and
3 讨论
房颤介导心肌病(AMC)是一种继发于房颤的在当今的临床实践中其发病率可能被低估,了解AMC的发病机制十分重要。
JP2是一个由696个氨基酸组成的蛋白质,其N末端作用于心肌细胞质膜,C端嵌入内质网膜,使两者之间保持一定的距离,JP2对维持心肌正常的兴奋-收缩功能起着至关重要的作用[7]。JP2不仅可以维持LTCC与RyR2受体的紧密连接,还使处于关闭状态的RyR2受体更加稳定。JP2基因敲除小心肌病,最初为特发性AF患者,因AF长期控制不佳而继发性引起心房、心室的扩大,最终发展为房颤介导心肌病,诊断时需具备两个条件:1)排除患者有引起心室扩大、心衰的其他病因;2)窦律恢复并维持时(包括心室率得到严格控制),心脏扩大与心衰得到完全性或几乎完全性逆转[1]。因此对于AMC的诊断是“回顾性”的,鼠表现为明显的膜连接复合体(junction membrane complex,JMC)紊乱,更易发生HF[8-9]。本文研究了JP2在AMC中的表达变化,发现JP2在AMC中的表达下降。然而,在房颤组中,JP2表达增加。有研究表示JP2表达下降会导致内质网钙泄漏,心肌细胞中自发Ca2+火花频率增加[10]。但起搏刺激JP2过度表达的心肌细胞,结果显示钙电流峰值和钙泄漏频率更高[11]。因此,JP2的高表达和低表达都会破坏细胞内的钙平衡进而导致心律失常。在代偿期的心肌病动物模型中,心肌细胞T小管的体积和表面积都会增加。相反,在心肌肥厚或心力衰竭模型中,其体积和表面积则会减少[12]。由于JP2与T小管共同定位,推测JP2在快速起搏下代偿性增加,最终进入失代偿期,此时JP2 表达减少,心肌收缩力下降,HF发生。此外,在一个JP2过度表达模型中发现,RyR2簇的大小增加,但兴奋性趋于稳定[13]。因此,JP2与RyR2的比例可能比JP2本身的表达对疾病的发展更有价值。
FGF23在AF的纤维化过程中发挥着重要作用[14],本文同样发现AF组FGF23表达明显增加,当发生射血分数下降时,FGF23的表达相对减少。有研究表示FGF23与左室功能独立相关[15]。另外FGF23可能受心律失常的影响而有不同的作用机制,成纤维细胞生长因子可以直接作用于心肌Na+通道、Ca2+通道[16],房颤时心肌细胞发生钙重构,离子通道改变,进而影响FGF23发挥作用,期待未来大规模的基础及临床研究进行探索。
本研究的一个局限是没有评估JP2与RyR2的比值,这使无法对膜连接复合体做出全面的说明。动物试验样本量较小,可能导致统计分析不充分或有偏差。此外,由于时间限制,动物试验产生的短期效应可能不同于长期效应,因此在解释结果是否适用于临床时必须谨慎。
综上所述,在AMC动物模型中,FGF23表达增加,JP2表达下降。这些发现可能为开发针对JP2的抗房颤药物开辟新的途径,同时为AMC的发病机制与诊断研究提供方向。

