FHL2通过NF-κB信号通路调节THP-1巨噬细胞泡沫化
陈卫卫,廖 煌,史振鸿,罗 颖
海南医学院第二附属医院 心血管内科,海南 海口 570216
动脉粥样硬化(atherosclerosis, AS)主要表现为动脉壁纤维的脂肪病变,病程中伴随慢性炎性反应,常导致心梗、中风等心血管疾病的发生,致死率、致残率极高,是急需重视的疾病之一[1]。在大、中动脉内皮下内膜层血管中,阻塞斑块的慢性积累会导致严重狭窄,血流受限,最终致组织缺氧[2]。包含巨噬细胞在内的多种细胞促进了AS的发生,其中巨噬细胞在动脉壁内积聚是导致AS的必要条件[3],是参与AS疾病进程的主要炎性细胞。疾病初始期由单核细胞向M1型分化,发挥清除胆固醇的同时,内化脂蛋白颗粒,发生泡沫化,伴随炎性细胞因子、活性氧(reactive oxygen species,ROS)等的分泌[4],进一步促进AS的发展。巨噬细胞泡沫化是AS的关键病理特征,对AS疾病进程具有一定程度的影响,因此明确其泡沫化的分子机制,对AS的治疗研究具有重要意义。
核因子κB(nuclear factor kappa-B, NF-κB)被激活后,移位至巨噬细胞核内,参与下游多种脂质代谢靶基因的调控,进一步影响巨噬细胞的脂质代谢。4个半LIM结构域蛋白(four and a half LIM domains protein 2,FHL2)参与多条信号通路,调节AS、心律失常、心肌肥厚等疾病的发展,并与细胞的增殖、凋亡有关,能够与TNF受体相关因子2(TRAF2)、TRAF4和TRAF6相互作用,这些因子是激活NF-κB信号通路的关键介质[5]。推测FHL2在动脉粥样硬化中具有重要作用,但目前关于FHL2调节AS疾病发展的研究较少,因此有必要对此进行探讨。本研究使用氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)诱导的巨噬细胞泡沫化模型,利用质粒上调或下调FHL2在细胞内的表达水平,研究FHL2影响巨噬细胞泡沫化的作用机制。
1 材料与方法
1.1 试剂与细胞
RPMI 1640培养基(Gibco公司),胎牛血清(fetal bovine serum,FBS)和PBS(Hyclone公司),ox-LDL(Solarbio公司),IL-6 ELISA试剂盒、IL-1β ELISA试剂盒和TNF-α ELISA试剂盒(BD公司),BAY 11-7082、油红O染色试剂盒和PMA(Beyotime公司),兔抗phospho-IκBα单克隆抗体、兔抗IκBα单克隆抗体、兔抗phospho-p65单克隆抗体和兔抗p65单克隆抗体(Cell Signaling Technology公司),抗FHL2单克隆抗体(Abcam公司),THP-1(人单核细胞)(中国科学院细胞库)。本研究所用质粒及siRNA由金斯瑞生物科技有限公司合成。
1.2 方法
1.2.1 细胞的分组及处理:将THP-1细胞培养至汇合度达70%~80%后,将细胞传代培养用于后续实验。使用含100 ng/mL PMA的培养基刺激THP-1细胞,将其诱导为THP-1巨噬细胞。使用Lipo 2000,按说明书要求操作,将构建好的FHL2过表达质粒、FLH2小干扰RNA(si-FLH2)及相应的对照质粒和siRNA转染至细胞中,之后换含50 μg/mL ox-LDL的培养基孵育细胞48 h,使其内化脂质转化为THP-1泡沫细胞。将细胞分为对照组(control组);ox-LDL组;FHL2+ox-LDL组;si-FHL2+ox-LDL组。为明确FHL2缓解细胞泡沫化的机制增加BAY 11-7082+FHL2+ox-LDL组。
1.2.2 转染基因表达的验证:细胞转染24 h后,提取细胞总蛋白,确定浓度后,加样,利用SDS-PAGE胶分离,转膜,5%脱脂奶粉封闭,洗3次,加入1∶1 000稀释的一抗(FHL2)孵育过夜,洗3次,加入二抗,ECL显色液显色曝光,检测FHL2的表达情况。
1.2.3 ELISA检测细胞因子的分泌:收集各处理组细胞的培养上清,按要求处理样品后,按照说明书所述操作,读取A450数值。
1.2.4 油红O染色检测巨噬细胞泡沫化程度:取各组细胞,吸去细胞培养基,取适量染色洗涤液,覆盖细胞20 s,弃掉洗涤液,加入油红O染色工作液,染色15~20 min,洗涤液洗30 s,弃掉,加入PBS静置30 s,弃掉后,在加入300 μL PBS,显微镜下观察细胞状态。
1.2.5 Western blot检测NF-κB的活化:本部分所用一抗为:p-IκBα、IκBα、p-p65、p65。
1.3 统计学分析
2 结果
2.1 成功诱导THP-1巨噬细胞
PMA刺激48 h后细胞呈不规则长梭形,有伪足且贴壁,形态特征与巨噬细胞吻合(图1)。因此,成功诱导THP-1巨噬细胞用于后续实验。

图1 PMA诱导前后THP-1细胞形态Fig 1 Morphology of THP-1 cells after PMA treatment(n=3)
2.2 FHL2敲低及过表达细胞株构建
将FHL2质粒、si-FHL2转染至诱导成功的细胞中,si-FHL2组FHL2蛋白表达较对照组明显下降,FHL2组中上调(P<0.05)(图2)。成功构建了敲低表达或过表达FHL2的细胞,可用于后续研究。
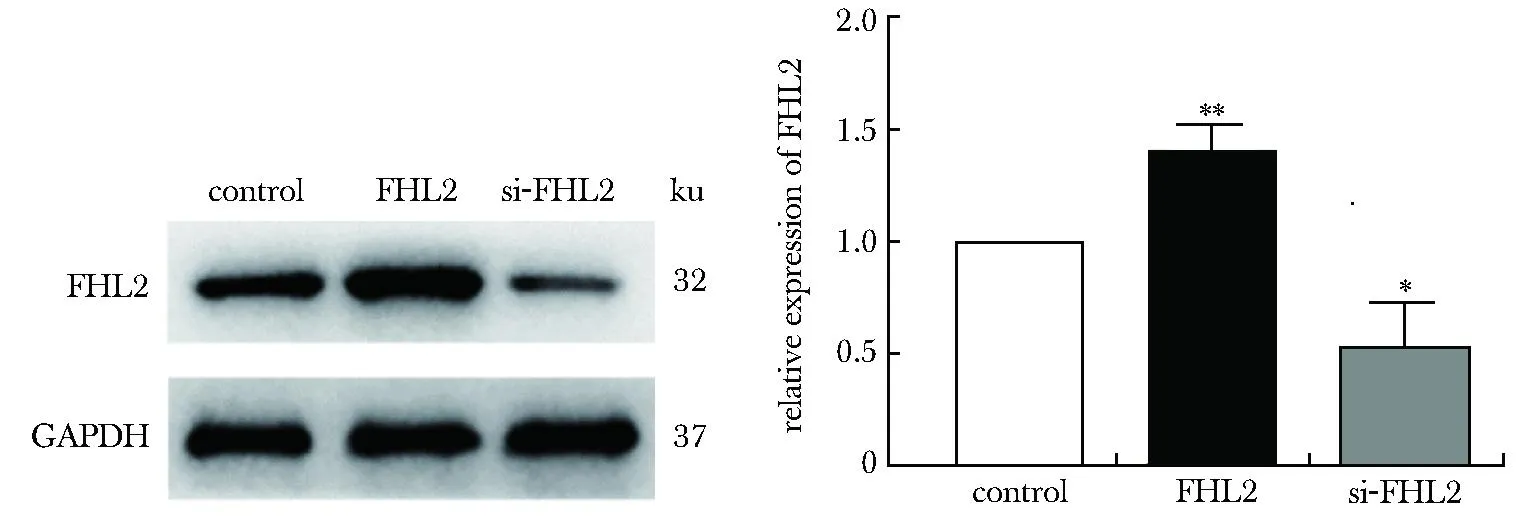
*P<0.05,**P<0.01 compared with control.
2.3 敲低FLH2能降低IL-6、IL-1β、TNF-α分泌水平
si-FHL2+ox-LDL组细胞IL-6、IL-1β、TNF-α的分泌水平较ox-LDL组明显降低,而ox-LDL组、FHL2+ox-LDL组细胞因子分泌水平与control组相比明显上调(P<0.01),其中FHL2+ox-LDL组上调更为显著(P<0.001)(图3)。

*P<0.01, **P<0.001 compared with control group; # P<0.01, # # P<0.001 compared with ox-LDL group.
2.4 FLH2表达下调缓解细胞泡沫化
与对照组相比,ox-LDL组细胞内脂滴较大且数量较多,FHL2+ox-LDL组泡沫化更为明显,而si-FHL2+ox-LDL组细胞ox-LDL组、FHL2组相比,脂滴明显减小、减少,泡沫化程度较轻(图4)。
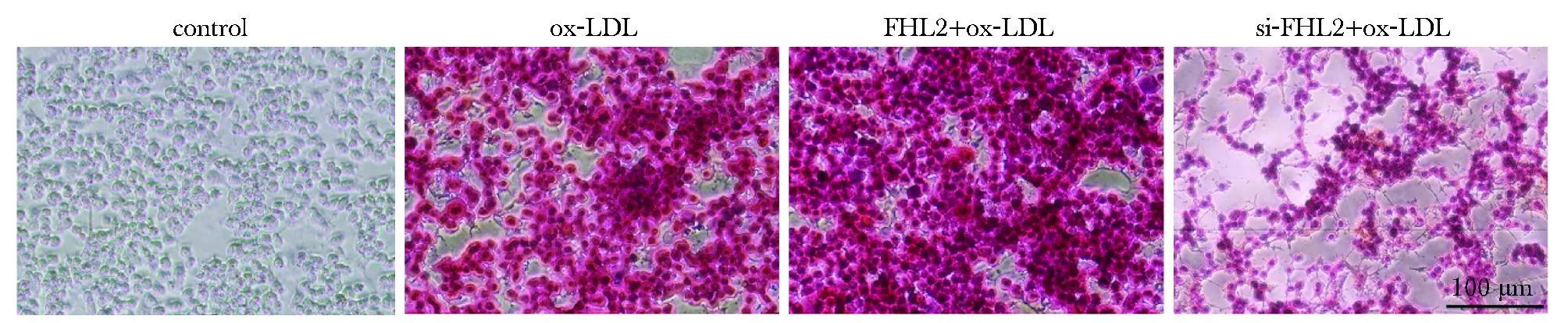
图4 油红O染色检测泡沫化Fig 4 Detection of foaming by oil red O staining (n=3)
2.5 FLH2调节NF-κB信号通路的活化缓解细胞泡沫化
与对照组相比,ox-LDL组p-P65、p-IκBα表达水平显著增加,其中FHL2+ox-LDL组上调更为显著,而si-FHL2+ox-LDL组细胞则表现为表达水平降低(P<0.05)(图5A)。与FHL2+ox-LDL组相比,BAY 11-7082+FHL2+ox-LDL组p-IκBα表达水平降低(图5C)。与ox-LDL组相比,FHL2+ox-LDL组细胞泡沫化严重,而BAY 11-7082+FHL2+ox-LDL组与FHL2+ox-LDL组相较,泡沫化程度相对较轻(图5B)。
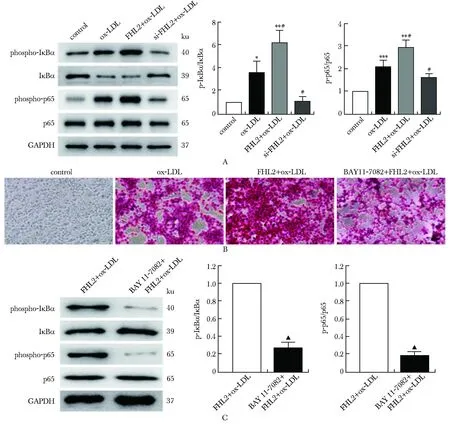
*P<0.05, **P<0.01, ***P<0.001 compared with control; # P<0.05 compared with ox-LDL; ▲ P<0.001 compared with FHL2+ox-LDL.
3 讨论
AS的主要特点表现为动脉脂质沉积,常伴有平滑肌细胞增殖,逐步形成硬化斑块,炎症几乎参与了AS的所有阶段,是AS起始和发展过程中生理病理变化的基础[6],分为脂肪条状、粥样及复杂硬化斑块、临床病理并发症等4个阶段,复杂粥样硬化斑块的主要特征为泡沫细胞的积累[7]。泡沫细胞是巨噬细胞内化脂蛋白后,自身脂质代谢紊乱形成的。巨噬细胞是机体主要的免疫细胞之一,能够分泌产生相关细胞因子,调节机体的炎性反应,进而影响AS的疾病进程[7]。
FHL蛋白由4个完整和一个半LIM结构域组成,属于一个家族,包括FHL1、FHL2、FHL3、FHL4和ACT,其中FHL1和FHL3主要在骨骼肌中表达,FHL2则主要在心脏中表达。FHL2是一种多功能的适配器蛋白,能与细胞表面受体、胞质适配器和结构蛋白、激酶和核转录因子相互作用,参与细胞的增殖、凋亡、黏附迁移及基因的表达[8],FHL2已被发现在心血管发育、AS、血管生成中发挥重要作用[9]。FHL2缺失的小鼠在高胆固醇饮食后,其AS病变较正常小鼠减轻[10];高脂饮食后ApoE/FHL2-/-小鼠AS斑块较小,且巨噬细胞含量减少[11]。在本文中,通过在细胞中转染si-FHL2,经油红O染色发现巨噬细胞的泡沫化程度减轻,相关炎性细胞因子的分泌也下调,缓解AS的发展。
NF-κB信号通路能调节巨噬细胞炎性反应,影响炎性因子的分泌。通常情况下,NF-κB信号通路中IκB与异二聚体结合,通路不被激活,当细胞被刺激后,IκB磷酸化降解,异二聚体转移至胞质中,调节IL-6、TNF-α、IL-1β等炎性细胞因子的分泌[12]。而IL-6、TNF-α、IL-1β均可对AS产生调节作用。通过抑制IL-6的信号转导能够减少AS的发生[13];雷洛昔芬通过抑制IL-6/STAT3信号通路抑制AS的发展[14]。TNF-α作为一种促AS细胞因子,敲除TNF-α、ApoE的小鼠AS减轻,炎症标志物减少[15-16]。IL-1β被阻断后,血液单核细胞的炎性反应减弱,进而AS斑块减小[15]。因此在本研究中,通过ELISA检测了这三种细胞因子的分泌情况,结果显示转染siFHL2后,IL-6、TNF-α、IL-1β的分泌水平均下调。为进一步明确FHL2调节AS的机制,si-FHL2可以下调phospho-p65、phospho-IκBα的表达,NF-κB信号通路不被激活。且使用BAY 11-7082处理后,FHL2组细胞泡沫化程度相对减轻。综上,下调FHL2的表达可以通过调节NF-κB信号通路的活化,下调IL-6、TNF-α、IL-1β的分泌水平,缓解THP-1巨噬细胞泡沫化。本研究为AS的治疗提供了新的思路,为明确FHL2在动脉硬化疾病中的潜在作用提供实验依据。

