髓系细胞触发受体2在高糖处理的小胶质细胞中的表达及作用
王曌慧,刘 潇,周 玥,魏心怡,王 玥,李俊发,赵 丽*
1. 首都医科大学 基础医学院 神经生物学系,北京 100006;2.首都医科大学附属北京安定医院国家精神心理疾病临床医学研究中心 精神疾病诊断与治疗北京市重点实验室,北京 100088;3.首都医科大学 人脑保护高精尖创新中心,北京 100069
高血糖是影响认知功能的独立危险因素[1]。高糖促使小鼠脑内海马神经元发生病变,诱发炎性反应激活小胶质细胞[2],并导致淀粉样蛋白β(amyloid β-peptide, Aβ)向大脑过度转运[3]。
小胶质细胞是中枢神经系统的免疫细胞,在认知功能中发挥双刃剑作用。近期发现的一种新的小胶质细胞表型——疾病相关小胶质细胞(disease-associated microglia, DAM),可以聚集在Aβ斑块周围,对其进行包围和吞噬,是一种对认知功能有益的小胶质细胞类型。髓系细胞触发受体2(triggering receptor expressed on myeloid cells 2, TREM2)是DAM标志性蛋白,其缺乏会导致DAM不能从第一阶段向第二阶段转化,影响其激活[4]。
然而,目前高糖对小胶质细胞TREM2表达及其功能的影响研究较少。因此,本文旨在探究高糖条件下小胶质细胞中TREM2表达的变化以及TREM2对小胶质细胞功能的作用。
1 材料与方法
1.1 实验材料
N9小胶质细胞系(北京协和细胞资源中心);葡萄糖(Gibco公司);抗Iba1抗体(Abclonal公司);抗TREM2抗体(abcam公司);辣根过氧化物酶(HRP)标记的山羊抗兔二抗(Thermo Scientific公司);Alexa Fluor® 594 驴抗山羊 IgG (H+L) (Molecular Probes 公司);ReverAid First Strand cDNA Synthesis Kit以及PowerUpTMSYBRTMGreen Master Mix(ThermoFisher公司);siRNA(北京利科丽公司);引物合成(奥科鼎盛生物科技有限公司);BrdU试剂盒(Anaspec公司);带荧光标签的Aβ(Anaspec公司)。
1.2 实验方法
1.2.1 细胞的分组及处理:将N9小胶质细胞分为对照组(NG)和高糖组(HG),对照组不做处理,高糖组在培养基中加入50 mmol/L的葡萄糖,培养基中葡萄糖终浓度为67.5 mmol/L。在对照组和高糖组的基础上,加入Lipofectamine2000和Opti-MEM混合孵育液作为Lipo组(NG+Lipo)和高糖加Lipo组(HG+Lipo)。在对照组和高糖培养基的基础上,加入Lipofectamine2000和siRNA的孵育混合物作为TREM2敲减组(NG+TREM2 siRNA)和高糖加TREM2敲减组(HG+TREM2 siRNA)。在此基础上,为了探究小胶质细胞对Aβ的吞噬能力,在培养基中额外加入带荧光标签的Aβ作为正常加荧光Aβ组(NG+Aβ)、高糖加荧光Aβ组(HG+Aβ)、高糖加Lipo加荧光Aβ组(HG+Lipo+Aβ)和高糖加TREM2敲减加荧光Aβ组(HG+TREM2 siRNA+Aβ)
1.2.2 免疫荧光实验检测小胶质细胞钙结合蛋白(Iba1)和TREM2表达:将5×104个细胞接种在提前放入细胞爬片的24孔板内,并进行相应的加药处理,处理好的细胞弃掉培养基,用PBS轻轻漂洗1次,洗去残留培养基和细胞碎片,弃掉PBS后,加入4%的多聚甲醛固定液,室温固定30 min。弃掉多聚甲醛,用PBS清洗3次,每次10 min,之后加入0.3% PBST通透缓冲液,室温孵育15 min,进行破膜,弃掉PBST,用PBS清洗3次,每次10 min,加入3%的BSA溶液封闭,室温孵育1 h。弃掉BSA,加入适宜浓度的一抗(Iba1, 1∶200;TREM2, 1∶500),4 ℃孵育过夜。弃掉一抗,PBS洗5次,每次6 min,加入Alexa fluor 488或594标记的荧光二抗,避光室温孵育3 h,弃去二抗,用PBS洗5次,每次6 min。将细胞爬片用眼科镊去除,封片,晾干后观察拍照。
1.2.3 RT-qPCR检测TREM2 mRNA表达:去除细胞培养基,PBS洗两次,每孔加入200 μL Trizol,冰上放置10 min,收集细胞至1.5 mL离心管中,按照试剂盒要求步骤提取RNA,用Nanodrop微量分光光度计测量并记录提取的总RNA样本的浓度和纯度。配制反转录体系,合成cDNA。利用从NCBI上设计的TREM2引物进行cDNA片段扩增,用相对定量法比较各组目的基因表达量。TREM2上游引物:5′-GGAGGACCCTCTAGATGACCAAGA-3′;下游引物:5′-AGGCCAGGAGGAGAAGAATGGA-3′;内参GADPH上游引物:5′-AGAACATCATCCCTGCATCC-3′;下游引物: 5′-CACATTGGGGGTAGGAACAC-3′。20 μL上样体系:2×SYBR Green Mix 10 μL、cDNA 1 μL、上下游引物各0.5 μL、ddH2O 8 μL。

A.representative images of immunofluorescence showed the expression and distribution of TREM2 (red), Iba1 (green) and DAPI (blue) in microglia; B,C.quantitative analysis of mean fluorescence intensity(MFI) of Iba1 and TREM2 in microglia in each group; *P<0.001 compared with NG group.
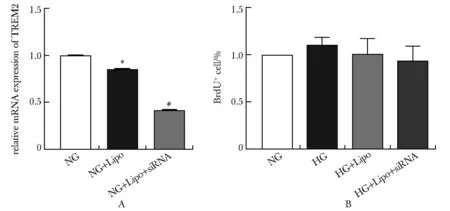
A.the expression of TREM2 mRNA in microglia after TREM2 knockdown; B.the percentage of BrdU positive microglia in each group; *P<0.05 compared with NG group; # P<0.001 compared with NG+Lipo group.

A.scratch test showed the migration of microglia 24 hours after wounding in each group; B.the percentage of wound closure 24 hours after wounding in each group; *P<0.05 compared with NG group.

A.representative images of flow cytometry showed the phagocytic ability of Aβ by microglia; B.quantitative analysis of flow cytometry showed the percentage of Aβ uptake in microglia; *P<0.001 compared with NG+Aβ group, # P<0.001 compared with HG+Lipo+Aβ group.
1.2.4 BrdU实验检测小胶质细胞增殖:将细胞以适宜浓度种入96孔板,培养完成后,添加BrdU,2 h后,加入固定液,在室温下孵育30 min,之后弃掉固定液,用洗涤液洗3次。洗完之后,拍干。加入抗BrdU的多克隆检测抗体,室温孵育1 h。用洗涤液洗3次。洗完之后,拍干。加入过氧化物酶-山羊抗小鼠IgG偶联物,室温孵育30 min。用洗涤液洗3次。洗完之后,拍干。用去离子水浸没板子,拍干。加入TMB过氧化物酶底物,避光室温孵育30 min。添加终止液,测量450/550 nm的波长。
1.2.5 划痕实验检测小胶质细胞迁移:将细胞以适宜浓度接种入底部划线的6孔板中,培养24 h后进行分组给药处理,处理完成后用200 μL枪头沿6孔板底部直线垂直于孔板进行划线,弃去培养基,并用PBS轻柔的清洗细胞2次,洗去划痕内的漂浮细胞,在显微镜下选取5处划痕位置拍照并记录。24 h后,在镜下选取相同位置进行拍照,记录细胞的迁移情况。
1.2.6 流式细胞术检测小胶质细胞吞噬Aβ情况:将细胞以适宜浓度接种入6孔板,培养24 h后进行分组给药处理,处理完成后加入带荧光标签的Aβ,2 h后收集细胞。用PBS洗涤细胞1~2次,用不含EDTA的胰蛋白酶消化2 min后,加入完全培养基终止消化,收集细胞液,300 r/min离心10 min,PBS洗3次,重悬细胞终浓度为1×106个/mL。
1.3 统计学分析
2 结果
2.1 高糖对小胶质细胞TREM2表达的影响
基础培养基中添加50 mmol/L葡萄糖溶液处理小胶质细胞,24 h后观察Iba1和TREM2蛋白的表达变化(图1A)。与正常组相比,高糖处理组Iba1的表达显著升高(P<0.001)(图1B),与DAM表型相关的TREM2蛋白表达也明显升高(P<0.001)(图1C),说明高糖可以明显增加小胶质细胞TREM2的表达。
2.2 小胶质细胞中TREM2的敲减
与正常组和Lipo组相比,TREM2 siRNA敲减的小胶质细胞中TREM2表达水平显著下降,差异具有统计学意义(P<0.001)(图2A),表明利用Lipofectamine2000转染构建瞬时敲减TREM2的细胞模型成功。
2.3 TREM2对高糖小胶质细胞增殖的影响
与正常组相比,高糖组小胶质细胞增殖能力无明显变化(图2B);与高糖组相比,TREM2 siRNA敲减的高糖小胶质细胞的增殖没有变化(图2B)。因此,高糖处理和TREM2敲减均不影响小胶质细胞的增殖。
2.4 TREM2对小胶质细胞迁移能力的影响
与正常组相比,高糖组小胶质细胞的迁移明显减少,差异具有统计学意义(P<0.05)(图3),说明高糖使小胶质细胞的迁移能力下降。然而,与HG+Lipo对照组相比,HG+TREM2 siRNA组小胶质细胞迁移能力没有显著差异(图3)说明TREM2敲减对高糖条件下小胶质细胞的迁移能力没有影响。
2.5 TREM2对小胶质细胞吞噬Aβ能力的影响
与正常组相比,高糖组小胶质细胞吞噬Aβ的百分比下降为0.29±0.015;与Lipo对照组相比,TREM2 siRNA敲减的高糖小胶质细胞吞噬Aβ的百分比从0.26±0.048下降为0.15±0.043(P<0.001)(图4)。因此,高糖会降低小胶质细胞对Aβ的吞噬能力,且TREM2敲减进一步削减其吞噬能力。
3 讨论
TREM2是先天性免疫吞噬受体,在中枢神经系统中主要表达于小胶质细胞。阿尔茨海默病(Alzheimer′s disease,AD)、多发性硬化症、慢性睡眠障碍等疾病均可以引起脑组织中TREM2表达明显升高[5-7]。本研究发现,高糖处理明显增强小胶质细胞TREM2表达,提示TREM2有可能在高糖影响小胶质细胞功能中发挥重要作用。
高糖对于小胶质细胞增殖的作用尚存在争议,有研究认为高糖提高小胶质细胞的增殖能力[8],也有研究认为高糖减少了小胶质细胞的增殖[9]。本研究发现高糖对于小胶质细胞的增殖没有显著影响。这些研究结果的差异可能与不同葡萄糖浓度和处理时间有关。目前,报道TREM2对小胶质细胞增殖能力的研究较少,而本研究发现TREM2敲减不影响高糖小胶质细胞增殖能力。
研究报道,随着葡萄糖浓度的增加,小胶质细胞的迁移能力不断下降[10]。本研究也发现高糖明显削弱了小胶质细胞的迁移能力。还有研究发现,TREM2缺乏明显削弱小胶质细胞向受损伤神经元的迁移能力,并缩短小胶质细胞迁移的距离[11]。然而,对于高糖条件下TREM2对小胶质细胞迁移能力的影响的研究较少。本研究发现,TREM2敲减并不影响高糖小胶质细胞迁移能力。
Aβ是淀粉样前体蛋白(amyloid precursor protein, APP)的裂解产物。Aβ1-40和Aβ1-42肽是AD典型病理特征老年斑中的主要成分。有研究发现,TREM2会与载脂蛋白结合,促进小胶质细胞对Aβ的摄取[12]。人类多能干细胞(human pluripotent stem cells, hPSCs)衍生的小胶质细胞中TREM2敲减或者敲除后,对于淀粉样蛋白的吞噬作用明显下降[13]。过表达TREM2的5xFAD小鼠小胶质细胞对Aβ的吞噬作用明显增强,从而有效改善认知功能[14]。本研究发现高糖显著减弱小胶质细胞吞噬Aβ的能力,而TREM2进一步下调高糖小胶质细胞吞噬能力。
综上所述,本研究发现高糖处理后小胶质细胞TREM2表达明显升高,TREM2敲减明显削弱了高糖小胶质细胞吞噬Aβ的能力,但并不影响高糖小胶质细胞增殖和迁移。本研究初步阐明了高糖条件下TREM2对小胶质细胞功能的影响,后续需要在动物水平进一步探索TREM2在糖尿病小鼠认知功能障碍中的具体作用和分子机制。

