乳鼠原代成骨细胞的培养优化
王左钰,周 阳,杨俊伟
南京医科大学第二附属医院 肾脏病中心,南京 210003
矿物质和骨异常(mineral and bone disorder,MBD)是影响慢性肾脏病患者生存的重要并发症之一[1-2]。骨骼不仅是支撑人体的结构组织,还具备调控机体钙磷代谢的作用,骨异常在慢性肾脏病钙磷平衡中的影响日益备受重视。成骨细胞是骨骼的主要成分之一,参与骨吸收与重建的同时,受到诸如力量负荷、炎性反应、激素和电解质等因素的影响,还可经旁分泌途径影响肌肉、心血管和肾脏等器官的结构与功能[3-6]。因此,研究成骨细胞生物学特性及影响因素将有助于阐明慢性肾脏病矿物质和骨异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)的机理。
原代成骨细胞的分离与培养是研究成骨细胞的基础,本研究通过分离、纯化的小鼠成骨细胞,优化其诱导培养条件,借助成骨细胞成熟标志物的表达和钙化活性的改变,改良体外培养原代成骨细胞的方案,为研究其在CKD-MBD中的作用构建实验体系。
1 材料与方法
1.1 材料
SPF级新生1 d~3 d CD1小鼠(北京维通利华实验动物技术有限公司);0.25%胰蛋白酶、兔或鼠二抗、β-甘油磷酸钠(β-glycerophosphate,β-GP)、L-抗坏血酸(L-ascorbic acid,AA)和地塞米松(dexamethasone,Dex)(Sigma公司);胶原酶A(Roche公司);α-MEM培养基、胎牛血清、青霉素+链霉素(penicillin-streptomycin,PS)(Gibco公司);兔抗鼠成骨细胞特异转录因子SP7/Osterix(Osterix,Osx)抗体和兔抗鼠骨钙素(Osteocalcin,OC)抗体(Abcam公司);兔抗鼠Runt相关的转录因子-2(RUNX2)抗体(MBL公司);BCIP/NBT碱性磷酸酯酶显色试剂盒和茜素红试剂(碧云天公司);4%多聚甲醛组织固定液(Biosharp公司);增强化学发光检测底物(Thermo Fisher公司)。
1.2 方法
1.2.1 细胞的培养: 取CD1乳鼠10~15只,处死后置75%乙醇容器内灭菌5 min,0.9%氯化钠溶液冲洗后,无菌下取顶骨于盛有0.9%氯化钠溶液培养皿中,去除骨膜及附着结缔组织后剪成0.5 cm×0.5 cm骨片,PBS冲洗2次。将骨片放入0.25%胰蛋白酶消化液中,37 ℃消化10 min后,800 r/min离心弃上清液,PBS清洗2次。加入2 mg/mL胶原酶A消化液,37 ℃消化30 min,吹打骨片后,800 r/min离心弃消化液,再加入新配上述消化液,37 ℃消化60 min。轻柔吹打骨片,1 000 r/min离心吸取上清液于另支50 mL离心管,2 000×g离心5 min。弃上清,以10 mL培养液(α-MEM+10% FBS+1% PS)重悬细胞,经200目筛网滤过,将细胞悬液接种于培养皿内,5% CO2,37 ℃条件下培养,2 d~3 d换液1次。
1.2.2 实验的分组: 将培养好的原代成骨细胞分为3组。血清梯度组:10%、8%和2% FBS +1% PS+50 μg/mL AA+10 mmol/L β-GP+5 nmol/L Dex;培养时间梯度组:10% FBS+1% PS+50 μg/mL AA+10 mmol/L β-GP+5 nmol/L Dex分别培养7、10、14、17和21d;β-GP浓度梯度组:10% FBS+1% PS+50 μg/mL AA+5、10或20 mmol/L β-GP+5 nmol/L Dex;Dex浓度梯度组:10% FBS+1% PS+50 μg/mL AA+10 mmol/L β-GP+5、10或20 nmol/L Dex。
1.2.3 电镜观察细胞形态: 取诱导培养(10% FBS+1% PS+50 μg/mL AA+10 mmol/L β-GP+5 nmol/L Dex)的成骨细胞爬片(1 cm×1 cm),经4%多聚甲醛等处理后电镜观察其超微结构。
1.2.4 成骨细胞碱性磷酸酯酶及钙结节茜素红染色: 取各组细胞,PBS洗涤的细胞爬片,经4%多聚甲醛固定。BCIP/NBT碱性磷酸酯酶显色工作液,室温孵育30 min;或新鲜制备的茜素红(2%,pH 4.2)室温避光染色30 min;DAPI染核后进行观察,使用Image-Pro软件统计分析。
1.2.5 成骨细胞标志蛋白免疫荧光染色: 4%多聚甲醛固定成骨细胞爬片,0.3% Triton X-100渗透。PBS洗涤、封闭处理后,兔抗鼠Osx或OC抗体孵育4 ℃过夜;PBS洗涤后,室温下二抗避光孵育。DAPI染核后进行观察,荧光成像仪采集图像。
1.2.6 Western blot检测: 用PBS洗涤细胞,用裂解缓冲液(50 mmol/L Tris-HCl,0.5% SDS,250 mmol/L NaCl,5 mmol/L EDTA)提取蛋白质,离心,取上清,用BCA法蛋白定量。用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)对等量的蛋白质进行分离。SDS-PAGE后,将蛋白质转移到PVDF膜上,进行免疫印迹。用4%牛血清白蛋白封闭PVDF膜,予兔抗鼠Osx、OC和RUNX2抗体(1 ∶1 000),在4 ℃孵育过夜。然后与兔二抗(Sigma)(1 ∶5 000),在室温下孵育1 h。用增强化学发光检测底物显示免疫反应蛋白,通过ImageJ软件进行定量分析。以β-肌动蛋白(β-actin)为内对照。
1.3 统计学分析

2 结果
2.1 原代成骨细胞的形态
原代成骨细胞在倒置显微镜下可见其增殖状态良好,形成不规则细胞突起,可呈三角形、梭形、纺锤形多种形态,细胞核明显,核仁清晰可见。培养5 d~7 d细胞可完全汇合,呈鹅卵石样铺满培养皿(图 1A)。
2.2 成骨细胞的染色鉴定与超微结构观察
原代成骨细胞经诱导培养14 d,其碱性磷酸酶及成熟标志蛋白表达,基质钙结节沉积(图1B~D)。电镜下可见部分细胞表面存在密集的胶原纤维网络,呈不规则覆盖,表面光滑。高倍率下可见裸露部位的成骨细胞胞体多轴突,彼此呈网状交织,表面分泌囊泡状物质融合形成钙结节(图 1E)。

A.light microscopic morphology of primary osteoblasts; B.alizarin red staining of osteoblasts; C.alkaline phosphatase staining of osteoblasts; D.immunofluorescence staining for Osterix at 14 days of cell culture; E.electron microscopic morphology.
2.3 成骨细胞培养时间条件的优化
成骨细胞体外成熟度随诱导时间延长而增加,表现为体外钙结节沉积面积增大(图2A~B)、表达碱性磷酸酶的细胞数增多(图2C~D),在10% FBS条件下培养至14~21 d Osx及OC表达较前明显增加(图 2E)。可见诱导培养14 d后,多数细胞可分化为成骨细胞,并有形成骨基质功能。

A.distribution of alizarin red-positive calcium nodules; B.nodule area ratio at different serum concentrations and culture times, *P<0.001 compared with Ctrl; C.staining of alkaline phosphatase; D.percentage of alkaline phosphatase positive cells at different serum concentrations and culture times, *P<0.05, **P<0.001 compared with Ctrl; E.expression of osteoblast marker proteins at different culture times, *P<0.05, **P<0.01, ***P<0.001 compared with Ctrl.

A.expression of osteoblast marker proteins at different serum concentrations, # P<0.05, # # P<0.01 compared with precursor osteoblasts cultured with 10% FBS; *P<0.05, **P<0.01, ***P<0.001 compared with 2% FBS; △ P<0.05 compared with 8% FBS.
2.4 影响成骨细胞分化的条件
2.4.1 血清浓度对成骨细胞成熟度的影响: 在不同浓度血清连续培养21d,可见原代成骨细胞分化成熟均随血清浓度升高而增加,表现为体外钙结节沉积增多(图2B),成骨标志蛋白较前增加(图2E),细胞分化为成熟成骨细胞。但当成骨细胞仅予2% FBS培养时,于14 d 观察到钙沉积较少(图3A)。此外,当细胞诱导至14 d 时,8%与10% FBS培养相比,使用10% FBS培养成骨细胞OC表达明显(图3D)。
2.4.2 β-甘油磷酸钠浓度对成骨细胞成熟度的影响: 随磷酸盐浓度增高,成骨细胞碱性磷酸酶含量及胞外钙结节沉积增加,Osx表达增加,RUNX2降低(图4A~C),表明磷酸盐有促进前体成骨细胞分化成熟的作用,成骨活性增强。但当磷酸盐浓度高达20 mmol/L时,可见成骨细胞形态异常,轴突消失,呈多边型小细胞状(图 4D),骨钙素表达及钙结节形成较前下降,成骨细胞骨形成作用受抑制。因此使用10 mmol/L β-GP更适宜。

A.Alizarin red staining; B.alkaline phosphatase staining; C.Western blot assay of osteoblast marker protein expression; D.immunofluorescence staining for osteoblast marker protein; *P<0.05, **P<0.01, ***P<0.001 compared with 0 mmol/L β-GP.
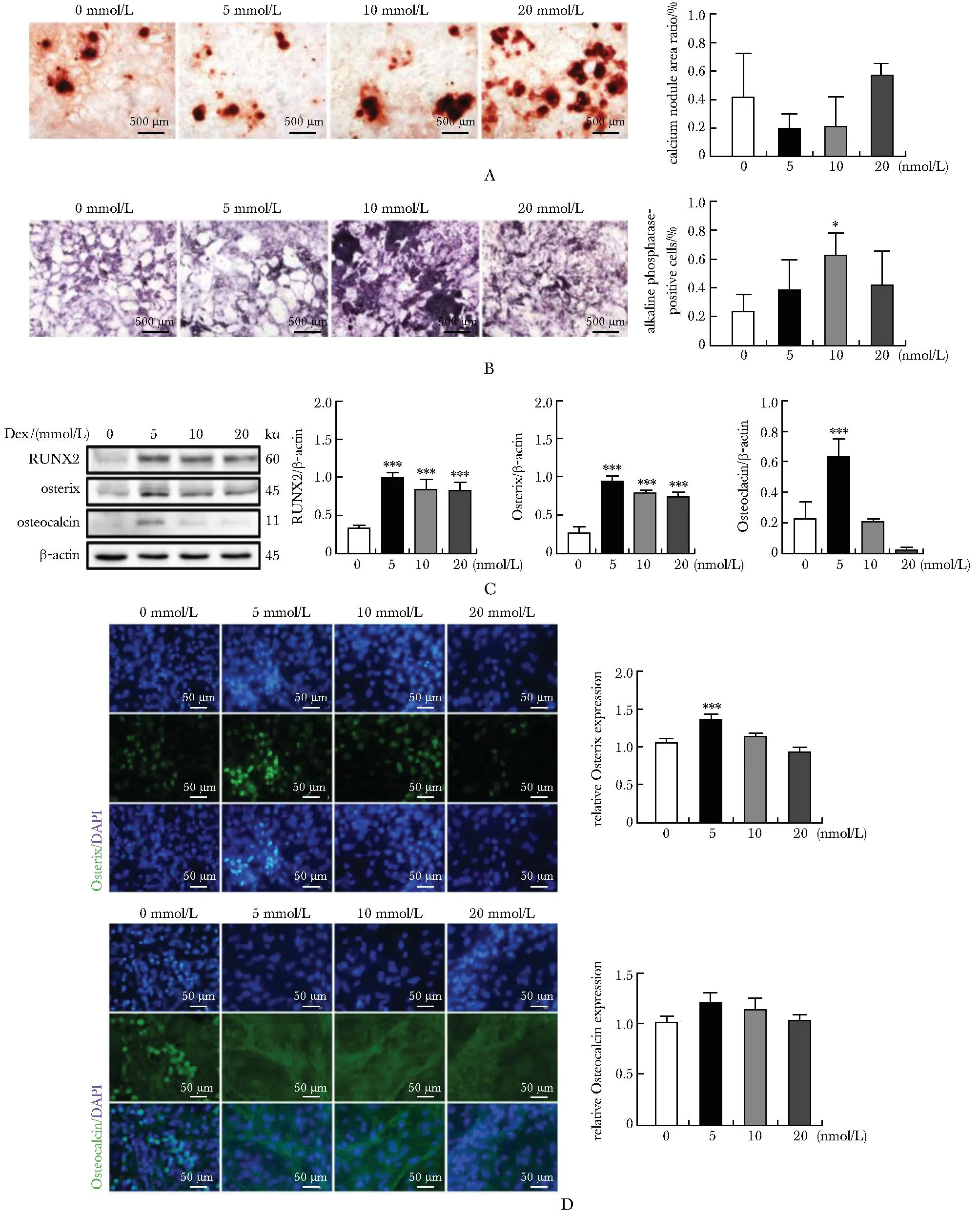
A.Alizarin red staining; B.alkaline phosphatase staining; C.Western blot assay of osteoblast marker protein expression; D.immunofluorescence staining for osteoblast marker protein; *P<0.05, **P<0.01, ***P<0.001 compared with 0 mmol/L Dex.
2.4.3 地塞米松浓度对成骨细胞成熟度的影响: 使用优化诱导培养(10% FBS+1% PS+50 μg/mL AA+10 mmol/L β-GP+ Dex),可见成骨细胞在5 nmol/L Dex作用条件下成骨细胞标志蛋白Osx、OC、RUNX2表达明显,但高浓度Dex可抑制成骨细胞分化(图 5A-D)。值得一提的是,细胞外基质中钙沉积总面积与地塞米松浓度呈正比,在20 nmol/L作用下出现广泛散在钙结节,但镜下未见单个钙结节面积扩大;成骨细胞碱性磷酸酶在10 nmol/L地塞米松时,表达轻度增加,但与5 nmol/L及20 nmol/L相比无统计学差异(图 5B)。
3 讨论
原代成骨细胞是研究疾病模型及信号通路等体外实验的基础。目前,成骨细胞的分离方法主要有酶消化法和组织块法。组织块法虽然操作简易,不易污染且细胞损伤较低,但细胞游出较缓慢且数量少,限制其使用。因此,本实验采取间断酶消化法。在贯序消化3~5次后,可获得大量原代细胞,经过诱导培养即获得成熟成骨细胞,出现弥漫细胞外基质钙盐沉积,RUNX2、Osx和OC表达明显升高,标志着大量前体成骨细胞分化,成骨细胞成熟比例增高。
对于成骨细胞诱导培养中磷酸盐及糖皮质激素配比,目前国内外尚无统一标准方案及相应浓度梯度测定。有研究指出[7-8],成骨细胞在β-GP作用下可增强其体外形成骨骼的能力,该过程类似于体内骨形成,但高浓度磷酸盐可降低成骨细胞标志基因的表达,表现出细胞凋亡特征。基于此设定梯度实验,发现10、20 mmol/L β-GP浓度作用下磷酸盐均可促进成骨细胞分化,但20 mmol/L β-GP明显抑制成骨细胞的矿化形成,免疫荧光染色见细胞收缩,结合既往文献,可能因高磷通过NOX诱导活性氧(reactive oxygen species,ROS)产生,改变细胞稳态,抑制成骨能力[9]。
数篇研究指出Dex在10-8~10-6mmol/L可增加成骨细胞碱性磷酸酶活性和钙结节形成,促进成骨细胞自噬,增加细胞活性。然而,大剂量Dex通过ROS-PI3K/AKT/GSK3β信号通路显著抑制成骨细胞和MC3T3-E1细胞的分化并诱导细胞凋亡[10-14]。本实验中茜素红染色示,20 nmol/L Dex可促进细胞外基质钙结节生成,但抑制成骨细胞标志蛋白及碱性磷酸酶表达,对此推测Dex可刺激未成熟成骨细胞分泌细胞外囊泡沉积于基质,起到骨矿化作用,其对于钙盐沉积作用需未来进一步探索。
综上所述,本研究最终采用α-MEM培养基,10% FBS,1% PS,50 μg/mL抗坏血酸,10 mmol/L β-GP加5 nmol/L Dex作为诱导成骨细胞成熟的培养方案,在14 d可获得形态正常且有成骨活性的成熟成骨细胞。此培养方案有望规范目前体外成骨细胞实验模型的构建,为进一步探究成骨细胞代谢及药物作用等提供良好的实验基础。

