Nutlin-3a通过抑制CIDEC的表达调控小鼠脂肪功能
陈恩惠,杨佳卉,赵 微,解相宏,郭艳芳,刘晓军,闫 莉
中国医学科学院基础医学研究所 北京协和医学院基础学院 1.病理生理学系;2.重大疾病共性机制研究全国重点实验室,北京 100005;3.山西医科大学 基础医学院 微生物学与免疫学教研室,山西 太原 030001
脂肪组织调节机体内能量平衡与稳态[1],当机体热量摄入超过消耗时,这种平衡被打破,往往会造成脂肪细胞肥大以及内脏脂肪组织的堆积[2],从而造成肥胖,以致于引起一系列代谢相关疾病的发生,如糖尿病,动脉粥样硬化等[3]。脂滴也称为脂质体,广泛分布于脂肪细胞中,主要的作用为储存脂类[4],脂滴的一系列变化与肥胖引起的代谢性疾病密切相关[5]。有研究表明,细胞死亡诱导DFFA样效应子c(cell death-inducing DFF45-like effector C,CIDEC)在脂肪组织中高表达[6],且其定位于脂滴表面[7],参与脂肪细胞能量代谢。在之前的研究证明了小鼠双微体同源基因2(murine double minute 2,MDM2)与肥胖有关[8-9], 顺式咪唑啉类似物3a(Nutlin-3a)作为MDM2的抑制剂,已被证明是有效的抗癌剂[10],然而Nutlin-3a在脂肪代谢中的作用及调节机制目前报道较少。
1 材料与方法
1.1 材料
动物:SPF级C57BL/6J雄性小鼠(中国医学科学院基础医学研究所实验动物中心)。
主要试剂:葡萄糖粉末(Thermo公司);胰岛素溶液(上海碧云天生物技术有限公司);高脂饲料(Research Diets公司);RIPA裂解液,PMSF(碧云天生物技术有限公司);蛋白酶抑制剂Cocktail(Aqlabtech公司);Tris,SDS,甘氨酸(AMRESCO公司);Trizol(Invitrogen公司);NovoScript Plus All-in-one 1st Strand cDNA Synthesis SuperMix(近岸蛋白公司);Hieff UNICON Universal Blue qPCR SYBR Green Master Mix(Yeasen Biotechnology公司);CIDEC抗体(Abclonal公司)。
1.2 方法
1.2.1 小鼠的分组及给药:将C57小鼠随机分为对照组和实验组,每组6只,对照组腹腔注射DMSO,实验组腹腔注射Nutlin-3a(10 μg/g)每2天注射1次,使用电子秤进行小鼠体质量的称量并记录。
1.2.2 小鼠葡萄糖耐量实验与胰岛素敏感性实验:于实验当天上午将小鼠换入干净的笼子并禁食6~8 h;禁食完成后,用血糖仪测定空腹初始血糖值,小鼠适应30 min之后,按0.01 mL/g给小鼠腹腔注射葡萄糖或胰岛素溶液。从注射完毕起开始计时,分别在第 15、30、60、90和120 min测定每只小鼠的血糖值。
1.2.3 Western blot检测CIDEC蛋白:在取材时所冻存的组织中加入配制好的蛋白裂解液RIPA(含蛋白酶抑制剂cocktail和PMSF),冰上匀浆后,4 ℃旋转孵育1 h,4 ℃ 12 000 r/min离心15 min,取蛋白上清到1.5 mL离心管中,加入5×SDS-PAGE蛋白上样缓冲液混匀后金属浴100 ℃,10 min,冷却后开始上样,进行电泳,浓缩胶70 V,30 min,分离胶100 V,1 h;使用湿转法恒流300 mA进行转膜,完毕后使用5%的脱脂奶粉(TBST配制)进行封闭1 h;一抗4 ℃过夜孵育后,在室温下用TBST洗膜(100 r/min,10 min/次,共3次),用相应的二抗在室温下旋转孵育1 h并再次洗膜,将eECL-A和eECL-B按照1∶1的比例等体积混合,配制为化学发光检测底物工作液,使用天能化学发光仪进行曝光。
1.2.4 RT-qPCR检测CIDECmRNA:将取材时所冻存的组织使用Trizol试剂提取脂肪组织总RNA,并定量2 μg将其反转录为cDNA,并使用PCR仪进行扩增,PCR程序为:50 ℃反转录反应15 min,75 ℃终止反应5 min;定量取0.5 μL的cDNA模板,并与qPCR SYBR Green Master Mix以及上下游引物,配制成20 μL的反应体系,在PCR仪上完成扩增及实时荧光定量检测,最终结果以相对定量(2-ΔΔCq法)进行计算,得到目的基因相对于内参的相对表达水平。引物序列如下:β-actin上游引物:5′-CCAGCCTTCCTTCTTGGGTAT-3′,下游引物:5′-TGCTGGAAGGTGGACAGTGAG-3′;鼠Cidec上游引物:5′-GTGTCCACTTGTGCCGTCTT-3′,下游引物:5′-CTCGCTTGGTTGTCTTGATT-3′; PCR程序为:95 ℃预变性2 min;95 ℃变性10 sec,60 ℃退火/延伸30 sec,循环40次。
1.3 统计学分析

2 结果
2.1 Nutlin-3a增加高脂饮食所诱导的肥胖
腹腔注射Nutlin-3a的高脂饮食小鼠,在38 d后,较对照组体质量有显著增加(P<0.001)(图1)。

*P<0.001 compared with DMSO group.
2.2 Nutlin-3a对小鼠葡萄糖耐量和胰岛素敏感性没有影响
在葡萄糖耐量和胰岛素敏感性实验中,小鼠注射葡萄糖或胰岛素后,Nutlin-3a组小鼠每个时间点的血糖和曲线下面积(area under the curve, AUC)较对照组均没有统计显著性差异(图2)。

GTT.glucose tolerance test; AUC.area under the curve; ITT.insulin tolerance test.A.GTT in mice; B.AUC in GTT; C.ITT in mice; D.AUC in ITT.
2.3 Nutlin-3a诱导小鼠白色脂肪组织的质量无明显变化
高脂饮食诱导肥胖(diet-induced obesity, DIO)小鼠在Nutlin-3a处理48 d后,其肝脏质量没有变化,附睾白色脂肪组织(epididymal white adipose tissue, eWAT)与皮下白色脂肪组织(inguinal white adipose tissue, iWAT)的质量与占比无明显增加;二者棕色脂肪组织(brown adipose tissue, BAT)无明显变化(图3)。

eWAT.epigonadal white adipose tissue; iWAT.inguinal WAT; BAT.brown adipose tissue; A.liver, white and brown fat weights in mice; B.tissue/body weight ratio.
2.4 Nutlin-3a减少了白色脂肪脂滴的形成
H&E结果显示,Nutlin-3a处理后白色脂肪组织的脂肪细胞体积明显变小,且细胞数量明显增多(图4)。
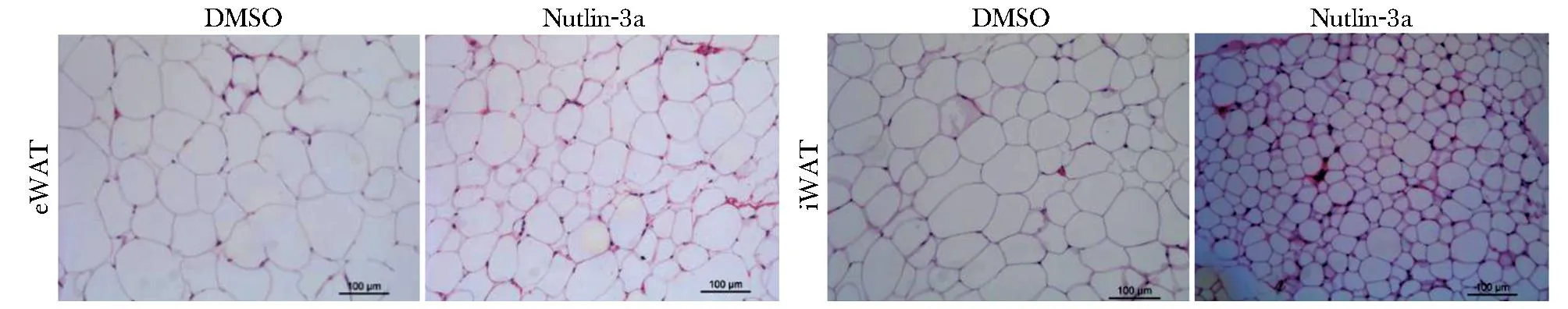
图4 白色脂肪组织HE染色Fig 4 HE staining of white adipose tissue
2.5 Nutlin-3a抑制白色脂肪组织中CIDEC的表达
与对照小鼠相比,Nutlin-3a组小鼠eWAT中诱导CIDEC mRNA和蛋白质的表达水平明显降低(P<0.001)(图5)。

A.Nutlin-3a decreased CIDEC mRNA expression in eWAT;B.Nutlin-3a decreased CIDEC protein expression in eWAT;*P<0.001 compared with DMSO group.
3 讨论
维持脂肪组织的功能正常对于平衡机体能量代谢是极其重要的。在正常情况下,脂肪组织除了储存能量以外,还可承担如调节体温、代谢、内分泌、免疫等多项生命功能,保持机体稳态。长期慢性高脂饮食可诱导脂肪细胞中三酰甘油过多积累诱发脂代谢紊乱最终导致肥胖,严重危害身体健康。
Nutlin-3a是Nutlin-3的活性异构体,是一种MDM2抑制剂。有研究表明MDM2的表达与营养状态相关,脂肪特异性过表达MDM2可加重高脂饮食诱导的脂肪组织功能紊乱[9]。Nutlin-3a可通过抑制 MDM2和p53的相互作用稳定 p53 蛋白,因此可用来诱导细胞周期停滞和细胞凋亡。本研究利用高脂饮食诱导小鼠肥胖(DIO),同时腹腔注射Nutlin-3a,与对照组相比,实验组小鼠的体质量在38 d后出现显著增加。肝质量在两组间无统计学差异,eWAT和iWAT的质量与对照组相比,有增加的趋势但是无统计学差异,这可能需要后续研究增加小鼠样本量进一步确定是否存在统计差异。同时病理切片结果显示,与对照组相比,实验组的脂肪细胞体积明显减小,细胞数量增加,表明MDM2抑制剂Nutlin-3a可能影响机体的白色脂肪组织功能。CIDE家族蛋白是一类脂滴结合蛋白,包括CIDEA,CIDEB与CIDEC,定位于脂滴表面,是维持脂质代谢稳态的重要调节因子[11]。CIDEC特异性表达于白色脂肪组织和棕色脂肪组织中,主要功能是抑制脂质分解,促进细胞内脂质积累和单室脂滴形成。有研究表明,CIDEC缺陷会显著减少 WAT 中的脂质储存,增加能量消耗[12]。本研究中,小鼠腹腔注射Nutlin-3a导致eWAT中CIDEC的基因和蛋白水平表达下调,表明Nutlin-3a改善了饮食诱导的白色脂肪组织的脂滴增加。与对照组相比,实验组小鼠体质量增加但白色脂肪组织中细胞体积减小,脂滴含量减少,这是否提示发生脂肪重新分布和异位脂肪沉积,有待于进一步研究。同时脂肪细胞数量增加,这可能是机体为了维持脂肪高代谢率产生负反馈调控的结果。
综上所述,MDM2抑制剂Nutlin-3a通过减少白色脂肪组织中CIDEC的表达来减少饮食诱导的脂滴增加,改善白色脂肪组织功能。本研究为MDM2抑制剂Nutlin-3a有可能在未来预防饮食诱导的肥胖症提供新思路。

