下调去甲基化酶FTO抑制人肝癌细胞系HepG2增殖
卢慧莹,王建国
新乡医学院第一附属医院 肝胆外科,河南 新乡 453002
肝细胞癌(hepatocellular carcinoma,HCC)是一种原发性肝癌,数据统计显示[1],中国肝癌死亡率约占世界的1/2,严重威胁患者的生命健康。研究发现[2],肿瘤细胞恶性生物学行为与表观稳态失衡密切相关,其中RNA等动态化学修饰是表观调控的前沿领域。脂肪质量和肥胖相关(fat mass and obesity associated,FTO)蛋白是N6-甲基腺嘌呤(N6-methyladenosine,m6A)的去甲基化酶,可调控m6A修饰的水平并和m6A甲基转移酶共同作用,进而维持体内m6A甲基化修饰的动态平衡[3]。研究发现[4],FTO在宫颈癌、乳腺癌等肿瘤中有癌基因的功能,在肝内胆管癌、卵巢癌、肾癌等中有抑癌基因的作用,但目前在肝细胞癌中的报道较少。叉头盒蛋白O1(forkhead box protein O1,FoxO1)是叉头转录因子家族一个关键成员,其通过减少癌细胞的过度增殖来抑制癌细胞的转录活性,从而参与了早期恶性肿瘤的形成和发展。FoxO1还能够促进癌细胞的分化,并降低其异型性水平。目前已有研究发现[5],FoxO1的表达缺失与肝细胞癌的临床分期进展或癌细胞形态的改变密切相关,且在FTO抑制人肝细胞癌增殖中的作用研究较少。因此,本研究旨探究m6A去甲基化酶FTO在肝细胞癌中的表达,及能否调控FoxO1,影响肝细胞癌增殖。
1 材料与方法
1.1 材料
1.1.1 细胞系:人肝癌细胞系HepG2、正常肝细胞系HL7702(中国科学院上海细胞库)。
1.1.2 试剂:胎牛血清、胰蛋白酶(Gibco公司);DMEM培养基(Sigma-Aldrich公司);FTO干扰RNA(si-FTO)、FTO过表达质粒(FTO Over-expression)(上海生工生物工程有限公司);FoxO1抗体(Abcam公司);FoxO1干扰RNA(si-FoxO1)(瑞博生物公司);EpiQuik m6A RNA(甲基化定量检测试剂盒)(Epigentek公司);annexinV-FITC凋亡试剂盒、CCK-8试剂盒(南京凯基生物公司)。
1.2 方法
1.2.1 从基因库检测患者生存期:于TCGA数据库下载并整理(TCGA-GOAD)项目的STAR流程的RNAseq数据,其中Ⅱ期肝癌患者120例,Ⅲ期肝癌患者189例,提取临床数据。用R语言进行统计分析,从而比较不同组织表达的差异水平。使用ggplot2包的视化呈现结果。再使用R语言进行比例风险假设检验,并进行拟合生存回归,分析不同蛋白表达患者的生存预后情况。最后,使用Logrank检验来评估差异的统计显著性。
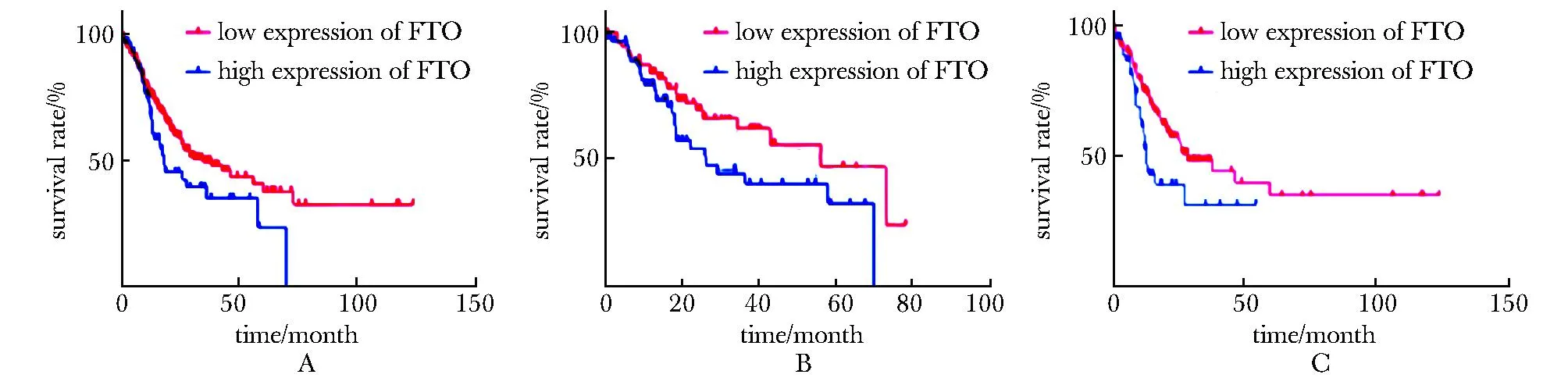
A.TGGA whole survival analysis; B.TCGA Grade Ⅱ survival analysis; C.TCGA Grade Ⅲ survival analysis.
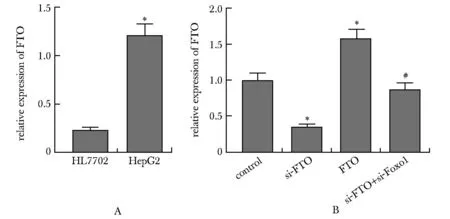
A.comparison of FTO relative expression between HepG2 cells and HL7702 cells; B.comparison of FTO relative expression of each group in HepG2 cells;*P<0.05 compared with HL7702 or control;# P<0.05 compared with si-FTO.
1.2.2 细胞的分组及处理:取对数的HepG2细胞,根据转染试剂盒说明书,分别采用LipofectamineTM2000转染试剂进行质粒转染,将转染FTO Overexpression质粒的细胞设为FTO组,将转染si-FTO的细胞设为si-FTO组,将同时转染si-FTO+si-FoxO1的细胞设为si-FTO+si-FoxO1组,将转染空载体或质粒的细胞设为对照组。每组6个复孔,培养48 h后进行后续实验。
1.2.3 RT-qPCR检测细胞中FTO表达:用TRIzol裂解液裂解HepG2细胞,提取细胞中总RNA,并测定浓度,根据反转录试剂盒说明书,反转录总RNA为cDNA,后进行qRT-PCR扩增。引物序列表见表1。分别取0.5 μL上游引物和0.5 μL下游引物,6 μL SYBR Green Mix,2 μL cDNA,后加入6 μL ddH2O,保证总反应体系为15 μL。PCR反应条件:95 ℃预变性60 s,95 ℃预变性15 s,65 ℃退火10 s,72 ℃延伸15 s,共40个循环。用2-△△Ct法分析相对表达量。
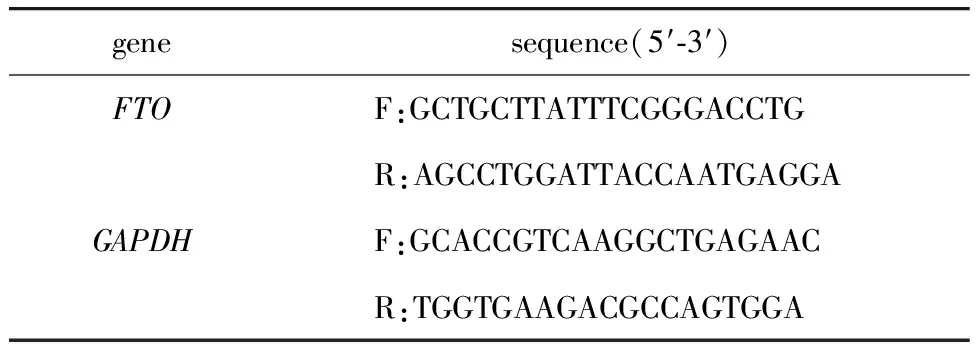
表1 引物序列Table 1 Primer sequencee
1.2.4 CCK-8法检测细胞增殖:每组HepG2细胞以1.5×104个/mL浓度接种于96孔板中,培养孔板于5% CO2、37 ℃的培养箱中,24 h后在每孔中分别加入100 μL的CCK-8溶液培养24、48、72 h,后培养细胞于37 ℃,5% CO2的培养箱3.5 h,后将孔板置于酶标仪上,于450 nm处测定OD值。
1.2.5 Transwell小室法检测细胞侵袭:每组HepG2细胞以1.5×104个/mL密度接种于96孔板中,在Transwell上室中平铺Matrigel胶,在下室加入每组HepG2细胞悬液200 μL,在37 ℃、5% CO2培养箱中孵育,24 h擦掉上室中残留的基质胶,将小室固定于质量分数为4%的甲醛溶液中,10 min后用质量分数为1%的结晶紫染色10 min,显微镜下观察细胞侵袭数目。
1.2.6 流式细胞仪检测细胞凋亡:取处于对数期的HepG2细胞,按照1.5×104个/mL接种细胞于96孔板中培养24 h;分别将1× binding buffer,10 μL annexin V和20 μL PI加入到96孔板中;弃掉原有的培养基,加入配制好的annexin V/PI染色工作液,于常规培养箱孵育孔板。将胰蛋白酶裂解液分别加入到孔板的每孔中,裂解细胞呈悬液后上机检测。
1.2.7 Dot blot检测m6A甲基化水平:在细胞中加入Trizol裂解液,提取细胞中总RNA,用mRNA纯化试剂盒分离mRNA。Nano Drop定量mRNA,于95 ℃变性5 min,后置于冰上。取200 ng的mRNA上样固定在Biodot微孔过滤仪的尼龙膜上,自然风干后取下尼龙膜置于平皿中,用紫外线交联,从而使mRNA和尼龙膜能较好的结合,亚甲蓝染液染色细胞后将浮色用双氧水洗去,拍照后将其作为内参。用5%脱脂奶粉封闭膜2 h,后将其与m6A抗体(1∶1 000)一起在4 ℃孵育过夜。清洗尼龙膜后加入山羊抗兔IgG二抗,在常温环境下孵育1 h。用化学发光成像系统得到m6A点印迹图像。
1.2.8 Western blot检测细胞中FoxO1蛋白表达:用BCA法测定各组细胞中总蛋白质浓度。将终浓度为2 μg/mL的蛋白质样品煮沸,10 min后冷冻于-20 ℃冰箱。取蛋白上样50 μg,将上样缓冲液加入到蛋白质样品中煮沸,将变性的蛋白质样品用SDS-PAGE分离,后转移蛋白质样品于PVDF膜上,加入脱脂牛奶(5%)封闭PVDF膜,1 h后用TBST溶液清洗PVDF膜,将CKS1B的一抗(1∶1 000)添加到反应液中,并在4 ℃的环境中,避光条件下过夜孵育。随后,将二抗(1∶5 000)加入反应液中并继续孵育2 h。使用ECL发光液进行显影和曝光,并使用Image Lab软件对各蛋白质条带进行分析。
1.3 统计学分析
2 结果
2.1 FTO低表达提示肝癌不良预后
肝细胞癌中FTO高表达患者的生存期较短(HR=1.476,P<0.05)。同时通过筛选出120例Ⅱ期肝癌患者和189例Ⅲ期肝癌患者的生存分析,结果同样显示FTO高表达患者生存期更短(Ⅱ期HR=1.58;Ⅲ期HR=1.71,P<0.05)(图1)。
2.2 各组细胞中FTO相对表达量比较
与HL7702细胞相比,HepG2细胞中FTO表达明显升高(P<0.05)(图2A)。和对照组相比,si-FTO组细胞中FTO相对表达量明显降低,FTO组细胞中FTO相对表达量明显升高(P<0.05);和si-FTO组相比,si-FTO+si-FoxO1组细胞中FTO相对表达量明显升高(P<0.05)(图2B)。
2.3 各组细胞增殖能力比较
si-FTO组细胞活性低于对照组,FTO组细胞活性高于对照组(P<0.05);和si-FTO组相比,si-FTO+si-FoxO1组细胞活性明显升高(P<0.05)(图3)。
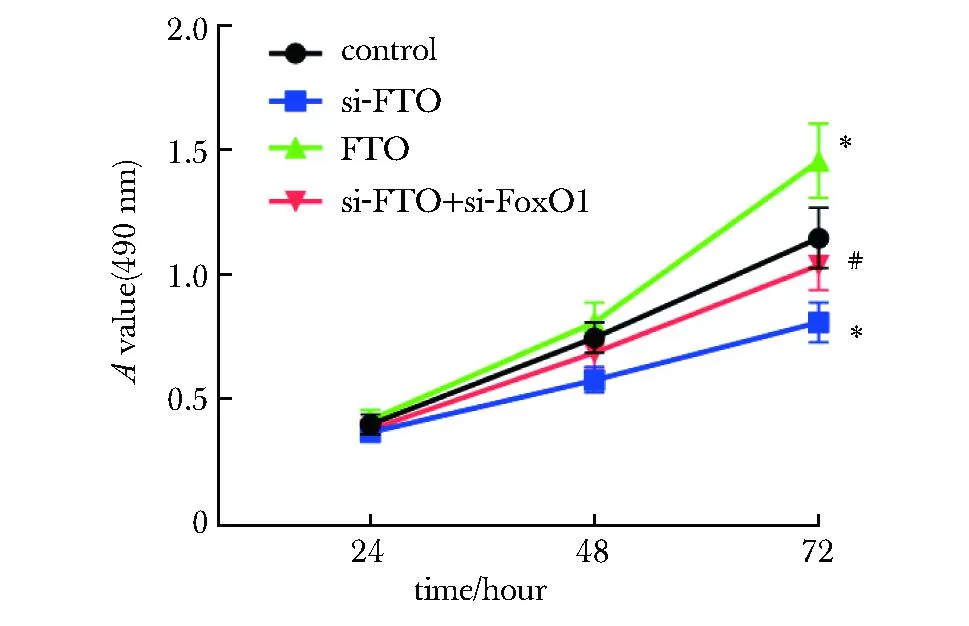
*P<0.05 compared with control;# P<0.05 compared with si-FTO.
2.4 各组细胞侵袭能力比较
和对照组相比,si-FTO组细胞侵袭数目明显降低,FTO组细胞侵袭数目明显增加(P<0.05);si-FTO+si-FoxO1组细胞侵袭数目较si-FTO组明显升高(P<0.05)(图4)。
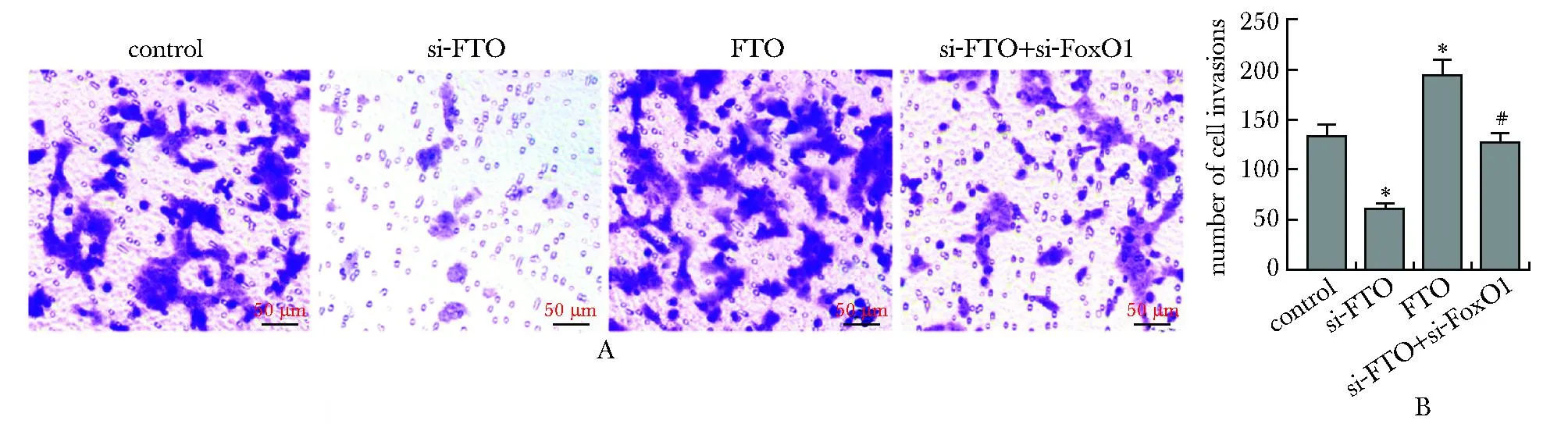
A.cell crystal violet staining; B.compare the number of cell invasions;*P<0.05 compared with control;# P<0.05 compared with si-FTO.
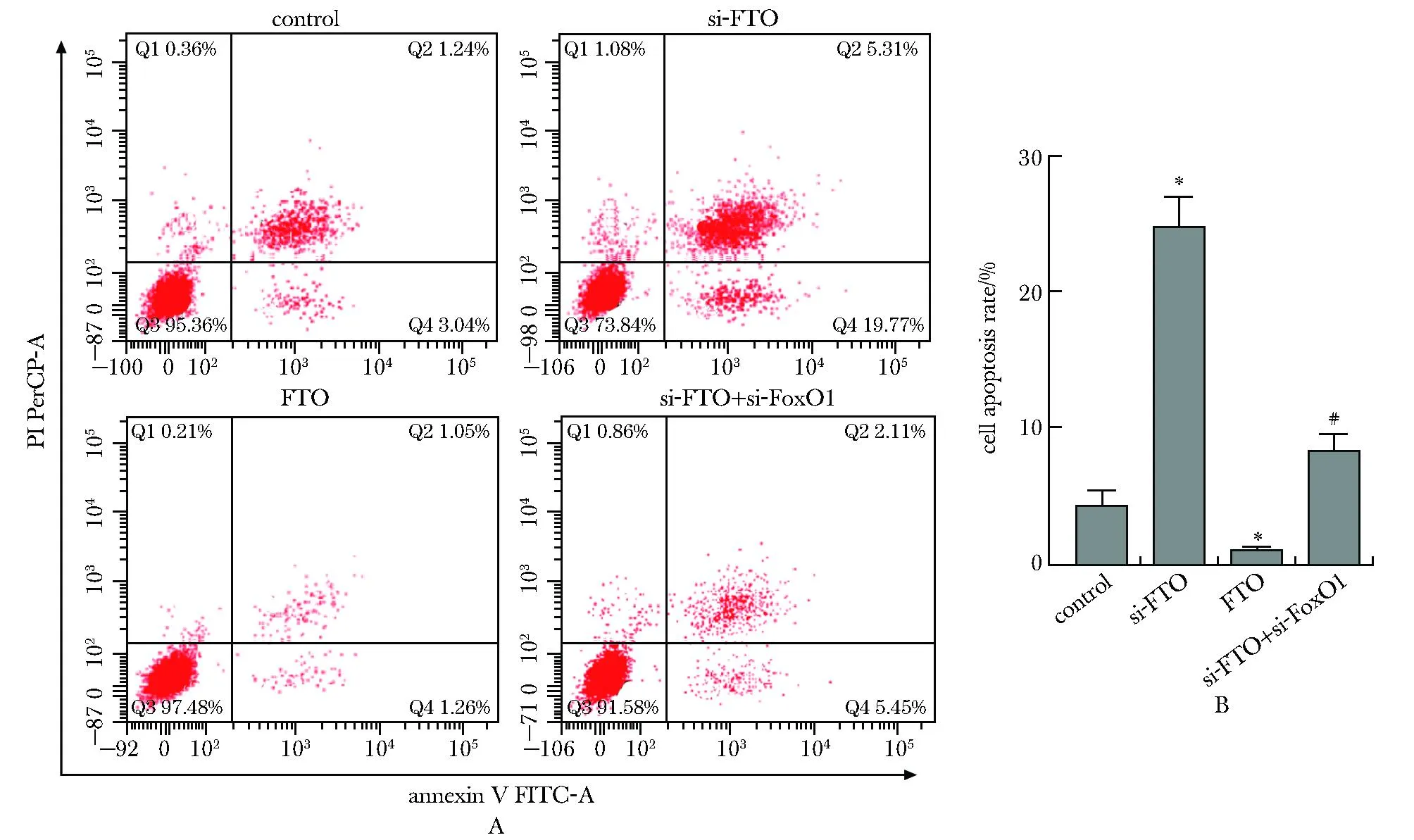
A.flow cytometry was used to detect cell apoptosis; B.comparison of cell apoptosis rates;*P<0.05 compared with control;# P<0.05 compared with si-FTO.

A.comparison of relative levels of m6A in cells; B.Western blot assay of FoxO1 protein in cells; C.comparison of FoxO1 protein expression in cells;*P<0.05 compared with control;# P<0.05 compared with si-FTO.
2.5 各组细胞凋亡率比较
和对照组相比,si-FTO组细胞凋亡率明显增加,FTO组细胞凋亡率明降低(P<0.05);si-FTO+si-FoxO1组细胞凋亡率较si-FTO组明显降低(P<0.05)(图5)。
2.6 各组细胞m6A甲基化水平和FoxO1蛋白表达比较
和对照组相比,FTO组细胞中m6A相对表达量明显升高,FoxO1蛋白表达明显降低(P<0.05);si-FTO组细胞中m6A相对表达量低于对照组,FoxO1蛋白表达高于对照组(P<0.05);和FTO组相比,FTO+si-FoxO1组细胞中m6A相对表达量明显升高,FoxO1蛋白表达明显降低(P<0.05)(图6)。
3 讨论
N6-甲基腺嘌呤(m6A)修饰酶在肿瘤的发生和进展中具有关键的作用,但m6A相关修饰酶是否可以作为肿瘤的诊断标志物还需深入探究[6]。FTO是一种常见的去甲基化酶,在m6A修饰中起着重要作用,其主要功能是将带有m6A修饰的碱基进行去甲基化修饰。FTO基因敲除可增强m6A甲基化水平,反之上调FTO可抑制其甲基化水平。研究发现[7],FTO可参与多种病理生理过程,如RNA的修饰、转录调控和翻译等。胃癌组织中FTO呈高表达,其对胃癌细胞的增殖、侵袭和迁移可发挥促进作用,进而导致胃癌的发生[8];m6A去甲基化酶FTO的蛋白在胃癌患者中低表达,与患者生存期缩短密切相关,其可介导胃癌发生发展[9];敲减FTO表达可抑制肺鳞状细胞癌细胞增殖和侵袭,反之,过表达FTO可对肺鳞状细胞癌的恶性程度发挥促进作用[10]。基于以上研究猜测,FTO在肿瘤中可能发挥促癌作用。本研究结果显示,肝细胞癌中FTO表达明显升高,FTO可能是肝癌进展中的促进因素,但关于FTO如何调节肝癌进展还需进一步探究。
FoxO1作为一种转录因子,在多种组织器官中均广泛表达,可介导多种生物学过程,如细胞凋亡、DNA损伤修复等。FoxO1在多种肿瘤细胞中表达明显降低,如肝癌、乳腺癌等,可发挥抑制作用[11];FoxO1在肝癌中表达明显降低,低表达FoxO1可增加肝癌的风险系数[12]。三氟拉嗪(trifluoperazine,TFP)可通过增加细胞中FoxO1表达对肝癌细胞增殖、侵袭和迁移发挥抑制作用,对细胞周期停滞于G0/G1期和细胞凋亡发挥促进作用[13]。本研究结果显示,过表达FTO可抑制肝癌细胞中FoxO1蛋白表达,抑制FTO可增加肝癌细胞中FoxO1表达, 因此推测抑制FTO可能通过增加肝癌细胞中FoxO1表达而对肝癌细胞活性发挥调控作用。为验证这一猜想,本研究采用si-FTO和si-FoxO1共同转染至肝癌细胞中, 结果显示,敲减FoxO1可减弱低表达FTO对肝细胞癌细胞增殖和侵袭的抑制作用,并促进对肝癌细胞凋亡的作用。
综上所述,高表达FTO与临床预后较差相关,FTO基因敲除可抑制肝细胞癌的增殖和侵袭,诱导肝细胞癌的凋亡,其作用机制可能和调控FoxO1表达有关。另外,本研究设置阴性对照尚不充分,可能使实验结果存在一定的局限性,在今后的研究中会增加相关阴性对照,为临床治疗肝癌提供更可靠的实验数据。

