β-乳球蛋白与红曲色素非共价相互作用及其对色素稳定性的影响
赵 楠, 李秉桓, 宋宇宁, 韩 钊, 武淑芬,*
(1.天津科技大学 食品科学与工程学院, 天津 300457; 2.天津兰瑞生物科技有限公司, 天津 300384)
红曲色素(monascus pigments,Mps)是由红曲霉属的丝状真菌在代谢过程中产生的次级代谢产物,是聚酮类化合物的混合物[1]。目前已被广泛研究和应用的有6种醇溶性Mps,包括两种黄色素,即红曲素(monascin)(Y1)和安卡红曲黄素(ankaflavin)(Y2);两种橙色素,即红斑红曲素(rubropunctatin)(O1)和红曲玉红素(monascorubrin)(O2);两种红色素,即红斑红曲胺(rubropunctamine)(R1)和红曲玉红胺(monascrubramine)(R2)[2]。这些色素分子化学结构相似,不同色素组分通常以混合物的形式存在于发酵产物中。由于分离难度大、成本高,Mps大多以混合物的形式应用于食品工业[3]。Mps通常作为食品着色剂应用于肉制品、调味品、面制品等食品工业,Mps还具有抗炎、抑菌、防腐、抗氧化、抗癌等生理活性[1,4]。然而,Mps对温度和光照敏感,稳定性较差,同时在不同pH值条件下溶解性也存在较大差异,限制了其在食品领域的应用[5-7]。
β-乳球蛋白(β-lactoglobulin,β-LG),是存在于大多数反刍动物乳中的一种球状蛋白质,分子质量为18.3 kDa,由162个氨基酸残基构成,等电点pI约为5.2[8-9]。β-LG也是牛乳清蛋白中的主要成分,其含量大约占乳清蛋白的50%[10]。β-LG是由8个反平行的β-折叠链组成的β-桶状结构,又称calyx结构,该结构易与疏水性小分子结合,是配体结合的潜在位点[11]。研究表明,β-LG与配体之间的结合,不仅受配体自身性质的影响,还受外界环境因素的影响,因为β-LG的结构会随溶液pH值的变化而改变[12]。在生理条件下,反刍动物中的β-LG一般以二聚体形式存在;而当pH值小于3.0时,β-LG主要以单体形式存在;当pH值在3.5~5.5时,β-LG二聚体则转变为八聚体[13];当pH值大于7.4时,β-LG由二聚体解离为单体[14]。借助β-LG独特的构象变化机制,可实现多种疏水活性成分溶解性、稳定性及生物可及性的提高[15-16]。Zagury等[17]制备了表没食子儿茶素没食子酸酯(EGCG)与β-LG复合物,显著提高了EGCG的稳定性、抗氧化活性及体内生物利用度。Abdollahi等[18-19]分别研究了香草酸在酸性(pH值为2.4)和中性(pH值为7.2)条件下与β-LG的相互作用,为香草酸在酸性食品和中性乳制品中的应用提供了理论参考。Wang等[20]探究了在pH值为7.0和8.1的条件下,β-LG与番茄红素之间的结合情况,发现当pH值为8.1时,配合物具有更稳定的结构。Zhu等[21]发现,β-LG与芹菜素在pH值为6.2时形成的复合物亲和力强且稳定性高。
蛋白质与小分子之间的相互作用会影响食品的风味、颜色和营养功能的变化,以蛋白质作为载体可用于改善食品功能因子的物理性质,同时使复合物表现出更优的生理活性[22-23]。β-LG是一种很好的生物大分子载体,Mps作为一种脂溶性小分子,其光和热不稳定性限制了其在食品领域的应用,目前有关β-LG作为壁材包载Mps的研究尚未见报道。本研究拟在不同pH值条件下,研究 β-LG 与Mps之间的相互作用,利用荧光光谱和圆二色谱,分析β-LG与Mps的结合行为,并采用分子对接技术探究β-LG与Mps的结合机制,对β-LG&Mps复合物的抗氧化活性、热稳定性和光稳定性进行评价。本研究旨在为增强Mps的稳定性,拓宽Mps应用领域提供理论参考。
1 材料与方法
1.1 材料与试剂
β-乳球蛋白(β-LG)、1,1-二苯基-2-苦基肼(DPPH),上海源叶生物科技有限公司;Mps提取物(1 031.25 U/g),实验室自制;无水乙醇,天津市江天化工技术股份有限公司;无水磷酸氢二钠、无水磷酸二氢钠,上海易恩化学技术有限公司;盐酸,国药集团化学试剂有限公司。实验所用试剂均为分析纯,所有试剂配制及实验用水均为超纯水。
1.2 仪器与设备
SQP型天平,赛多利斯科学仪器(北京)有限公司;SevenEasy型实验室pH计,梅特勒-托利多仪器(上海)有限公司;UV-Vis型紫外-可见分光光度计,美国安捷伦公司;F-2500型荧光分光光度计,日本日立公司;MOS-450型圆二色谱仪,法国Bio-Logic公司;Infinite M200 PRO型酶标仪,瑞士Tecan公司;DF-101S型集热式磁力加热搅拌器,江苏金怡仪器科技有限公司;HPG-280HX型人工气候箱,哈尔滨市东联电子技术开发有限公司;TES-1339型照度计,泰仕电子工业股份有限公司。
1.3 实验方法
1.3.1β-LG与Mps复合物的制备
1) β-LG溶液制备。准确称取10 mg的β-LG粉末,分别溶于0.1 mol/L pH值为2.6、6.2、7.1、8.2的磷酸盐缓冲液(PBS)中,在室温条件下涡旋1~2 min,使其充分溶解,置于4 ℃冰箱过夜,使蛋白质充分水合。依据β-LG的消光系数(ε278 nm=17.6 mol·mL-1·cm-1)[21],对β-LG溶液进行稀释,即得到浓度为100 μmol/L的β-LG溶液,置于4 ℃ 冰箱待用。
2) Mps溶液制备。称取一定量的Mps粉末,溶于无水乙醇中,在室温下涡旋1~2 min,超声处理2~3 min,搅拌至充分溶解,得到质量浓度为6.4 mg/mL的色素母液,避光保存、待用。
3) β-LG和Mps混合溶液制备。分别取β-LG溶液与Mps溶液混合,得到pH值为2.6、6.2、7.1、8.2的混合溶液,使得β-LG的终浓度固定为10 μmol/L,Mps的终质量浓度为0.004、0.008、0.016、0.032、0.064 mg/mL。将配制好的溶液混合均匀,室温下静置30 min,待二者充分结合后进行测定。各体系中无水乙醇体积分数不超过3%,以消除乙醇对蛋白质的诱导变性[24]。
1.3.2β-LG荧光光谱测定
在室温条件下,使用荧光分光光度计测定蛋白的荧光光谱,记录随着pH值与Mps质量浓度的改变,β-LG内在荧光光谱的变化情况。设定激发波长为295 nm,扫描波长为300~450 nm,激发和发射狭缝宽度均为2.5 nm。以不含β-LG的同等质量浓度的Mps溶液体系的荧光光谱作为背景,以扣除Mps自身荧光光谱的干扰。
1.3.3β-LG二级结构含量测定
用圆二色谱仪在室温下分别分析不同pH值和不同Mps质量浓度条件下β-LG二级结构含量变化情况。β-LG溶液的浓度固定为10 μmol/L,Mps质量浓度设定为0.004 mg/mL和0.032 mg/mL。测量波长为200~260 nm,石英比色皿厚度为0.1 cm, 步长1 nm。所有样品扫描3次取平均值。利用CDNN软件对圆二色谱数据进行处理,计算β-LG各二级结构的相对含量。
1.3.4分子对接
β-LG的晶体结构分别从PDB(蛋白质数据库)(http:∥www.rcsb.org)下载,pH值为2.6、6.2、7.1、8.2混合溶液的PDB编号依次为1DV9、3BLG、1BSY和2BLG[21]。通过AutoDock软件对β-LG进行加氢、去除水分子等处理以生成不同pH值的β-LG的PDBQT文件。Mps分子的3D结构从小分子数据库(https:∥pubchem.ncbi.nlm.nih.gov/)下载,其中R2的分子结构需要利用ChemBioDraw软件绘图后,再通过Chem 3D软件生成3D结构,然后对其进行能量最小化处理,并用OpenBabel软件进行格式转换,生成可供对接的PDBQT文件。利用AutoDock vina软件进行盲对接,并用Pymol和Discovery Studio 2017 R2 Client软件进行可视化分析。
1.3.5抗氧化活性测定
参考赵焕焦[10]的方法,稍加修改。称取3.95 mg 的DPPH粉末溶解于100 mL的无水乙醇中,配制成浓度为100 μmol/L的DPPH工作液。按照1.3.1中方法制备β-LG&Mps溶液,使复合物体系中β-LG的终浓度为10 μmol/L,Mps终质量浓度分别为0.004、0.008、0.016、0.032、0.064 mg/mL。 避光静置20 min,使二者充分反应,然后向样品组加入100 μL的DPPH工作液,对照组加入100 μL的无水乙醇,空白组以相应PBS代替样品,混匀后避光反应30 min,使用酶标仪于517 nm处测定吸光度值,并根据式(1)计算DPPH自由基清除率。

(1)
式(1)中,A0为空白组的吸光度,A1为对照组的吸光度,A2为样品组的吸光度。
1.3.6热稳定性分析
按照1.3.1中方法制备β-LG&Mps复合物溶液,使复合物体系中β-LG终浓度为40 μmol/L,Mps终质量浓度为0.048 mg/mL。量取2 mL样品溶液,分别置于4 ℃冰箱,于25 ℃和50 ℃磁力加热搅拌器内避光孵育。以相同质量浓度的Mps溶液作为对照,每间隔2 h取样一次,测定样品在410 nm处的吸光度(An)。每个样品设置3组平行,取平均值进行计算。将每组样品的初始吸光度记为A初,保留率设为100%,按式(2)进行计算。

(2)
式(2)中,An为第n小时吸光度,A初为样品初始吸光度。
1.3.7光稳定性分析
按照1.3.1中方法制备β-LG&Mps溶液,使复合物体系中β-LG终浓度为40 μmol/L,Mps终质量浓度为0.048 mg/mL。量取2 mL样品溶液,分别置于25 ℃,光照强度为600 Lux和避光条件下孵育。以相同质量浓度的Mps溶液作为对照,每间隔12 h取样一次,测定样品在410 nm处的吸光度。每个样品设置3组平行,取平均值进行计算。将每组样品的初始吸光度记为A初,保留率设为100%,按式(2)进行计算。
1.4 数据处理
采用Excel 2010软件进行数据处理,用Origin 2022软件对数据进行分析和绘图。所有实验设置3个平行,重复测定2次,结果用平均值±标准差表示,并用IBM SPSS Statistics 26.0软件进行显著性分析,P<0.05表示差异显著。
2 结果与讨论
2.1 不同pH值条件下Mps与β-LG结合行为分析
2.1.1Mps的结合对β-LG内源荧光光谱的影响
由于蛋白质内源荧光易受蛋白分子微环境的影响,因此可通过测定蛋白质荧光强度的变化,来推断蛋白质是否与小分子之间发生了结合作用。对不同pH值、不同Mps质量浓度条件下β-LG内源荧光光谱的分析结果如图1。由图1可知,当激发波长为295 nm时,β-LG在337 nm附近有强吸收峰,且随着Mps质量浓度的增加,β-LG的固有荧光强度逐渐降低,在4个实验pH值范围内均发生了荧光猝灭,这表明Mps和β-LG之间发生了相互作用。此外,不同pH值条件下β-LG固有荧光性质不同。当pH值由2.6提高到8.2时,β-LG自身荧光强度增大,这表明β-LG所处微环境的极性改变,荧光发色基团由亲水环境向疏水环境转移[25]。同时,随着Mps质量浓度增大,β-LG的荧光强度逐渐降低,在Mps质量浓度增大到0.064 mg/mL时,Mps对β-LG荧光猝灭强度可通过猝灭率表示,见式(3)。
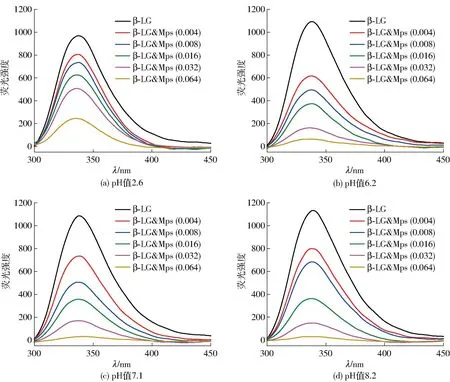
β-LG为10 μmol/L,Mps后括号内数字表示Mps质量浓度,单位为mg/mL。

(3)
式(3)中,A0和A1分别为β-LG和β-LG&Mps的荧光强度最大值。
根据式(3)计算,在不同pH值条件下,Mps对β-LG的猝灭率分别为74.7%(pH值2.6),94.2%(pH值6.2),97.2%(pH值7.1)和97.4%(pH值8.2)。这可能与β-LG在不同pH值条件下的结构存在差异有关[26]。
2.1.2Mps的结合对β-LG二级结构的影响
圆二色谱被广泛应用于蛋白质二级结构的分析。为了进一步分析在不同pH值条件下Mps的结合对β-LG二级结构的影响,测定了在4个实验pH值范围内,β-LG同Mps结合前后的圆二色谱,如图2。由图2可见,圆二色谱在216 nm处有一个大的负峰,这是β-折叠结构的特征峰,表明β-LG主要是由β-折叠组成的蛋白质[27]。随着Mps的加入,负峰强度有所降低,使β-LG的二级结构发生轻微变化,但谱图中的峰形没有明显改变,说明β-LG与Mps结合后仍保持较为稳定的结构。
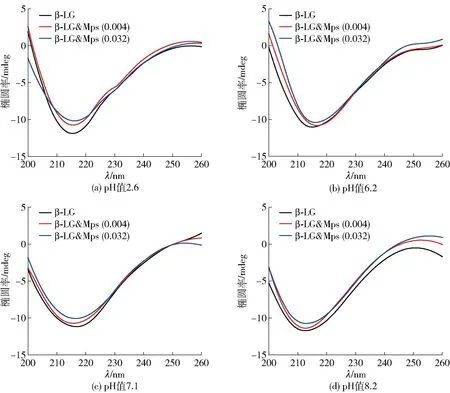
β-LG为10 μmol/L,Mps后括号内数字表示Mps质量浓度,单位为mg/mL。
为了进一步量化蛋白质二级结构含量,通过CDNN软件对样品的二级结构进行计算,结果如表1。当β-LG与Mps结合后,α-螺旋含量略有降低,β-折叠含量增加,且β-转角和无规则卷曲含量变化不大。这表明与Mps结合后,β-LG的结构没有发生显著改变,即没有明显松弛或展开[21,28]。
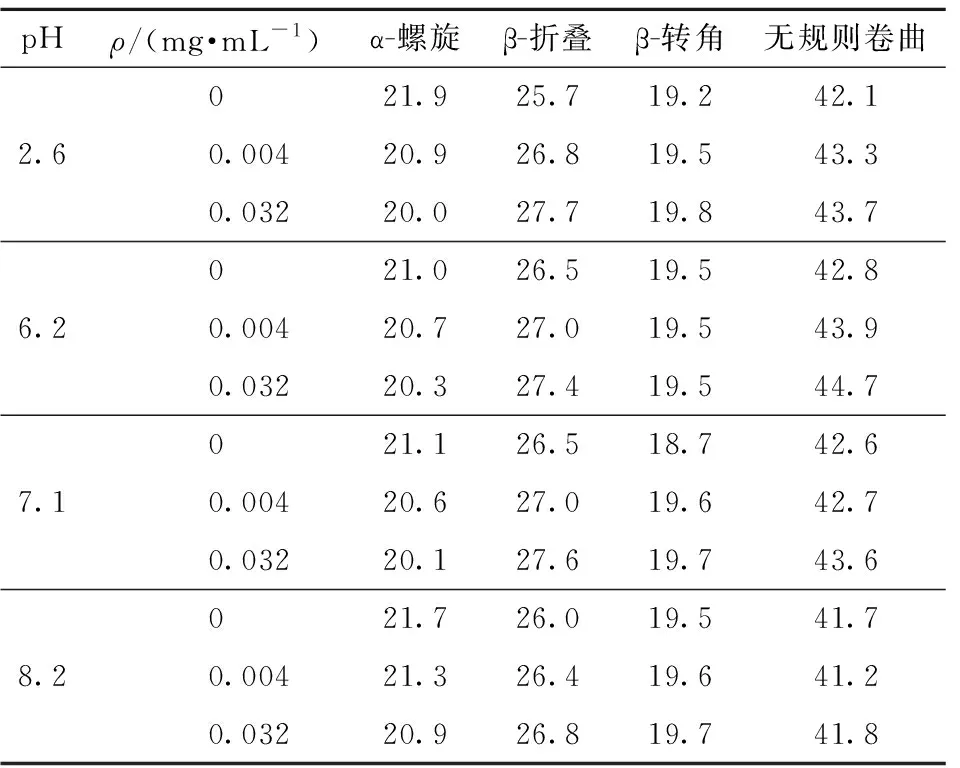
表1 不同pH值条件下Mps添加对β-LG二级结构的影响
2.1.3Mps与β-LG分子对接结果分析
据报道,β-LG上存在4个潜在的活性位点,供其与配体结合,包括β-桶状结构的内部疏水空腔、α-螺旋和β-桶状结构之间的表面疏水口袋、靠近Trp19至Arg124处的外表面以及二聚体界面[21, 29]。而PDB中所下载的β-LG的晶体结构并不包含配体的结构信息,无法确定其最佳结合位点。因此,为了预测6种Mps分子在β-LG上的结合位点,采用盲对接方式进行模拟分析。在利用AutoDock vina软件运行20次对接后,生成的Mps分子构象按照对接结合能的大小进行排序,在每个pH值下选择结合能最低的对接构象来预测其结合位点。6种Mps分子和β-LG分子的结构及对接结果如图3至图7。

图3 6种Mps分子和β-LG分子结构Fig.3 Structure of six Mps and β-LG
由图4(a)至图7(a)可知,在同一pH值条件下,6种Mps分子与β-LG的同一区域相结合,这可能是因为Mps分子结构具有相似性。从图4(a)可知,在pH值为2.6时,EF Loop处于闭合状态,6种Mps分子主要结合在D链和E链附近的外表面。由图5(a)可知,在pH值为6.2时,EF Loop仍处于闭合状态,6种Mps分子主要结合在A链和B链附近的外表面,这表明β-LG 结构中Trp19至Arg124附近的外表面是6种Mps分子结合的一个主要位点。而当pH值大于7.0时,EF所形成的Loop打开,使得配体能够进入疏水空腔内的结合位点[25]。由图6(a)和图7(a)可知,在pH值为7.1和8.2时,6种Mps分子主要结合在β-桶状结构的开口端位置,这表明在中性以及偏碱性环境中,β-桶状结构的疏水空腔是6种Mps分子的主要结合位点。图4(b)至图7(b)分别显示了β-LG的氨基酸残基与Mps分子结合的相互作用力。在不同pH值条件下,6种Mps分子与β-LG的结合区域相互靠近,而参与结合作用的氨基酸残基不同,同时维持复合物的相互作用力均涉及范德华力、疏水相互作用和氢键。由图4(b)可见,在pH值为2.6时,只有一种Mps分子即R2与β-LG的Leu87形成了一个碳氢键;由图5(b)可见,在pH值为6.2时,每种Mps分子均与β-LG之间形成氢键,参与氢键形成的主要氨基酸有Gly52、Lys75、Thr76和Lle12等;由图6(b)可见,在pH值为7.1时,除了O1未与β-LG形成氢键,其他分子均形成2个以上氢键,参与氢键形成的主要氨基酸残基有Asn109、Asn90和Asn88等;由图7(b)可见,在pH值为8.2时,Mps分子与β-LG之间形成的氢键数量为1~4个,参与结合的氨基酸残基有Asn88、Asn90、Ser116、Lys69和Lys60。除了氢键以外,疏水相互作用也是主要驱动力,包括烷基、π-烷基、π-σ等。本研究结果表明,β-LG 与Mps之间能够形成非共价复合物,且Mps能够结合到β-LG的疏水空腔上,但在pH值为2.6条件下形成的氢键数量较少,而在pH值为6.2、7.1、8.2条件下形成的氢键数量较多,这可能对复合物的稳定性产生影响。
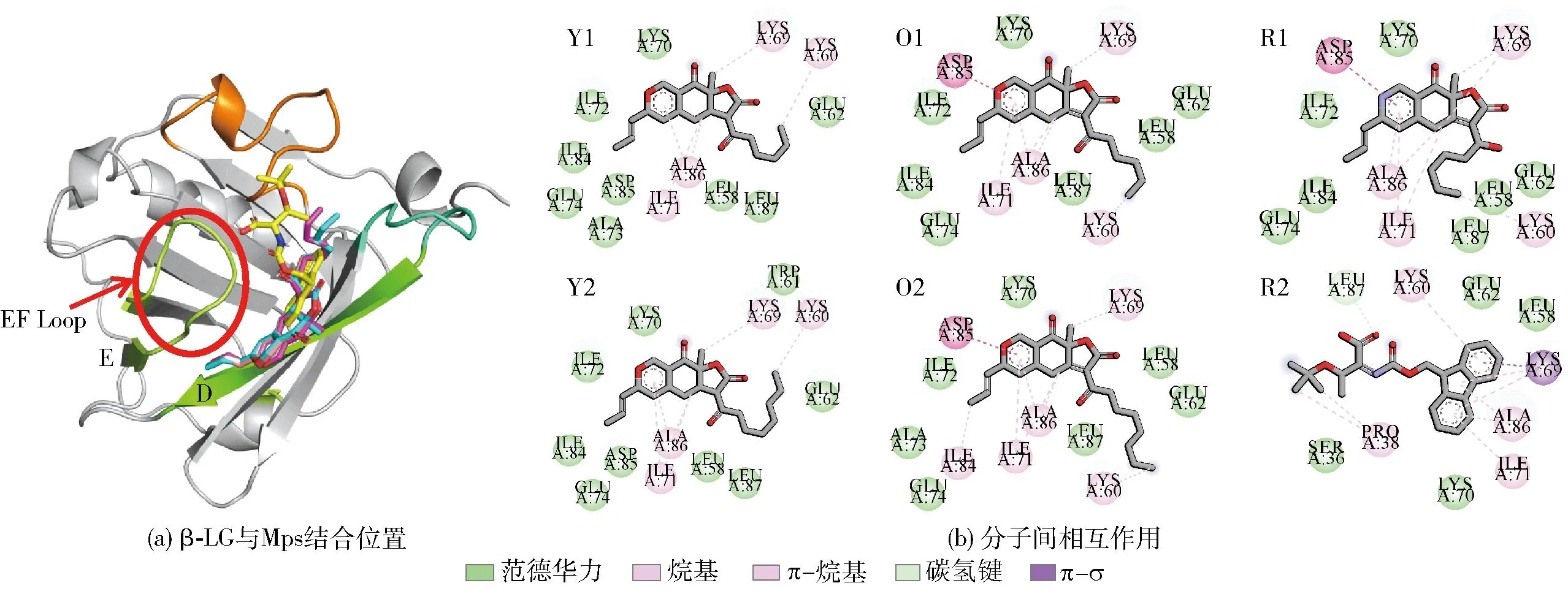
图4 pH值为2.6时6种Mps分子与β-LG分子的对接结果Fig.4 Docking results of β-LG with six Mps at pH 2.6

图5 pH值为6.2时6种Mps分子与β-LG分子的对接结果Fig.5 Docking results of β-LG with six Mps at pH 6.2
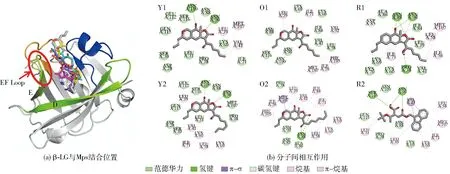
图6 pH值为7.1时6种Mps分子与β-LG分子的对接结果Fig.6 Docking results of β-LG with six Mps at pH 7.1
2.2 不同pH值条件下β-LG&Mps的抗氧化性及稳定性分析
2.2.1抗氧化性分析
DPPH在乙醇溶液中呈现紫色,在517 nm处有特征吸收峰,当存在抗氧化活性成分时,其溶液颜色变浅,吸光度值降低,表明DPPH自由基被部分清除。因此,通过测定DPPH吸光值可对样品的抗氧化能力进行定量分析。分别测定了pH值为2.6、6.2、7.1和8.2时,β-LG与Mps及二者复合后对DPPH自由基的清除能力,实验结果如图8。由图8可见,在相同蛋白浓度、不同pH值条件下,β-LG(10 μmol/L)的DPPH自由基清除率分别为13%、19%、22%和16%,表明β-LG在中性环境中清除DPPH自由基的能力更强。随着复合物中Mps质量浓度从0.004 mg/mL增加到0.064 mg/mL,复合物的抗氧化能力也显著增强(P<0.05),并呈浓度依赖性,这表明高质量浓度的Mps,对复合物DPPH自由基清除能力的影响更为显著。
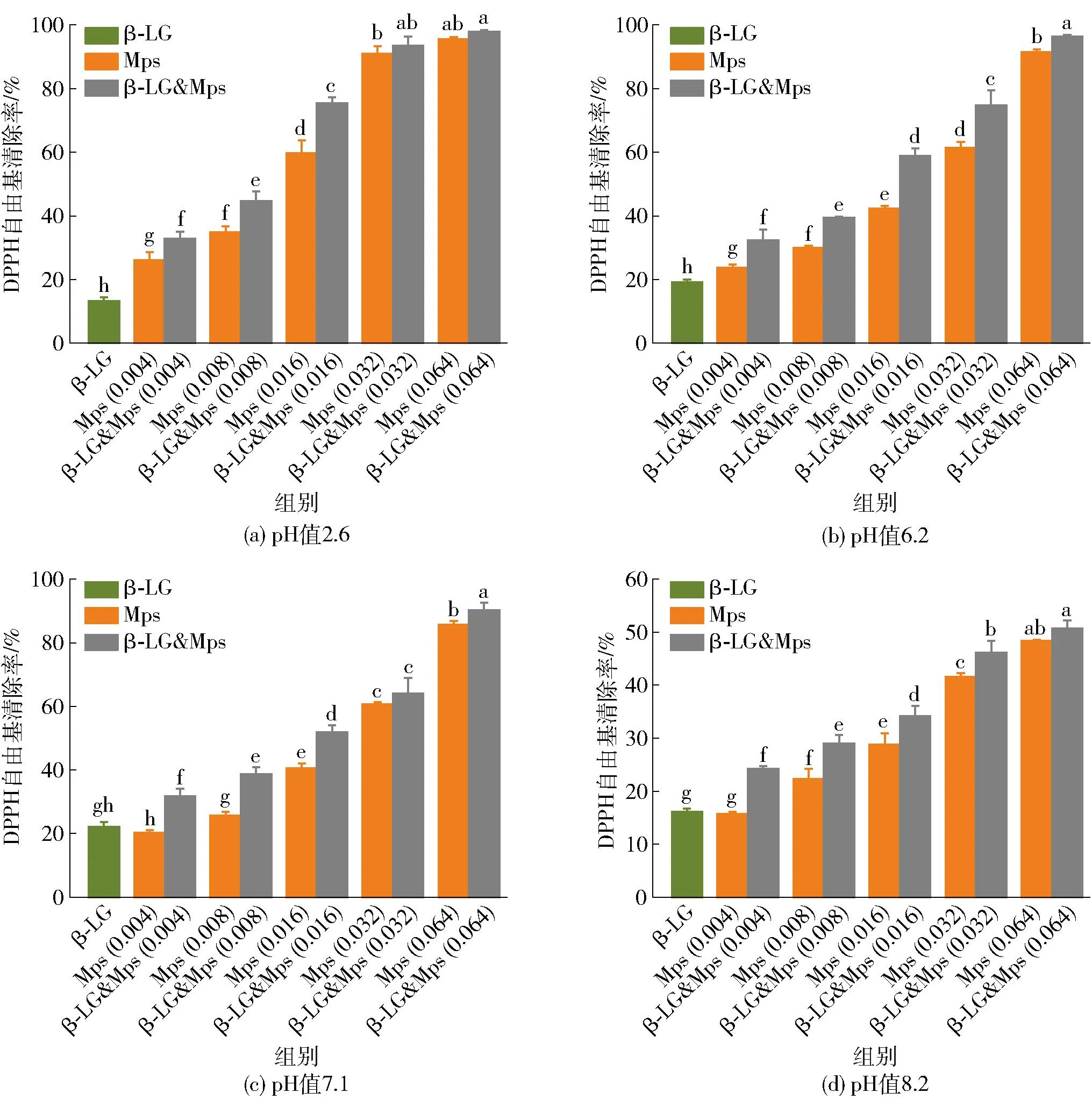
β-LG为10 μmol/L,Mps和β-LG&Mps后括号内数字表示Mps质量浓度,单位为mg/mL。不同小写字母表示DPPH自由基清除率差异显著(P<0.05)。
当Mps质量浓度达到0.064 mg/mL,在pH值为6.2和7.1时,复合物的DPPH自由基清除能力显著高于未复合的Mps(P<0.05);而在pH值为2.6和8.2时差异不显著(P>0.05)。这表明,复合物抗氧化能力的强弱主要与Mps自身抗氧化能力密切相关。在pH值为2.6、6.2和7.1时,复合物的DPPH自由基清除率达到了90%以上,而在pH值为8.2时,复合物的自由基清除率为51%。这可能是由于Mps中红色素和橙色素具有很强的抗氧化活性,对DPPH自由基的清除能力要强于黄色素组分,而在弱碱性环境中,红色素和橙色素在高pH值条件下自身结构不稳定,黄色素较为稳定[30-31]。虽然复合物的抗氧化能力比单独的β-LG和相应质量浓度的Mps强,但小于两者抗氧化能力的总和,表明两者之间产生了拮抗作用,这可能是由于Mps分子结构中的某些基团与β-LG发生非共价相互作用,从而使复合物的抗氧化能力减弱[32]。
2.2.2热稳定性分析
由于Mps中红、橙、黄色素都在400 nm左右有较高的吸光值,通常选用410 nm处的吸光度来表示色素浓度[31]。本实验通过测定410 nm处吸光度值的变化来计算Mps的保留率,以此对热稳定性进行评价。测定了4、25、50 ℃时,复合物中的Mps和未复合的Mps保留率,实验结果如图9。由图9可知,在不同pH值条件下,复合物中Mps的保留率均高于未复合的Mps,这表明Mps与β-LG复合后热稳定性的提高。由图9(a)可知,在pH值为2.6,温度为4 ℃和 25 ℃ 时,复合物中的Mps和未复合的Mps在10 h内均发生快速降解,复合物中Mps的保留率为59.1%和54.3%,未复合的Mps的保留率则为36.3%和32.7%。
由图9(a)和(b)可知,在温度为50 ℃,pH值为2.6或6.2时,复合物在前2 h内发生快速降解,随着加热时间延长,吸光度值变大,保留率增加。这可能是由于在强酸条件下,Mps发色团遭到破坏,结构发生变化,从而使溶液的颜色发生转变[33],导致吸光度增大。这表明,色素在酸性条件下不稳定,该结果与分子对接结果一致。图4(b)的分子对接结果显示,在pH值为2.6时,Mps与β-LG形成非共价复合物时生成的氢键数量较少,这使得复合物的稳定性较差,因而形成的复合物对Mps的保护作用较弱。由图9(b)、(c)、(d)可知,在pH值为6.2、7.1、8.2时,温度为50 ℃的条件下,复合物中Mps的保留率均高于未复合的Mps,分别提高了58%、30%和24%,这表明Mps与β-LG复合后热稳定性提高,在 10 h 内几乎没有损失。由图9(b)可知,对于未复合的Mps,在pH值为6.2时,3个温度下均发生快速降解,4 ℃和25 ℃下保留率在60%左右,50 ℃下保留率为42%;由图9(c)和(d)可知,在pH值为7.1和8.2时,4 ℃下的保留率能够保持在90%以上,而25 ℃和50 ℃加热条件下,Mps的稳定性虽然没有在4 ℃时的稳定性好,但保留率也能够保持在70%以上。因此,本研究表明,Mps能够在接近中性环境下与β-LG形成稳定的非共价复合物,且热稳定性良好。
2.2.3光稳定性分析
测定了Mps与β-LG复合前与复合后的光稳定性,设定光照条件为600 Lux和避光,温度为25 ℃,实验结果如图10。由图10可知,在光照强度为 600 Lux 条件下,未复合的Mps在12 h内快速降解。随着时间的延长,在光照60 h,Mps的保留率分别下降至16.8%、22.1%、31.7%和39%,这表明Mps在光照条件下不稳定。避光条件下未复合的Mps的保留率虽高于光照条件,但都低于复合物中Mps的保留率,说明复合物的形成可改善Mps的光不稳定性。

图10 不同pH值和光照条件下Mps及β-LG&Mps的稳定性变化Fig.10 Stability of Mps and β-LG&Mps under different light conditions at different pH values
由图10(b)、(c)、(d)可知,在pH值为6.2、7.1、8.2时,复合物中Mps在避光和光照条件下损失较少,仍具有较高的保留率。由图10(b)、(c)、(d)可知,在光照36 h后,复合物中Mps的保留率分别提高了65%、43%和43%。对于复合物中的Mps,在pH值为6.2、7.1和8.2时,放置36 h后,保留率增大这一现象,可能是由于长时间放置,复合物溶液的颜色发生变化,较刚反应时颜色偏红;随着pH值的升高,颜色转变更为明显,这可能是由于混合物中橙色素的内酯键断裂以及生色团上的共轭双键发生重排导致的[31]。陈莎等[34]对红曲橙、黄色素稳定性的研究发现了相似的现象,在pH值为5~9时,红曲黄色素和红曲橙色素的颜色较pH值为 2~4时明显偏红。有研究发现,pH值大于6的环境,有助于使红曲橙色素发生亲氨反应生成红曲红色素[35-36]。总体而言,非共价复合物的形成对Mps的光稳定性起到了有效的保护作用。
3 结 论
本研究表明,在实验的pH值范围内,β-LG与Mps之间可以通过非共价相互作用形成稳定的复合物。Mps所引起的β-LG内源荧光猝灭,证实了β-LG&Mps的形成,Mps与β-LG的相互作用使β-LG的二级结构发生轻微变化,且两者主要借助范德华力、疏水相互作用以及氢键进行非共价结合。与未复合的Mps相比,复合物中Mps的热稳定性和光稳定性均显著提高。本研究结果旨在为Mps稳态化研究提供理论依据,为基于β-LG的Mps产品在功能性食品开发中的应用提供有益参考。后期可利用β-LG为载体,通过单因素实验优化形成复合物的条件,并对复合物的其他功能特性进行探究,为提高色素的生物利用度提供理论支撑。

