大河乌猪火腿中新型α-葡萄糖苷酶抑制肽的分离、鉴定及活性研究
王道滇, 魏光强, 陶继芳, 李 祥, 赵兴文, 黄艾祥,*
(1.云南农业大学 食品科学技术学院, 云南 昆明 650201;2.云南东恒经贸集团有限公司, 云南 曲靖 655000;3.大理农林职业技术学院 食品工程学院, 云南 大理 671000)
糖尿病主要通过口服阿卡波糖、磺脲类和双胍类药物进行治疗。然而,长期服用阿卡波糖等α-葡萄糖苷酶抑制剂会使患者出现肝损伤和肠绞痛等副作用[1]。食源性α-葡萄糖苷酶抑制肽因较高的酶亲和力、特异性、低免疫原性和低毒性备受关注[2]。目前,许多研究已经从各种食品中分离和鉴定出α-葡萄糖苷酶抑制肽。例如:Zhao等[3]从牛乳酪蛋白中鉴定出4条α-葡萄糖苷酶抑制肽;Hu等[4]从米糠皮中鉴定到一条稳定性较好的α-葡萄糖苷酶抑制肽GLLGY;Yang等[5]利用分子对接筛选技术,从热压榨花生粕蛋白中鉴定出4条α-葡萄糖苷酶抑制肽。同时,也有从干腌肉制品中分离和鉴定α-葡萄糖苷酶抑制肽的研究。例如Mora等[6]从伊比利亚干腌火腿中鉴定出2条α-葡萄糖苷酶抑制肽,黄晶晶等[7]从皖浙花猪干腌火腿中鉴定出3条α-葡萄糖苷酶抑制肽。这说明干腌火腿可能是天然α-葡萄糖苷酶抑制肽的来源。目前,干腌火腿α-葡萄糖苷酶抑制肽的制备、鉴定和活性机制表征方面的相关研究较少,有待进一步加强;而且,不同的原料、加工环境及加工工艺都可能导致火腿肽谱及其生物活性的不同。因此,有必要对干腌火腿中肽的α-葡萄糖苷酶抑制活性进行深入研究,以提供更多、更高抑制活性的α-葡萄糖苷酶抑制肽,扩大α-葡萄糖苷酶抑制肽的来源。
大河乌猪是由云南本地的大河猪与“杜洛克”公猪杂交育成的国家级新品种猪,2003年被授予国家农产品地理标志产品(产品编号:AGI01438)[8]。目前,大河乌猪已被用于云南传统干腌火腿的加工。前期研究,我们通过代谢组学明确了大河乌猪火腿的脂肪酸谱和特征风味物质,结果表明,大河乌猪火腿具有比三元杂交猪火腿更好的风味品质和滋味口感[9]。然而,大河乌猪火腿中是否存在生物活性肽尚不清楚,进一步探究大河乌猪火腿的肽谱,进行大河乌猪火腿中α-葡萄糖苷酶抑制肽的挖掘和活性机制研究,对于完善大河乌猪火腿品质的研究具有重要意义。
肽的分离和纯化是一个复杂而耗时的过程。采用计算机辅助设计、在线数据库比对、分子对接技术和构效关系等生物信息学分析方法,结合体外和体内实验,不仅能快速、高效、低成本地筛选出具有潜在生物活性的肽序列,还可以从分子结构层面揭示肽的活性机制[10-13]。本研究拟采用超滤分离的方法,从大河乌猪火腿中制备不同分子质量的火腿肽,测定其α-葡萄糖苷酶抑制活性,采用液相色谱-串联质谱(liquid chromatography-tandem mass spectro-metry,LC-MS/MS)结合生物信息学分析方法挖掘出大河乌猪火腿中新型的α-葡萄糖苷酶抑制肽,探究其稳定性和分子作用机制,以期为大河乌猪火腿肽的进一步开发提供理论参考。
1 材料和方法
1.1 材料与试剂
大河乌猪火腿[(10±1) kg],云南东恒经贸集团有限公司提供。甲醇、乙腈、甲酸,德国默克公司;α-葡萄糖苷酶(700 000 U/mL),上海源叶生物科技有限公司;对硝基苯基-β-D-吡喃葡萄糖苷(PNPG),上海宝曼生物科技有限公司;邻苯二甲醛(o-phthalaldehyde,OPA),上海易恩化学技术有限公司;胰酪蛋白胨,美国Sigma-Aldrich公司;硼砂,天津市瑞金特化学品有限公司;哌啶(6-氢吡啶),西陇科学股份有限公司;树脂,吉尔生化(上海)有限公司;二氯甲烷、N,N-二甲基甲酰胺、吡啶,上海强盛化工有限公司;氨基酸,南京肽业生物科技有限公司;N,N-二异丙基乙胺、二异丙基碳二亚胺,苏州昊帆生物股份有限公司;β-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),国药集团化学试剂有限公司;胃蛋白酶、胰蛋白酶,北京索莱宝科技有限公司;盐酸、氢氧化钠,天津风船化学试剂科技有限公司。以上试剂除甲醇、乙腈、甲酸为色谱纯外,其他试剂均为分析纯。
1.2 仪器与设备
SCIENTZ-18N/A型真空冷冻干燥机,上海比朗仪器制造有限公司;Millipore UFSC40001型超滤装置,上海羽令过滤器材有限公司;Synergy H1型酶标仪,美国Biotek公司;Q-Exactive型四极杆质谱仪、Easy-nLC 1000型液相色谱仪,赛默飞世尔科技公司;竖行玻璃反应器,上海积坤化工科技有限公司;Nano型高效液相色谱仪,上海赛梵科分离技术有限公司;Inertsil ODS-SP型液相色谱柱(4.6 mm×250 mm,5 μm),岛津(上海)实验器材有限公司;DAISOPAK型C18制备柱(250 mm×30 mm,8 μm),江苏智润科技有限公司。
1.3 实验方法
1.3.1大河乌猪火腿的制备
参照Wei等[9]的方法制备大河乌猪火腿。将8月龄猪的新鲜后腿,在温度为3 ℃,相对湿度为85%的环境下预冷排酸18 h,修割整形。在温度为3 ℃,相对湿度为85%的环境下,按每只鲜腿质量的5.5%称取食盐,上盐腌制18 d。在温度为 8 ℃,相对湿度为55%的环境中进行60 d的脱水平衡,最后在温度为23 ℃、相对湿度为75%的环境下,进行360 d的发酵产香,得到成熟火腿。将成熟火腿的半膜肌和股二头肌按1∶1的比例混合进行取样,真空包装,并保存在-20 ℃以备后续实验用。
1.3.2肽的提取和肽含量测定
火腿肽的提取参照Mora等[14]的方法略加修改。取制备的火腿,剔除脂肪、剪碎,用液氮充分研磨为火腿粉末。称取50 g火腿粉末于200 mL 0.01 mol/L HCl中冰浴10 min,均质匀浆3次,离心(4 ℃、8 000 r/min,30 min)。在上清液中加入3倍体积的甲醇溶液,4 ℃环境中冷藏20 h,再次离心除去蛋白质,收集上清液。将上清液经0.45 μm油系膜过滤、旋蒸去除甲醇溶液,得到粗肽提取液。用3 kDa和10 kDa的超滤膜分离出分子质量大于10 kDa、3~10 kDa和小于3 kDa的超滤液。将粗肽提取液和超滤液进行冷冻干燥,保存于-80 ℃冰箱中备用。
根据邢路娟等[15]的方法,采用邻苯二甲醛分光光度法测定质量浓度为1 mg/mL粗提物和超滤组分样品的肽含量。采用胰酪蛋白胨(0~1 mg/mL)作为标准品,测定吸光度,绘制标准曲线(y=0.771 5x+0.239,R2=0.998 9,y为吸光值,x为胰酪蛋白胨浓度);按式(1)计算测定样品的肽含量。

(1)
式(1)中,A1表示经标准曲线计算得出的样品中肽的质量浓度,mg/mL;A2表示测定样品的质量浓度,mg/mL。
1.3.3α-葡萄糖苷酶抑制率的测定
参照Zhao等[3]的方法略加修改。吸取100 μL样品溶液、50 μL α-葡萄糖苷酶溶液(700 U/mL)到96孔板中,37 ℃下反应20 min;加入50 μL 10 mmol/L对硝基苯基-β-D-吡喃葡萄糖苷(PNPG)溶液,混匀并在37 ℃下反应30 min,通过添加50 μL 0.67 mol/L Na2CO3终止反应。以100 μL 0.02 mol/L磷酸盐缓冲液(pH值为6.8)替换样品作为对照组,150 μL 0.02 mol/L磷酸盐缓冲液作为空白组,100 μL样品溶液、50 μL 0.02 mol/L磷酸盐缓冲液作为样品空白对照。使用酶标仪在405 nm处测量溶液的吸光度,每个样品重复测定3次。α-葡萄糖苷酶抑制率计算方法见式(2)。

(2)
式(2)中,Ac表示对照组的吸光度;Ab表示空白组的吸光度;As表示样品组的吸光度;An表示样品空白对照的吸光度。
1.3.4肽的鉴定
参考刘问[16]的方法对分子质量小于3 kDa的火腿粗肽进行LC-MS/MS分析。LC条件:将样品溶解在Nano-HPLC缓冲液A中,进行液相系统分离(缓冲液A液为0.1%的甲酸水溶液,B液为0.1%的甲酸-乙腈水溶液,其中乙腈为84%)。色谱柱以95%的A液平衡,样品由自动进样器上样到上样柱[Acclaim PepMap nano-Viper C18型(100 μm×2 cm, 5 μm),赛默飞世尔科技公司],经过分析柱[C18型(75 μm×10 cm,3 μm),赛默飞世尔科技公司]分离,流速为 300 nL/min,洗脱时间为 30 min。 MS条件:样品经色谱分离后进行质谱分析。分析时长为60 min,检测方式为正离子,母离子扫描范围m/z为300~1 600,一级质谱在m/z为200时的分辨率为70 000,自动增益控制目标为 1×106,一级最大注射时间为40 ms,动态排除时间为 30 s。 多肽和多肽碎片的质量电荷比采集方法:每次全扫描后采集20个碎片图谱,二级质谱激活类型为高能碰撞解离,隔离窗宽度设置为m/z2,二级质谱在m/z为200时的分辨率为17 500,微碎片图谱数为1,二级注射时间为50 ms,规一化碰撞能量为 27 eV。 用Proteome Discoverer1.4软件与数据库(uniprot-Sus-scrofa-122175-20220218)进行肽的查库鉴定和比对。
1.3.5活性肽序列的筛选
通过PeptideRanker系统(http:∥distilldeep.ucd.ie/PeptideRanker/)对肽序列进行评分,分数越高(0~1),多肽具有生物活性的概率就越高。此外,采用PepDraw系统(https:∥pepdraw.com)评估了多肽在pH值为7时的净电荷。通过ToxinPred服务器预测每条肽的潜在毒性和关键物理化学性质。采用PEPTIDE 2.0(http:∥www.peptide2.com/N_peptide_hydrophobicity_hydrophilicity.php)评估肽的疏水性比例。基于BIOPEP-UWM数据库(https:∥biochemia.uwm.edu.pl/)检索已存在的α-葡萄糖苷酶抑制肽。
1.3.6肽的固相合成
采用体外Fmoc固相法,按照C端到N端的顺序固相合成FELLKHQK、VATVSLPR、EALELLK、IIAPPERK、IEEALGDK 5条筛选出的肽序列。通过氨基酸连接反应、肽链连接反应和肽链剪切处理,制备出干燥的粗肽。采用高效液相色谱仪与高分辨质谱仪联用对化学合成获得的粗肽进行纯化和检测分析(纯化条件:色谱柱以10%的乙腈水平衡5 min后,进行梯度运行;流动相A为0.1% 三氟乙酸水溶液,流动相B为0.1% 三氟乙酸乙腈溶液,流速为12 mL/min),根据质荷比检测目标肽的离子大小,判断目标多肽所在的峰域,将分析纯度大于95%的样品冻干,得到最终纯品多肽。肽的合成在生工生物工程(上海)股份有限公司完成。
1.3.7肽IEEALGDK的稳定性测定
1.3.7.1 IEEALGDK热稳定性和酸碱稳定性的测定
1)IEEALGDK的热稳定性测定。配制质量浓度为3 mg/mL的肽溶液,分别置于室温(25 ℃)、40、60、80、100 ℃环境中保温2 h,急速冷却至室温,评价其α-葡萄糖苷酶抑制活性的变化。
2)IEEALGDK的酸碱稳定性测定。分别用pH值为3、5、7、9、11的水溶液将IEEALGDK稀释至3 mg/mL;室温振荡反应2 h,结束后调节样品的pH值为7.0,评价其α-葡萄糖苷酶抑制活性的变化。
1.3.7.2 IEEALGDK体外消化稳定性的测定
参照姚轶俊等[17]的方法略加修改。模拟胃消化:取适量肽溶解在NaHCO3(200 mmol/L,pH值为7.0)中,用1 mol/L HCl调节pH值至2.0,加入质量分数为4%的胃蛋白酶,37 ℃条件下震荡消化2 h,95 ℃水浴15 min灭酶。模拟肠消化:取灭酶后的胃消化液,用1 mol/L NaOH溶液调节pH值至7.5,添加质量分数为4%的胰蛋白酶,37 ℃下震荡消化2 h,95 ℃水浴灭酶。将胃消化液和肠消化液分别冷冻干燥,配制质量浓度为3 mg/mL的肽溶液,评价其α-葡萄糖苷酶抑制活性的变化。
1.3.8分子对接模拟
使用AutoDock Vina 1.1.2软件评估合成肽与α-葡萄糖苷酶的对接模式。α-葡萄糖苷酶(4J5T)的晶体结构来源于蛋白质数据库(PDB)(https:∥www.rcsb.org/)。使用ChemBio2D Ultra 3.14软件包预测肽的二维结构,经ChemBio3D Ultra 3.14软件转换为3D结构。α-葡萄糖苷酶的X射线结构从RCSB蛋白数据库获得。肽被选为配体,酶被选为受体;在分子对接分析中,利用α-葡萄糖苷酶的X射线结构确定的天然配体的位置被用作结合点。使用AutoDock Tools 1.5.6软件进行对接模拟。α-葡萄糖苷酶活性口袋的坐标设置为center x:21.383,center y:14.226和center z:16.565;搜索空间坐标设置为sizes x:15,size y:15和size z:15。将搜索精度设置为20。对接后,结合位点的氨基酸侧链可以根据配体的构象进行优化和调整。根据评分选择最佳结合模式进行分析,用PyMol 1.7.6软件(http:∥www.pymol.org/)绘图和分析。
1.3.9火腿肽对α-葡萄糖苷酶抑制率的IC50值测定
将样品稀释成不同的5个浓度梯度,采用1.3.3中式(2)的方法测定其α-葡萄糖苷酶抑制率,进行非线性拟合,得出回归方程,计算α-葡萄糖苷酶抑制率的IC50值。
1.4 数据处理
所有实验均重复3次,结果以平均值±标准偏差表示。用IBM SPSS 25.0软件分析实验数据,用Duncan’s多重比较方法进行平均值之间的差异显著性分析;P<0.05表示数据具有显著性差异。采用Microsoft Excel 2010和Origin 2019b进行图表绘制。
2 结果与分析
2.1 火腿粗肽的肽含量与α-葡萄糖苷酶抑制活性分析
2.1.1肽含量分析
超滤可以截留大分子物质,有效地分离和富集出具有较高生物活性的低分子质量肽段[3-5]。本研究通过超滤分离,制备不同分子质量的火腿肽,采用邻苯二甲醛法测定火腿提取物的肽含量,实验结果见表1。由表1可知,大河乌猪火腿粗提物中肽的质量分数为72.28%±1.65%,低于金华火腿(74.87%±15.44%)[15],这可能是因为金华火腿(30 d)比大河乌猪火腿(18 d)腌制时间长,导致金华火腿中蛋白质水解得到的多肽含量更高[18]。经超滤分离后,分子质量小于3 kDa组分的肽含量显著高于其他两个组分(P<0.05),这说明大河乌猪火腿中的肽主要以分子质量小于3 kDa的短肽为主。Wang等[19]测定了成熟期10个月,分子质量小于3 kDa的羊肉火腿和宣威火腿中肽的质量分数分别为5.68%和4.34%,低于本研究中分子质量小于3 kDa组分的肽的质量分数(38.37%)。羊肉火腿和宣威火腿成熟期为10个月,大河乌猪火腿的成熟期为12个月。在本研究中,分子质量小于3 kDa的大河乌猪火腿肽含量高于羊肉火腿和宣威火腿,这可能是因为大河乌猪火腿较长的成熟期,导致火腿中的蛋白质被内源酶和肽酶更加充分地水解为小肽和游离氨基酸[20]。

表1 火腿提取物中的肽质量分数
2.1.2火腿粗肽的α-葡萄糖苷酶抑制活性分析
不同超滤组分,大河乌猪火腿肽对α-葡萄糖苷酶抑制活性的分析结果见图1。由图1可知,分子质量小于3 kDa组分肽对α-葡萄糖苷酶的抑制率高于其他分离组分,这表明低分子质量的火腿肽具有更强的α-葡萄糖苷酶抑制活性。质量浓度为10 mg/mL时,分子质量小于3 kDa组分肽的α-葡萄糖苷酶抑制率为66.90%,高于同等浓度下,皖浙花猪干腌火腿肽GPAGPQGPRG对α-葡萄糖苷酶的抑制活性(65.83%)[7]。本研究结果表明,分子质量小于3 kDa组分的大河乌猪火腿肽具有良好的α-葡萄糖苷酶抑制活性。
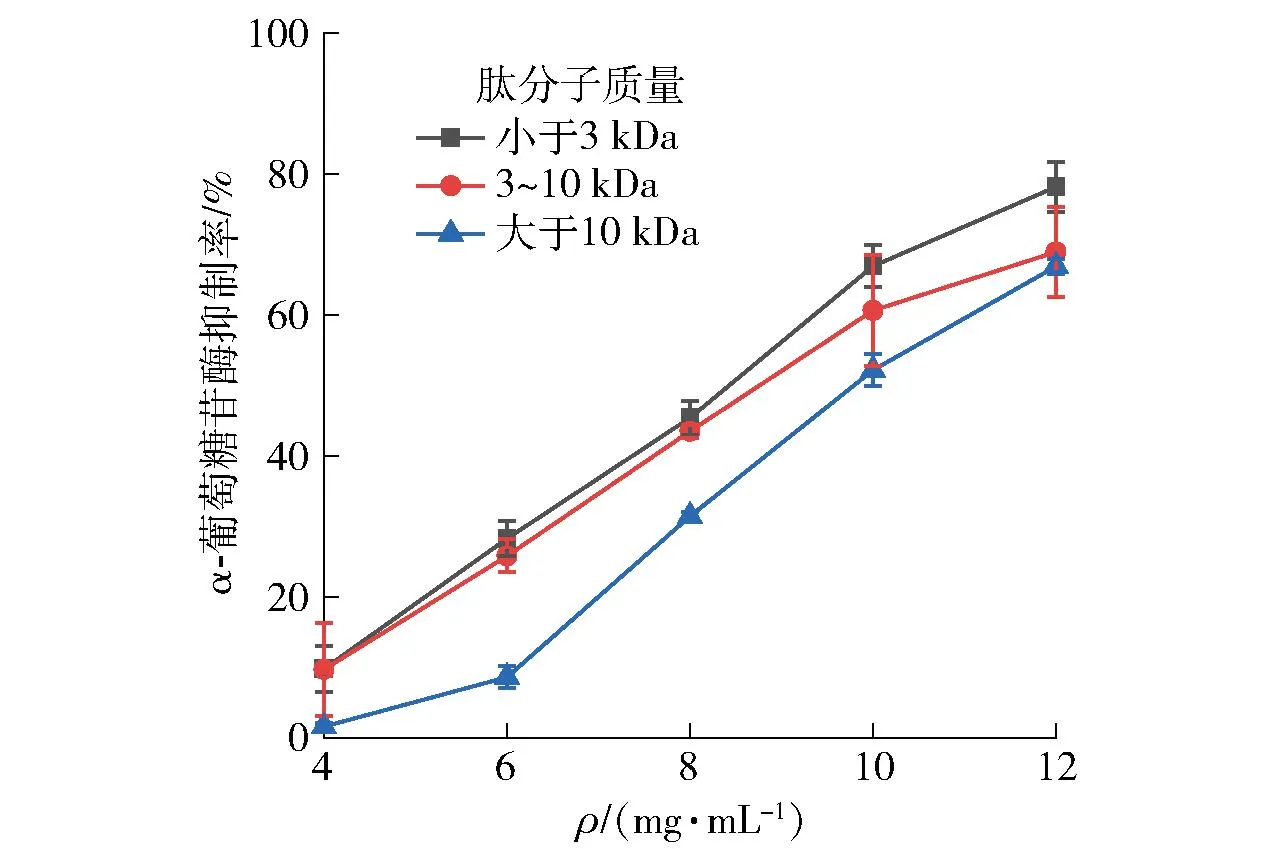
图1 火腿粗肽组分的α-葡萄糖苷酶抑制率Fig.1 Inhibitory rate of crude ham peptide on α-glucosidase
2.2 火腿肽的鉴定结果
采用LC-MS/MS鉴定了大河乌猪火腿中肽的氨基酸序列,分析结果见图2。经图2(a)和数据库(uniprot-Sus-scrofa-122175-20220218)比对分析,从大河乌猪火腿中鉴定出143条肽序列。由图2(b)和图2(c)可知,这些肽主要由6~15个氨基酸组成,以分子质量小于1.5 kDa的短肽为主(76.92%)。通过UniProt数据库将鉴定的肽进行蛋白质来源比对分析,大河乌猪火腿中的肽主要来源于肌球蛋白(32.09%)、肌钙蛋白(12.69%)和 β-烯醇化酶(11.94%)[图2(d)]。黄晶晶等[7]从皖浙花猪干腌火腿中鉴定出104条链长为8~24个氨基酸的肽序列,其主要来源于平滑肌肌动蛋白α2、肌球蛋白-4、I型胶原蛋白α1链、肌酸激酶、肌球蛋白轻链1。Li等[20]从盘县火腿中鉴定出66条含有2~16个氨基酸残基,主要来源于肌球蛋白和β-烯醇化酶的肽序列。干腌火腿中肽的含量和来源差异与加工时间和内源酶的活性密切相关,较高的酶活性和较长的后熟时间有利于促进蛋白质水解为氨基酸和小肽[18]。在本研究中,大河乌猪火腿中鉴定到的肽数量高于皖浙花猪干腌火腿和盘县火腿中鉴定到的肽。这可能是较长的后熟时间和较高活性的内源酶导致大河乌猪火腿中的蛋白质充分地降解为更多数量的小肽。
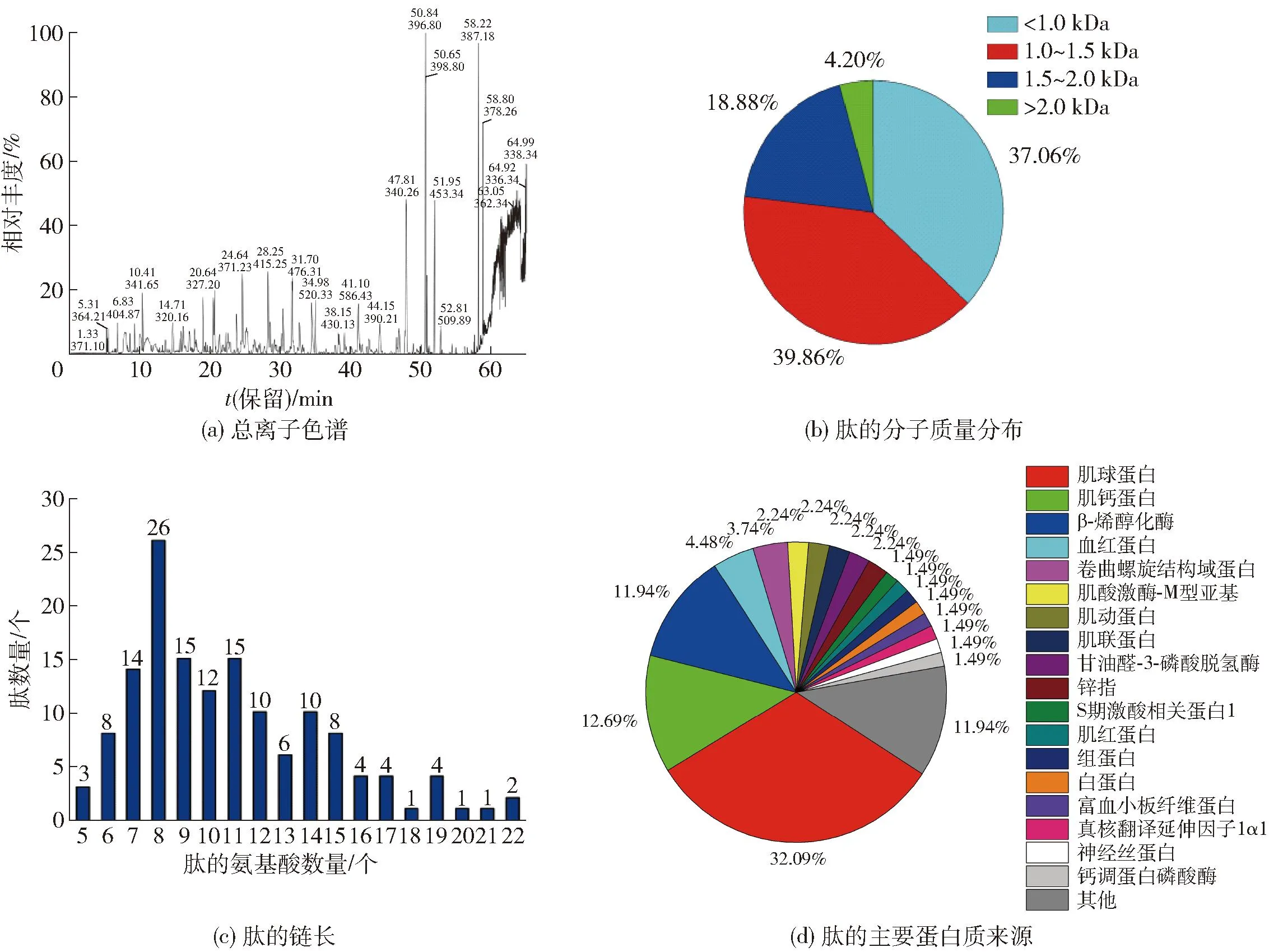
图2 火腿肽的鉴定和分析Fig.2 Identification and analysis of ham peptides
2.3 新型α-葡萄糖苷酶抑制肽的筛选结果
生物信息学分析方法是一种快捷、可靠的生物活性预测方法,被普遍应用于潜在生物活性肽的筛选和分析[21]。肽的生物活性与其氨基酸组成、理化特性以及分子质量大小密切相关[20]。以往对α-葡萄糖苷酶抑制肽的研究表明:1)大多数具有较高生物活性的α-葡萄糖苷酶抑制肽为氨基酸残基数小于10的寡肽[22],肽链C端的精氨酸(Arg)和赖氨酸(Lys)是保证活性肽发挥α-葡萄糖苷酶抑制活性的必要氨基酸残基[23]。2)疏水性氨基酸含量较高的肽对α-葡萄糖苷酶具有更好的抑制活性[3],亮氨酸(Leu)、异亮氨酸(Ile)、丙氨酸(Ala)和脯氨酸(Pro)等疏水性脂肪族氨基酸能促进胰岛素分泌,是构成α-葡萄糖苷酶抑制肽的重要氨基酸残基[24-26]。3)丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)、脯氨酸(Pro)、精氨酸(Arg)、赖氨酸(Lys)和蛋氨酸(Met)是活性肽发挥α-葡萄糖苷酶抑制作用的关键残基[23]。4)甘氨酸(Gly)和亮氨酸(Leu)可以促进胰岛素的分泌,改善饮食引起的高血糖症[27-28]。
本研究根据α-葡萄糖苷酶抑制肽的氨基酸组成特征,从143条肽序列中筛选出FELLKHQK、VATVSLPR、EALELLK、IIAPPERK、IEEALGDK 5条可能具有α-葡萄糖苷酶抑制活性的肽序列,筛选结果见表2。由表2可知,5条肽序列的C端都存在精氨酸(Arg)或赖氨酸(Lys)。肽IEEALGDK带2个负电荷,序列中含Leu、Gly、Ile、Ala等可以促进胰岛素分泌的氨基酸残基。肽VATVSLPR和IIAPPERK的疏水性氨基酸占比均高达62.50%。IIAPPERK的肽链得分值较高(0.33),经BIOPEP-UWM数据库检索,IIAPPERK中的片段IIAPPER具有α-葡萄糖苷酶抑制活性。经ToxiPred服务器预测,所筛选的5条肽都无毒性。对比BIOPEP-UWM数据(https:∥biochemia.uwm.edu.pl/),5条肽均未被研究报道,说明本研究筛选的肽是新颖的。因此,选择这5条可能具有α-葡萄糖苷酶抑制活性的新型肽进行下一步研究。

表2 新型肽的理化特性
2.4 合成肽的α-葡萄糖苷酶抑制活性和稳定性分析
2.4.1合成肽的α-葡萄糖苷酶抑制活性分析
为明确筛选肽的α-葡萄糖苷酶抑制活性,采用固相法合成了FELLKHQK、VATVSLPR、EALELLK、IIAPPERK和IEEALGDK共5条肽段,通过α-葡萄糖苷酶抑制实验进一步测定合成肽的α-葡萄糖苷酶抑制活性,实验结果见图3和表3。由图3(a1)、(b1)、(c1)、(d1)、(e1)和表3可见,5条合成肽的纯度都大于95%。由图3(a2)、(b2)、(c2)、(d2)、(e2)可知,各合成肽的分子质量测定值与其理论值相近,这表明肽的合成结果可靠,具体数据见表3。5条合成肽中,只有肽段IEEALGDK具有 α-葡萄糖苷酶抑制活性,其IC50值为1.42 mg/mL(回归方程:y=0.338x+0.021 3,R2=0.910 7)(表3)。本研究中,IEEALGDK对α-葡萄糖苷酶的抑制活性高于伊比利亚干腌火腿[6]中鉴定到的肽AEEEYPDL(IC50值为5.38 mg/mL)、LGVGG(IC50值为2.55 mg/mL)、GGLGP(IC50值为3.48 mg/mL)以及酸乳清水解物[13]中的肽YPVEPF(IC50值为3.52 mg/mL)、VPYPQ(IC50值为4.13 mg/mL)、LPYPY(IC50值为4.17 mg/mL)。本研究结果表明,IEEALGDK是一条具有较强α-葡萄糖苷酶抑制活性的新型生物活性肽。

图3 合成肽的色谱及质谱Fig.3 Chromatograms and mass spectroscopy analysis of synthetic peptides
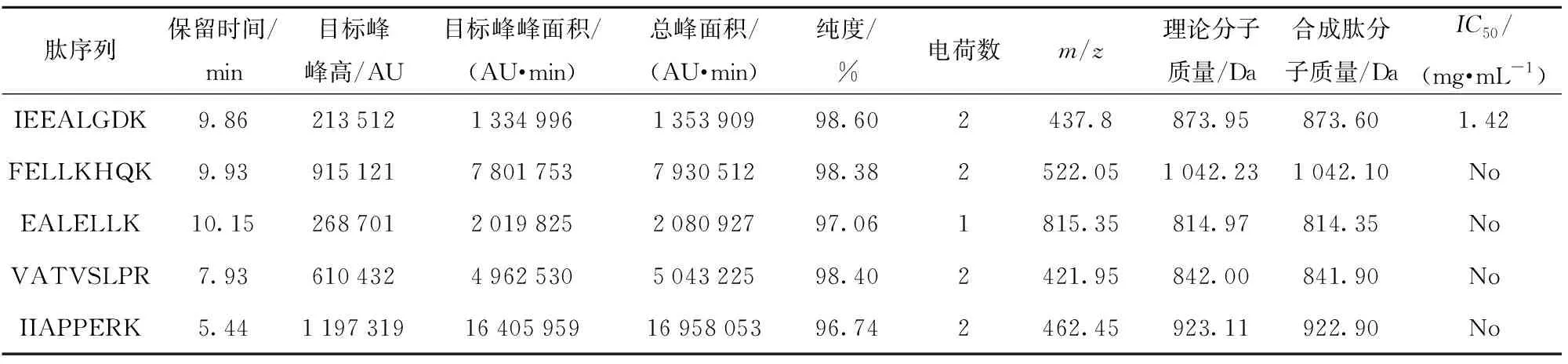
表3 合成肽的色谱、质谱信息及抑制α-葡萄糖苷酶的IC50值
目标峰峰高由液相色谱输出的电压信号转化而来(1 AU=1 000 mV)。合成肽纯度计算公式为合成肽纯度=(目标峰的峰面积/总峰面积)×100%;合成肽的分子质量计算公式为m=(M+n)/n,m代表质荷比(m/z),M代表分子质量,n代表离子峰所带电荷数。No表示目标肽无α-葡萄糖苷酶抑制活性。
2.4.2肽段IEEALGDK的稳定性分析
生物活性肽在到达α-葡萄糖苷酶活性靶点和被人体吸收利用之前,可能会受到酸碱环境、加工温度和人体胃肠消化环境等的影响[5]。因此,本研究测定了不同pH值、温度和模拟胃肠消化条件下IEEALGDK的活性变化,分析结果见图4。
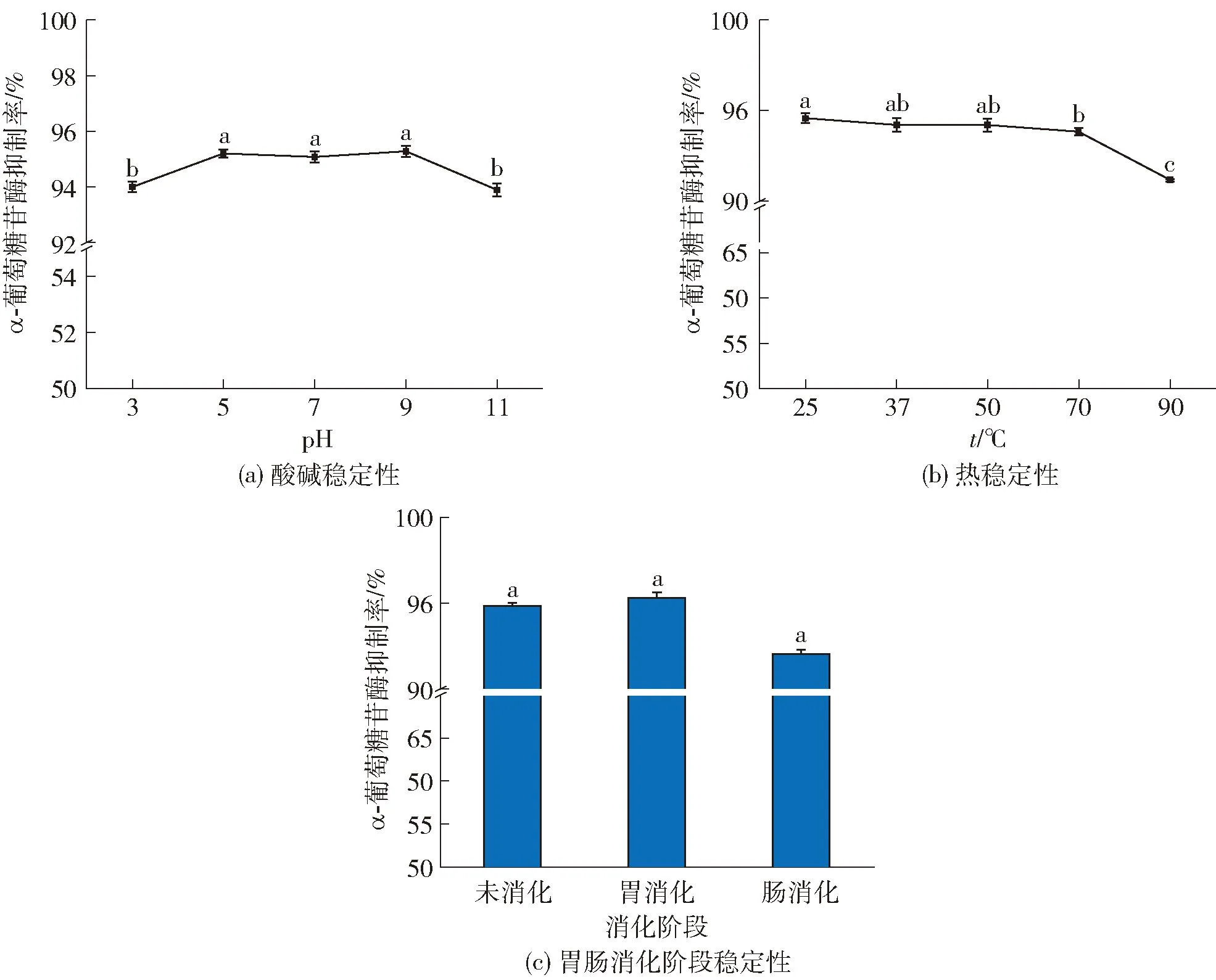
不同小写字母表示各组数据间差异显著(P<0.05)。
由图4(a)可知,IEEALGDK在强酸(pH值为3)和强碱(pH值为11)条件下的α-葡萄糖苷酶抑制率低于中性环境(P<0.05)。这可能是强酸强碱环境下,肽的活性片段发生外水解或脱酰胺反应,导致肽的二级结构改变,从而使活性下降[17],因此,活性肽的加工应该在中性环境中进行。由图4(b)可知,IEEALGDK的α-葡萄糖苷酶抑制活性随温度的升高逐渐降低,90 ℃时,IEEALGDK对α-葡萄糖苷酶抑制率降低至91.15%。这可能是温度升高,破坏了肽的二级结构和活性氨基酸残基[5],影响其功能活性。然而,在所有处理温度下,IEEALGDK对α-葡萄糖苷酶的抑制活性均保持在90%以上。这表明IEEALGDK具有较高的热稳定性,能够在加工热处理中保持较高的活性,是一种良好的α-葡萄糖苷酶抑制剂。
由图4(c)可知,模拟胃肠消化前后,IEEALGDK的α-葡萄糖苷酶抑制活性先增强后减小,抑制率能很好地保持在90%以上。胃消化阶段α-葡萄糖苷酶抑制率增长至95.35%,肠消化阶段结束时α-葡萄糖苷酶抑制率下降至92.04%。这可能是胃消化作用暴露出肽与α-葡萄糖苷酶结合的疏水性氨基酸位点[5],增强肽对α-葡萄糖苷酶的抑制活性;再经过肠消化后,肽在胰蛋白酶作用下进一步酶解为游离氨基酸,破坏了肽的二级结构,肽的功能活性降低。Hu等[4]发现,经胃肠道消化后,发酵米糠皮中的寡肽GLLGY对α-葡萄糖苷酶抑制活性降低至83.37%。Hu等[13]发现,经胃肠道消化后,酸乳清中α-葡萄糖苷酶抑制肽YPVEPF的生物活性降低至19.64%。胃肠消化稳定性结果显示,IEEALGDK的胃肠耐受性高于酸乳清肽段YPVEPF和发酵米糠皮肽段GLLGY。这表明IEEALGDK在胃液和肠液中均能保持较强的抗消化能力。
本研究结果显示,在高温、强酸强碱和模拟胃肠消化条件下,IEEALGDK的α-葡萄糖苷酶抑制活性受到一定的影响,但抑制率仍能保持在90%以上。这表明IEEALGDK具有较强的耐酸碱、耐热和抗消化能力,可以在食品加工和消化吸收过程中发挥有效的生物活性。
2.5 IEEALGDK与α-葡萄糖苷酶分子对接结果
分子对接技术是识别受体蛋白与活性肽的对接位点和相互作用最有效的方法[12]。本研究采用分子对接技术探究了IEEALGDK抑制α-葡萄糖苷酶的作用机制,实验结果见图5和表4。图5(a)为IEEALGDK与α-葡萄糖苷酶分子最佳结合模式下的可视化结果图,经PyMol 1.7.6软件转化得到最佳构象模式下的3D图[图5(b)]和2D图[图5(c)]。由图5(b)可见,IEEALGDK能够很好地嵌入α-葡萄糖苷酶分子的内部,这表明IEEALGDK与α-葡萄糖苷酶对接良好。经AutoDock Tools 1.5.6软件计算结合能大小,IEEALGDK与α-葡萄糖苷酶的结合能为-30.96 kJ/mol(表4),低于阿卡波糖与α-葡萄糖苷酶的结合能(-28.03 kJ/mol)和发酵米糠皮肽段GLLGY与α-葡萄糖苷酶的结合能(-29.71 kJ/mol)[4-5]。结合能的大小可用于判定复合物的稳定性,肽与α-葡萄糖苷酶结合所需能量越低,形成的复合物越稳定[5]。本研究中,IEEALGDK与α-葡萄糖苷酶的结合能低于阿卡波糖与α-葡萄糖苷酶的结合能和发酵米糠皮肽段GLLGY与α-葡萄糖苷酶的结合能,这说明IEEALGDK可以与α-葡萄糖苷酶形成较高稳定性的复合物。

图5 IEEALGDK与α-葡萄糖苷酶的分子对接结果Fig.5 Molecular docking results of IEEALGDK and α-glucosidase

表4 IEEALGDK与α-葡萄糖苷酶分子对接分析
生物活性肽主要通过氢键、疏水相互作用和盐桥与α-葡萄糖苷酶的活性残基位点结合,从而阻碍酶-底物复合物的形成和糖苷键的断裂[24]。图5(c)和表4显示了IEEALGDK与α-葡萄糖苷酶的分子对接位点和分析结果。由图5(c)和表4可知,IEEALGDK中的7个支链残基(Glu4、Asp3、lle1、Glu1、Leu1、Gly1、Lys1)与α-葡萄糖苷酶的11个残基(Gln617、Arg594、Tyr728、 Lys665、Asp724、Tyr720、His805、 His803、Ser466、Gln598、Lys597)之间形成15个氢键,平均键长为3.27 Å。同时,IEEALGDK与α-葡萄糖苷酶的12个氨基酸残基(Ile667、Glu616、Glu470、Glu463、Leu666、Lys669、Pro668、Val620、Ser802、Arg727、Arg799、Arg467)之间形成疏水相互作用。这些氢键和疏水相互作用增强了IEEALGDK和α-葡萄糖苷酶之间结合的作用力和稳定性。Barker等[29]研究发现,精氨酸(Arg)、色氨酸(Trp)和半胱氨酸(Cys)是α-葡萄糖苷酶主要的活性残基位点。Zhao等[3]发现,降血糖肽段RNAVPITPTLNR、TKVIPYVRYL、YLGYLEQLLR和FALPQYLK主要通过氢键和疏水相互作用与α-葡萄糖苷酶的潜在活性位点Arg387、Arg428、Arg727、Arg801、Arg799和Trp710结合,阻断α-葡萄糖苷酶与底物复合物间糖基化的形成发挥降血糖作用。本研究结果显示,IEEALGD主要通过氢键和疏水相互作用占据α-葡萄糖苷酶的潜在活性位点Arg594、Arg727、Arg799和Arg467,进而抑制α-葡萄糖苷酶的活性。
3 结 论
采用LC-MS/MS技术,在大河乌猪火腿中鉴定出143条主要来源于肌钙蛋白、肌球蛋白和β-烯醇化酶的肽序列。基于生物信息学分析方法和α-葡萄糖苷酶抑制活性分析,在143条肽段中筛选出一条新型的α-葡萄糖苷酶抑制肽IEEALGDK(IC50值为1.42 mg/mL)。肽的稳定性研究结果表明,IEEALGDK具有良好的热稳定性、耐酸碱稳定性及胃肠道消化稳定性。分子对接结果分析表明,IEEALGDK主要通过氢键和疏水相互作用占据Arg594、Arg727、Arg799和Arg467等α-葡萄糖苷酶的活性残基位点发挥酶的抑制作用。本研究表明,大河乌猪火腿肽IEEALGDK是一条稳定性较好的α-葡萄糖苷酶抑制肽,下一步可通过细胞或动物模型实验进一步验证肽的毒性和α-葡萄糖苷酶抑制活性,以便将其用于功能性食品的开发。

