HPLC法同时测定杠板归不同部位中5种成分的含量
胡冬青,阎兆君
(1山东中医药大学附属医院消化科,济南 250014;2山东中医药大学附属医院身心医学科;*通讯作者,E-mail:yzj7790@163.com)
杠板归为蓼科植物杠板归PolygonumperfoliatumL.的干燥地上部分,别名蛇倒退、老虎脷、犁头刺,收载于2020年版《中国药典》[1],性寒,味酸,归肺经、膀胱经。一般在夏季开花时采割,晒干后全草入药。杠板归具有清热解毒、利水消肿、止咳之功效,用于治疗咽喉肿痛、肺热咳嗽、小儿顿咳、水肿尿少、湿热泻痢、蛇虫咬伤等[2],在民间还常用于感冒发热、疔疮痈肿、蛇虫咬伤、跌仆肿痛等[3]。在我国各地均有分布,是一味资源丰富且集食、饲、药用于一身的常用中药[4]。现代研究表明,杠板归具有抗炎、抗氧化、抗肿瘤、抗病毒等多种药理作用[5,6],含有黄酮、苯丙素、有机酸、生物碱等多种化学成分[7]。目前,对于杠板归有效成分的含量测定研究相对较少,仅有少数学者对其进行了薄层色谱定性鉴别和HPLC含量测定研究[8,9],且研究主要集中在全草或炮制品[10],对其不同部位的有效成分含量测定和比较研究较少,深入开展杠板归不同部位中有效成分的含量测定研究,对进一步开发利用杠板归资源具有重要意义。因此,本研究以绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素为指标成分,建立杠板归不同部位(茎、叶、根)中5种成分的HPLC含量测定方法,初步阐明杠板归不同部位之间有效成分的含量差异,以期为杠板归的临床应用、质量控制和资源开发提供参考。
1 材料与方法
1.1 仪器
Waters 2695高效液相色谱仪(含PAD检测器,Empower工作站,美国Waters公司);Luna®-C18(4.6 mm×250 mm,5 μm)色谱柱(广州润知生物科技有限公司);CPA225D型十万分之一电子天平(赛多利斯科学仪器有限公司);KQ-500DE型超声波清洗机(昆山市超声仪器有限公司)。
1.2 试药
对照品绿原酸(批号110735-200806,纯度99.3%,中国药品生物制品检定所)、咖啡酸(批号2110809-201205,纯度98.9%,中国药品生物制品检定所)、芦丁(批号100080-200708,纯度99.6%,中国食品药品检定研究院)、阿魏酸(批号C12085951,纯度98.8%,上海麦克林生化科技有限公司)、槲皮素(批号100081-201608,纯度99.2%,中国食品药品检定研究院)。磷酸、乙腈均为色谱纯(美国ThermoFisher公司);其他试剂均为分析纯。杠板归及其不同部位茎、叶、根(批号20220713,产地为江西)购自江西上饶泽信堂药店。
1.3 方法
1.3.1 色谱条件 以Luna®-C18(4.6 mm×250 mm,5 μm)为色谱柱;乙腈(A)-0.1%磷酸水溶液(B)为流动相,梯度洗脱(0~12 min,5%→20%A;12~26 min,20%→30%A;26~40 min,30%→42%A)。流速为1.0 mL/min,检测波长320 nm;柱温30 ℃;进样量10 μL。
1.3.2 对照品溶液的制备 精密称取绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素对照品适量,加甲醇超声溶解,得绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素质量浓度分别为4.6,21.2,5.5,8.4,11.4 μg/mL的混合对照品溶液。
1.3.3 供试品溶液的制备 取杠板归茎、叶、根各1.0 g,精密称定,置50 mL具塞锥形瓶中,精密加入60%甲醇25 mL,精密称定,超声处理30 min,放冷至室温,精密称定并用60%甲醇补足减失质量,摇匀,过滤,经0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
1.3.4 线性关系的考察 精密吸取1.3.2项下的混合对照品溶液0.1,0.5,1.0,2.0,5.0,10.0 mL置于10 mL的容量瓶中,加入甲醇定容至刻度。按1.3.1项下的色谱条件进行进样分析,以峰面积Y对进样浓度X计算回归方程。
1.3.5 精密度试验 取1.3.2项下混合对照品溶液,按1.3.1项下的色谱条件连续进样6次,记录各成分峰面积,计算相对标准偏差(relative standard deviation, RSD)。
1.3.6 重复性试验 取杠板归茎样品6份,按1.3.3项下方法制备供试品溶液,按1.3.1项下的色谱条件进样测定,记录各成分峰面积,计算RSD。
1.3.7 稳定性试验 取杠板归茎供试品溶液,按1.3.1项下的色谱方法分别于0,2,4,8,12,24 h进样分析,记录各成分峰面积,计算RSD。
1.3.8 加样回收率试验 取杠板归茎样品6份,每份约0.5 g,加入等量的绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素对照品,按1.3.3项下方法制备供试品溶液,按1.3.1项下方法进样分析,计算加样回收率及RSD。
1.3.9 样品含量测定 取杠板归不同部位,按1.3.3项下方法制备供试品溶液,每批样品均平行制备3份,按1.3.1项下色谱条件对其进行含量测定。
2 结果
2.1 专属性试验
取混合对照品溶液和杠板归茎、叶、根供试品溶液,按照1.3.1项下色谱条件进样检测,结果显示对照品与供试品溶液5种成分色谱峰保留时间一致,各色谱峰分离度良好,方法专属性良好。色谱图见图1。

注:1.绿原酸;2.咖啡酸;3.芦丁;4.阿魏酸;5.槲皮素。图1 对照品与供试品的色谱图Figure 1 HPLC chromatograms of reference substance and samples
2.2 线性关系的考察
绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素分别在0.046~4.6 μg/mL,0.212~21.2 μg/mL,0.055~5.5 μg/mL,0.084~8.4 μg/mL,0.114~11.4 μg/mL的质量浓度范围内与峰面积呈线性关系良好,相关系数、回归方程及线性范围见表1。

表1 5种被测成分的线性关系和线性范围
2.3 精密度试验
精密度试验结果显示,绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素峰面积的RSD分别为1.46%,0.96%,2.16%,1.45%,2.12%(见表2),表明仪器精密度良好。

表2 5种被测成分的精密度试验结果
2.4 重复性试验
由表3可知,绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素峰面积的RSD分别为1.42%,1.37%,2.05%,1.57%,1.12%,表明该方法重复性良好。

表3 5种被测成分的重复性试验结果
2.5 稳定性试验
由表4可知,绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素峰面积的RSD分别为1.26%,1.68%,1.95%,2.31%,1.25%,表明供试品溶液在24 h内稳定。

表4 5种被测成分的稳定性试验结果
2.6 加样回收率试验
由表5可知,绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素的平均加样回收率分别为99.78%,101.63%,102.09%,97.65%,99.26%;RSD分别为1.76%,2.44%,1.89%,2.28%,2.17%。
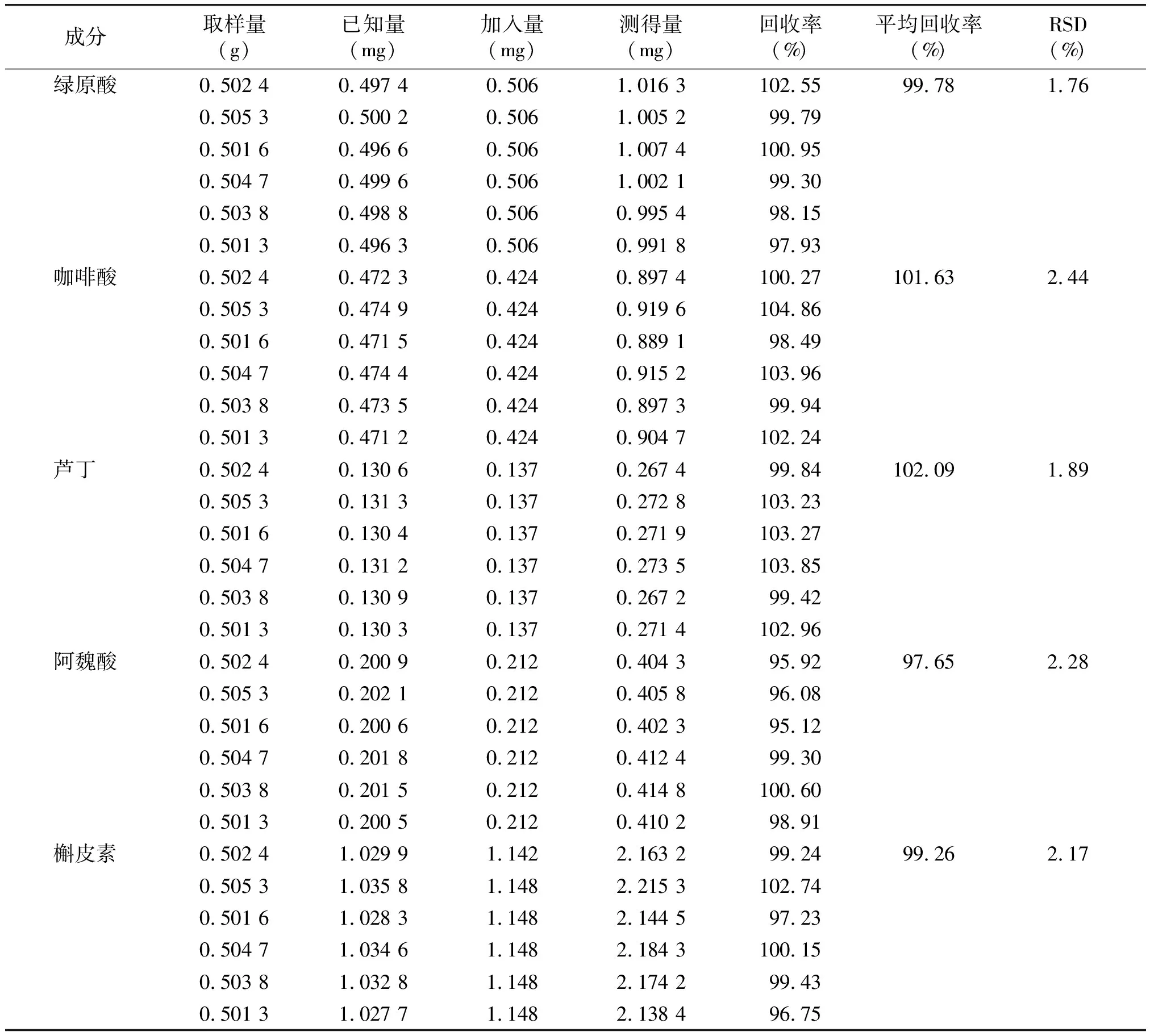
表5 加样回收率试验结果 (n=3)
2.7 样品含量测定
由表6可知,杠板归不同部位中5种成分含量差异较大,绿原酸和咖啡酸2个成分在叶中含量高,且远远高于根和茎中的含量;芦丁和阿魏酸主要存在于茎和根中,叶中未检测到;槲皮素在茎中含量最高,叶中次之,根中最低。

表6 不同部位中5种成分的含量测定结果 (n=3, mg/g)
3 讨论
3.1 指标成分的选择
杠板归中主要含有芦丁、槲皮素等黄酮类成分及绿原酸、阿魏酸、咖啡酸等酚酸类活性成分,2020年版《中国药典》含量测定项下以槲皮素为质量控制指标成分。现代研究表明,绿原酸、阿魏酸、咖啡酸等酚酸类具有抗氧化、抗肿瘤、抑菌、提高免疫力等多种活性,是多种药用植物的质控指标成分。因此,本试验选择绿原酸、咖啡酸、芦丁、阿魏酸、槲皮素5个成分进行含量测定研究。
3.2 色谱条件的考察
绿原酸、阿魏酸、咖啡酸等酚酸类成分呈弱酸性,芦丁、槲皮素等黄酮类成分也含有酚羟基,测定该类成分时一般以酸水为流动相以改善分离度和峰型。本试验对甲醇-水、乙腈-水、甲醇-0.1%磷酸水、乙腈-0.1%磷酸水、乙腈-0.4%磷酸水、乙腈-0.4%磷酸等流动相进行了比较,结果显示,在以乙腈-0.1%磷酸为流动相的条件下,5种被测成分能够完全分离且峰形较好。
3.3 不同部位成分差异分析
杠板归通常是全草入药,不同部位之间有效成分的含量可能存在差异。含量测定结果显示,绿原酸和咖啡酸均在叶中含量高,远远高于根和茎中的含量;芦丁和阿魏酸主要存在于茎和根中,叶中未检测到;槲皮素在茎中含量最高,叶中次之,根中最低。
本试验研究建立了简便快捷、专属性强、重现性好的HPLC法同时测定杠板归不同部位中5种有效成分含量,并初步阐明了杠板归不同部位之间有效成分的含量差异,为杠板归药材及其非药用部位的资源开发和合理利用提供科学依据。

