川崎病内皮细胞高表达IL-1β促进中性粒细胞活化和分泌Sema4D
黄君华,谢小娟,赵传梅,张书婉*
(1西安医学院医学技术学院临床检验基础与血液学检验教研室,西安 710021;2陕西省人民医院省临检中心;3西安市儿童医院检验科;*通讯作者,E-mail:shuwan0103@163.com)
川崎病(Kawasaki disease,KD)是一种以冠脉病变(coronary artery lesion,CAL)为主要特征的急性儿童血管炎症性疾病[1]。尽管对川崎病的研究已经取得了一定的进展,但其病因和发病机制仍未完全阐明。在川崎病急性期,中性粒细胞的活化状态明显增强,伴有中性粒细胞迁移能力的增强和凋亡减少[2]。这表明中性粒细胞处于过度活化状态,而过度活化的中性粒细胞可能与冠脉病变的发生和进展有关[3]。然而,目前对于中性粒细胞在冠脉病变部位活化的具体机制尚不清楚。
信号素4D(Semaphorin 4D,Sema4D)是一种表达于多种白细胞表面的信号分子,其脱落增加常被认为是中性粒细胞活化的标志之一[4]。研究发现川崎病患儿外周血中性粒细胞表面Sema4D脱落增加[4],但其机制仍不是很清楚。白介素1β(interleukin-1β,IL-1β)是一种重要的细胞因子,在介导血管炎过程中起着关键的作用,并在川崎病冠脉病变(Kawasaki disease-associated coronary artery lesion,KD-CAL)发生和发展中发挥着重要的调控作用[5]。研究表明,在川崎病条件下,内皮细胞高表达具有强烈细胞激活作用的IL-1β[4],然而对于内皮细胞通过IL-1β介导中性粒细胞活化的研究尚未深入展开。鉴于川崎病的临床重要性和对儿童健康的威胁,以及中性粒细胞和内皮细胞在KD-CAL发展中的关键作用,深入研究内皮细胞表达的IL-1β水平及其对中性粒细胞生物学功能的影响具有重要的必要性。
本研究在体外构建HCAEC川崎病模型的基础上,通过siRNA敲减内皮细胞IL-1β并获得相应条件培养基,进一步利用内皮细胞条件培养基探讨KD条件下内皮细胞表达的IL-1β对中性粒细胞迁移能力、凋亡水平和Sema4D分泌的影响及其机制。
1 材料与方法
1.1 临床资料
以美国心脏协会2017年修订的《川崎病的诊断、治疗和长期管理》[6]为诊断标准,纳入2022年12月西安市儿童医院收治的急性期KD患者10例,另选取同时期10例健康儿童作为对照(HC)。本实验方案经过西安医学院医学伦理委员会审查批准(批准编号:XYLS2022258),所有纳入对象的监护人均已了解本研究目的并签署了知情同意书。采集治疗前的KD患儿及对照儿童静脉血2 mL于促凝管并分离得到1 mL血清。将获得的10例KD患儿的血清汇集到塑料离心管即得到10 mL混合KD血清,另将10例HC患儿的血清汇集到塑料离心管得到10 mL混合HC血清,于-80 ℃保存备用。另采集健康儿童空腹静脉血4 mL于肝素抗凝管用于获取中性粒细胞。
1.2 实验材料
1.2.1 细胞株与试剂 人冠状动脉内皮细胞(human coronary artery endothelial cells,HCAECs)购自美国Sciencell公司;胎牛血清和RPMI-1640培养基购自美国Gibco公司;Lipofectamine 3000试剂盒购自美国Invitrogen公司;RNeasy mini试剂盒购自德国Qiagen公司;SYBR green qPCR Mix购自日本TakaRa公司;人外周血中性粒细胞分离液试剂盒购自北京索莱宝科技有限公司;ADAM17抑制剂TAPI-1购自美国Selleck Chemicals公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自德国Merck公司;IL-1β ELISA试剂盒购自武汉亚科因生物技术有限公司;Transwell迁移小室和塑料离心管购自美国Corning公司;细胞凋亡检测试剂盒购自美国Abcam公司;FITC标记的抗人Sema4D抗体购自美国Biolegend公司。
1.2.2 实验仪器 ABI 7500基因扩增仪购自美国ABI公司;全自动酶标仪购自深圳雷杜生命科学股份有限公司;NovoCyte D1040流式细胞仪购自美国ACEA公司;光学显微镜购自南京尼康江南光学仪器有限公司。
1.3 方法
1.3.1 HCAECs的培养与处理 在含10%胎牛血清的RPMI-1640培养基中培养HCAECs,细胞融合到70%~80%时接种到6孔板。当90%融合时,将培养基更换为含20% KD血清或HC血清的RPMI-1640培养基,分别为KD组和HC组。继续培养24 h后收集HCAECs。每组实验重复3次。
HCAECs的siRNA转染按照Lipofectamine 3000试剂盒说明书进行,转染4 h后更换为含20% KD血清的RPMI-1640培养基,其中KD血清刺激经siRNA敲减IL-1β后的HCAECs为si-IL-1β组,KD血清刺激经无效siRNA转染的HCAECs为si-NC组。继续培养24 h后收集各组的细胞和上清液。
1.3.2 实时荧光定量PCR(real-time polymerase chain reaction,RT-PCR)检测HCAECs中IL-1β的表达 分别提取KD组、HC组、si-IL-1β组和si-NC组HCAECs的总RNA,逆转录为cDNA,RT-PCR检测IL-1β的mRNA表达。PCR扩增条件:95 ℃预变性10 min后进入扩增循环,95 ℃变性20 s→58 ℃退火30 s→72 ℃延伸40 s,30个循环后冷却到4 ℃保存。反应体系为20 μl:SYBR green qPCR Mix 10 μl,无RNA酶超纯水4.4 μL,cDNA模板4 μL,上下游引物各0.8 μL。以GAPDH为内参,ΔCt=Ct目的基因-Ct内参基因,每组实验设3个复孔,用2-ΔΔCt计算相对表达量。
1.3.3 各组HCAECs条件培养基的获取 将收集的si-IL-1β组和si-NC组培养上清液在4 ℃条件下2 000 r/min离心5 min,取上清并用0.45 μm孔径的滤膜过滤除菌。ELISA法检测条件培养基中IL-1β的浓度。
1.3.4 密度梯度离心法分离中性粒细胞 使用外周血中性粒细胞分离试剂盒提取健康儿童中性粒细胞,经瑞氏染色验证细胞纯度>95%。中性粒细胞以1×106/孔的密度接种到24孔板上,按照处理方式分为4组,分别为TAPI-1预处理+si-NC条件培养基组、DMSO预处理+si-NC条件培养基组、TAPI-1预处理+si-IL-1β条件培养基组和DMSO预处理+si-IL-1β条件培养基组。TAPI-1或DMSO预处理中性粒细胞30 min后,再用si-NC组或si-IL-1β组条件培养基培养,4 h后采用流式细胞术检测细胞凋亡和Sema4D表达。
1.3.5 Transwell实验检测中性粒细胞的迁移 中性粒细胞以1×105个加入Transwell小室上室,下室加入500 μL si-IL-1β组或si-NC组的条件培养基。继续培养24 h后吸取下室培养液于牛鲍计数板中计数细胞。
2 结果
2.1 HCAECs表达IL-1β mRNA的情况
RT-PCR检测结果显示,KD组HCAECs中IL-1β mRNA表达水平较HC组明显升高,差异具有统计学意义(4.20±0.11vs1.08±0.02,t=8.92,P<0.01)。HCAECs转染siRNA后,si-IL-1β组的IL-1β mRNA的表达含量较si-NC组明显降低,差异具有统计学意义(0.51±0.04vs1.07±0.05,t=12.20,P<0.01)。
2.2 HCAECs条件培养基中IL-1β的浓度
ELISA数据显示,si-IL-1β组HCAECs条件培养基中IL-1β浓度较si-NC组显著降低,差异具有统计学意义[(90.80±20.27)pg/mLvs(211.40±30.90)pg/mL,t=11.02,P<0.01)。
2.3 HCAECs条件培养基对中性粒细胞迁移和凋亡的影响
Transwell检测结果显示,与si-NC组相比,si-IL-1β组HCAECs条件培养基处理的中性粒细胞迁移到下室的数量明显下降,差异具有统计学意义(t=9.93,P<0.01,见表1)。流式细胞术结果显示,与si-NC组相比,si-IL-1β组条件培养基处理的中性粒细胞凋亡明显增多,差异具有统计学意义(t=11.26,P<0.01,见图1和表1)。
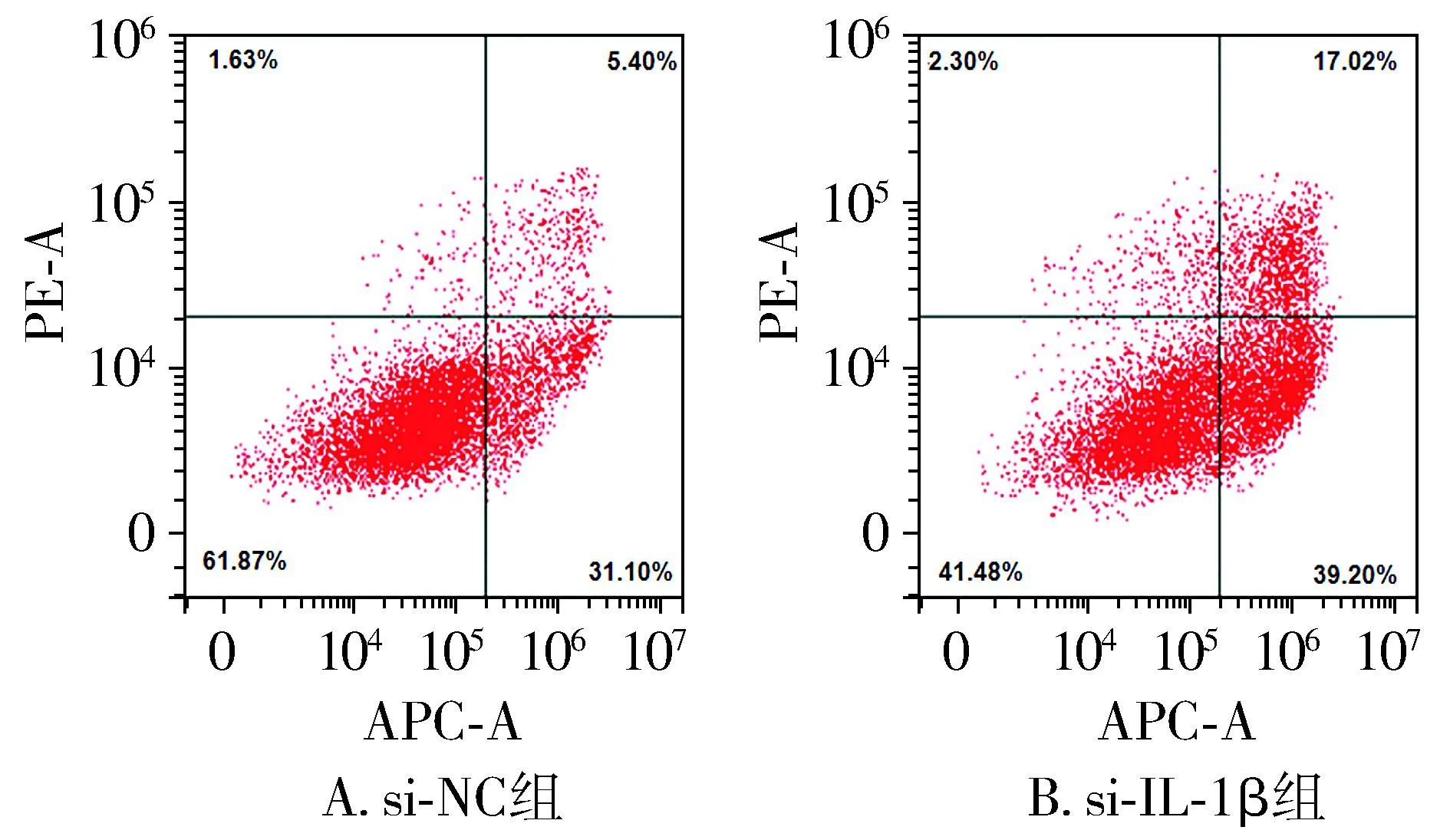
图1 川崎病HCAECs条件培养基处理后中性粒细胞凋亡Figure 1 Apoptosis of neutrophils treated with conditioned medium from KD-associated HCAECs
表1 HCAECs条件培养基处理后中性粒细胞的迁移能力和凋亡率
2.4 HCAECs条件培养基对中性粒细胞分泌Sema4D的影响
流式细胞术结果显示,si-IL-1β组条件培养基处理的中性粒细胞表面Sema4D表达较si-NC组明显升高(90.33%±5.10%vs66.35%±11.32%,t=5.11,P<0.05,见图2),说明IL-1β可促进中性粒细胞分泌Sema4D。

图2 川崎病HCAECs条件培养基处理的中性粒细胞表达Sema4D的情况Figure 2 Expression of Sema4D in neutrophils treated with conditioned medium from KD-associated HCAECs
2.5 ADAM17对中性粒细胞分泌Sema4D的作用
流式细胞术显示,与未加ADAM17活性抑制剂TAPI-1比较,在加入抑制TAPI-1后,si-NC组Sema4D+中性粒细胞百分比明显升高(P<0.05),说明中性粒细胞表面Sema4D脱落减少;而si-IL-1β组Sema4D+中性粒细胞百分比无明显变化(P>0.05,见图3),进一步说明IL-1β可能通过激活ADAM17导致中性粒细胞脱落Sema4D。
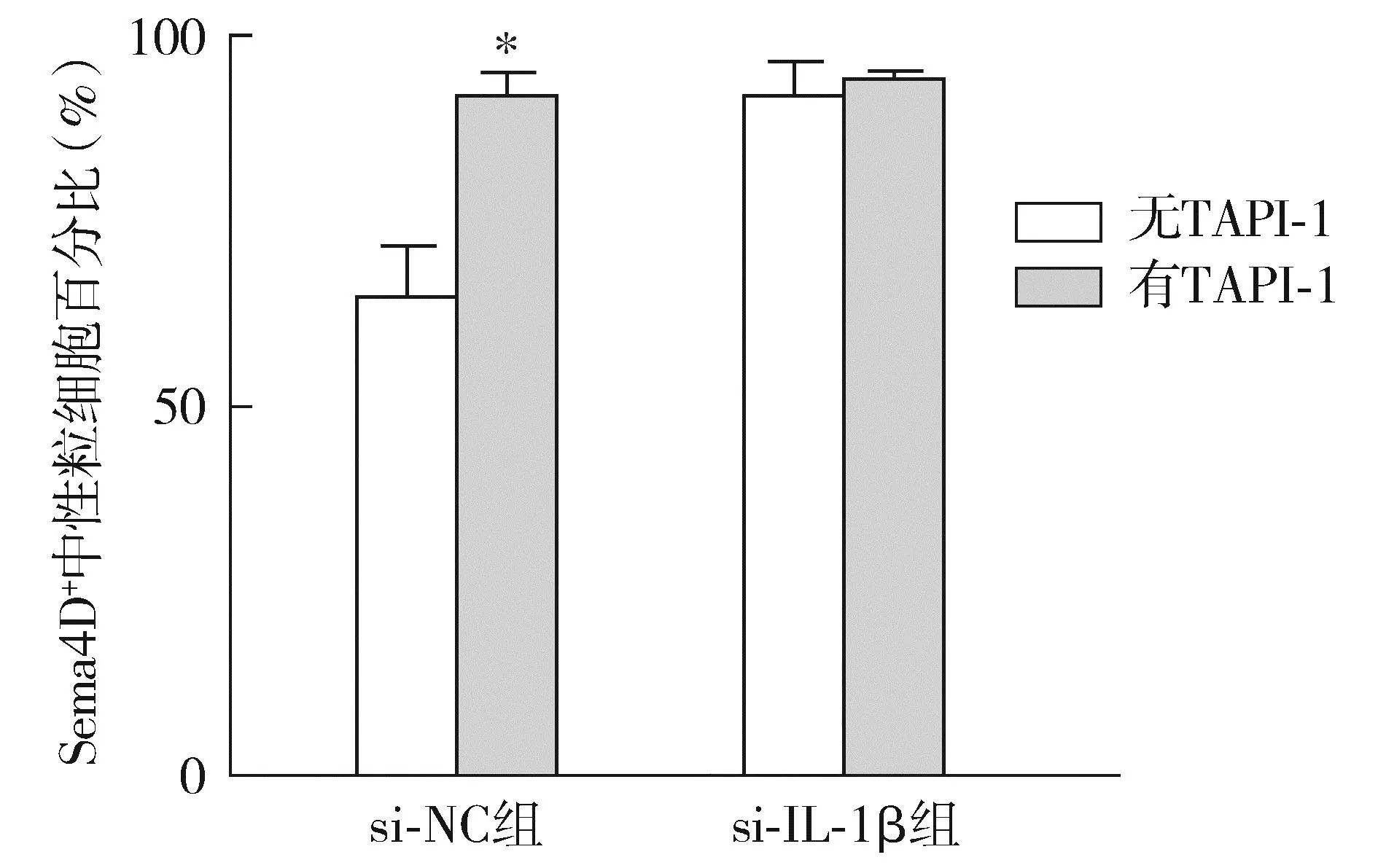
注:与无TAP-1比较,*P<0.05。图3 抑制ADAM17活性对中性粒细胞表达Sema4D的影响Figure 3 Effect of inhibiting ADAM17 activity on the expression of Sema4D in neutrophils
3 讨论
血管内皮细胞炎症反应是KD冠脉损伤的重要原因[7]。KD急性期炎症性内皮细胞分泌多种细胞因子,促进包括中性粒细胞在内的大量免疫细胞的迁移、浸润和活化。中性粒细胞是外周血含量最高的免疫细胞,在血管炎症性疾病中发挥重要作用[8]。KD患儿普遍存在外周血中性粒细胞升高现象,已成为KD发病早期的重要特征之一[9]。动物实验[10]和尸检[2]发现,KD早期冠脉病变部位有大量中性粒细胞浸润,说明中性粒细胞在急性期KD发病机制中起重要作用[11]。然而血管炎症处中性粒细胞激活的机制研究较少。本文发现HCAECs条件培养基能够显著提升中性粒细胞迁移能力和抑制中性粒细胞凋亡,表明HCAECs可能通过分泌某种细胞因子,活化中性粒细胞,进而促进冠脉损伤。
IL-1β是一种可与多种细胞相互作用的重要的促炎性细胞因子。IL-1β在KD发生发展中发挥关键作用,其受体抑制剂阿那白滞素已成为KD治疗的重要辅助手段[12]。血管内皮细胞是KD中IL-1β的来源细胞之一。多项研究发现,KD炎症刺激可促使内皮细胞分泌IL-1β等细胞因子[13]。本研究也发现经KD血清刺激的HCAECs高表达IL-1β,表明KD条件下内皮细胞通过分泌IL-1β影响炎症微环境。
中性粒细胞迁移能力增强有助于其跨内皮细胞浸润到血管壁。Li等[14]以早幼粒细胞白血病细胞系HL-60为研究对象,发现KD条件下中性粒细胞存在迁移能力增强的现象。本研究体外培养健康儿童中性粒细胞,通过Transwell实验发现,与si-NC组相比,si-IL-1β组HCAECs条件培养基处理的中性粒细胞的迁移能力明显下降,说明内皮细胞来源的IL-1β可促进中性粒细胞迁移,进一步提示在KD-CAL部位可能存在由IL-1β介导的内皮细胞和中性粒细胞的相互作用,阿那白滞素等阻断IL-1β信号通路的药物有可能通过阻止二者之间的交互作用发挥治疗功能。
中性粒细胞凋亡减少是KD外周血中性粒细胞数量升高的重要原因。Tsujimoto等[15,16]发现急性期KD中性粒细胞推迟凋亡而免疫球蛋白治疗可促进其凋亡。中性粒细胞推迟凋亡的现象可能与其内部高表达BCL2L1等抗凋亡基因有关[17]。本研究发现,与si-NC组相比,si-IL-1β组HCAECs条件培养基处理的中性粒细胞的凋亡增强,说明内皮细胞来源的IL-1β可作为外部因素抑制中性粒细胞凋亡。作为促炎因子,IL-1β一般表现为促进细胞凋亡[18]。然而本研究却发现在敲减IL-1β的HCAECs条件培养基中培养的中性粒细胞凋亡增强。这可能与培养环境有关,本研究所用的条件培养基是HCAECs在含20% KD血清的培养基中培养24 h后获得,条件培养基中所含的KD血清成分可能会影响IL-1β的生物学功能。也有可能IL-1β通过影响中性粒细胞的其他生物学表现而抑制凋亡。最近的一项研究发现肿瘤细胞来源的IL-1β促进中性粒细胞释放细胞外诱捕网(NETs)[19],而释放NETs的中性粒细胞多表现为推迟凋亡[20],因此推断KD条件下内皮细胞分泌的IL-1β可能通过促进中性粒细胞产生NETs而抑制其凋亡的方式发挥作用,然而这需要进一步地研究。
Sema4D是一种位于细胞膜上的信号素蛋白,细胞活化后可从细胞表面脱落为可溶性的仍具有生物学活性的分子。Nishide等[21]发现在抗中性粒细胞胞浆抗体相关性血管炎中,中性粒细胞分泌Sema4D增多,表明中性粒细胞过度活化。本课题组前期研究也发现在KD条件下,中性粒细胞表面Sema4D脱落是导致KD血清Sema4D升高的主要原因,且高浓度的Sema4D与KD严重程度有关[4]。本研究通过流式细胞术证明,与si-NC组相比,si-IL-1β组条件培养基处理的中性粒细胞表面Sema4D增加,表明内皮细胞来源的IL-1β是促进中性粒细胞活化并分泌Sema4D的原因之一。Sema4D的脱落与金属蛋白酶活化有关[22]。我们前期研究发现KD中Sema4D与ADAM17的浓度成正比[4]。为进一步探索中性粒细胞分泌Sema4D的机制,本研究抑制中性粒细胞ADAM17活性,结果显示,与未加ADAM17抑制剂比较,抑制ADAM17后,si-NC组条件培养基刺激的中性粒细胞分泌Sema4D明显减少;进一步的回复实验发现,si-IL-1β组条件培养基刺激的中性粒细胞分泌Sema4D无明显变化,表明内皮细胞来源的IL-1β通过激活ADAM17促进中性粒细胞脱落Sema4D。
综上所述,KD冠脉内皮细胞条件培养基高表达IL-1β并提高中性粒细胞迁移能力,抑制中性粒细胞凋亡;KD冠脉内皮细胞高表达IL-1β通过激活ADAM17促进中性粒细胞活化并分泌Sema4D,进而促进血管炎症反应。这些结果进一步揭示了IL-1β在KD冠脉病变中的致病机制,为靶向IL-1β信号通路治疗KD提供了理论依据。

