川崎病小鼠模型的超声心动图评估
张雪梅,郝 睿,焦富勇,娄 萍,张 丹,赵 欣,曹 玲,赵 颖,王俊香
(1陕西省人民医院超声诊断中心,西安 710068;2西安市第九医院超声医学科;3陕西省人民医院儿童病院儿科;*通讯作者,E-mail:994641857@qq.com)
川崎病(Kawasaki disease, KD)又称皮肤黏膜淋巴结综合征,是一种病因尚未明确的以变态反应性急性全身小血管炎为主的免疫系统疾病,好发于5岁以下婴幼儿[1],可严重危害患儿心血管系统,最易累及冠状动脉导致冠状动脉扩张和冠状动脉瘤[2],已经成为发达国家儿童后天获得性心脏疾病的第一位基础疾病[3]。患儿发病后,如果不及时有效地治疗,则极易引发其出现心血管疾病,甚至严重的可导致其死亡[4]。据相关研究报道患有KD的儿童心血管后遗症可延续到成年[5],因此早期诊断具有重要意义。但KD的发病机制及发病诱因虽然被广泛研究,但至今尚不明确,临床上尚无特异性检查标准用以诊断该疾病。目前冠状动脉病变组织样本取材困难,且缺少公认可靠的川崎病动物模型用于血管炎性损伤和冠状动脉瘤形成的发生机制研究。基于此符合临床特征的KD小鼠动物模型的建立有助于进一步研究其发病机制,预防严重并发症,为临床诊疗方法提供重要的实验依据。因此,本研究拟以干酪乳杆菌细胞壁成分(lactobacillus casei cell wall extract,LCWE)诱导小鼠KD模型为研究对象,利用高频小动物心脏超声仪,观察诱导下小鼠冠状动脉损伤及心功能的动态变化,评估高频小动物超声在小鼠KD疾病模型的诊断价值,为KD小鼠模型的制备及其功能评价提供依据。
1 材料和方法
1.1 材料
1.1.1 动物选择 随机选取BALB/c小鼠50只,体质量(17.0±0.5)g,无特定病原体,购自北京维顿利华实验动物技术有限公司,生产许可证:SCXK(北京)2016-0006,销售许可证:SYXK(陕西)2012-005。
1.1.2 主要试剂与仪器 乳酸菌肉汤培养基(杭州百思特生物技术有限公司);核糖核酸酶(RNAse)、脱氧核糖核酸酶(DNAse)、胰蛋白酶(Trypsin)、十二烷基硫酸钠(SDS),均从北京索莱宝科技有限公司购买;高分辨小动物超声仪(加拿大VISUALSONIC公司Vevo3100型),宽频探头(Mx400单晶片机械扇扫),聚焦深度为1.2 cm。光学电子显微镜(德国蔡司Zeiss Axio lab.A1);10%的甲醛溶液(天津市天力化学试剂有限公司)。
1.2 方法
1.2.1 干酪乳杆菌细胞壁提取物(LCWE)的制备 首先提取LCWE,将干酪乳酸杆菌菌种(贝纳细胞生物保存管理中心,第134415号)常规在乳酸菌肉汤培养基中培养24 h,收集处于对数生长期的细菌,加入4% SDS(Sigma公司,美国)裂解,以4 000 r/min离心30 min(离心半径8 cm),反复用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗,续贯的加入250 μg/mL RNA酶、DNA酶和胰蛋白酶,分别置于37 ℃培养箱中培养4 h,用PBS洗涤并离心后收集细菌碎片,以1 g湿重加入5 mL PBS,置于冰浴中进行超声细胞破碎仪裂解2 h(超声5 s,间隙5 s,功率300 W),将处理后的溶液低温高速离心机4 ℃ 15 600 r/min离心1 h(离心半径8 cm),收集上清即LCWE的终液。
1.2.2 KD小鼠模型的建立和实验分组 小鼠编号后,将50只小鼠随机分为模型组30只和对照组20只,模型组小鼠经腹腔注射LCWE的终液,单次注射0.5 mL;对照组小鼠同期不做任何处理。
1.2.3 小鼠心脏高分辨超声心动图检测 将小鼠用脱毛膏去除胸前被毛,分别于造模后第15,21,30天放入密封盒中,并吸入异氟烷麻醉气体后,待小鼠麻醉完成,将小鼠仰卧位固定在检查台上,同步记录小鼠心率和呼吸。当小鼠心率保持在400~500次/min时,用超声耦合剂涂抹于胸口,将高频超声探头固定在检查支架上进行超声检查。通过调节检查支架的角度和探头方向,进行超声测量,选取小鼠胸骨旁左心室长轴、主动脉短轴及左心室短轴等切面进行检查,观察左、右冠状动脉内径、内膜、管壁及厚度、回声、有无血栓、冠状动脉瘤等情况,测量和记录舒张末期左、右冠状动脉主干内径。采用M超记录小鼠左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)和左心室收缩末期内径(left ventricular end- systolic diameter,LVESD),并计算左心室射血分数(left ventricular ejection fraction,LVEF)及左心室短轴缩短率(left ventricular fractional shor-tening,LVFS),选取5个连续心动周期,提取超声参数并储存于后台。
1.2.4 病理检查 对照组及造模后第15,21,30天模型组分别处死1只小鼠并取出心脏标本,立即置于体积分数为10%的甲醛溶液固定。常规脱水、透明、石蜡包埋、4 μm连续切片,苏木素-伊红(HE)染色及弹力纤维染色(EVG),使用光学电子显微镜进行组织学形态观察。
1.3 统计学方法

2 结果
2.1 一般情况比较
模型组小鼠单次腹腔注射LCWE 12 h后,小鼠皮毛杂乱,无光泽,进食量和进水量均明显减少。对照组小鼠无上述类似表现。
2.2 超声心动图检查结果
对照组小鼠造模后15,21,30 d超声心动图显示冠状动脉血管壁无明显变化,呈纤细线状回声,回声强度低于主动脉根部;冠状动脉血管内缘光滑,管壁外缘与周围邻近组织分界清楚,未见冠状动脉瘤样扩张改变。模型组小鼠超声心动图观察到造模后15 d冠状动脉管壁内膜模糊、毛糙,动脉管壁及其周围邻近组织回声不清晰,出现明显高回声;造模后21 d冠状动脉管壁及其周围回声较造模后15 d增强,部分血管外缘呈片状回声增强且与周围回声不清,血管壁内膜明显毛糙,部分管腔形态不规则;造模后30 d冠状动脉管壁及其周围组织回声仍增强,部分存在冠状动脉管壁弥漫性增厚,血管壁内膜明显毛糙,管腔不规则,官腔狭窄(见图1)。
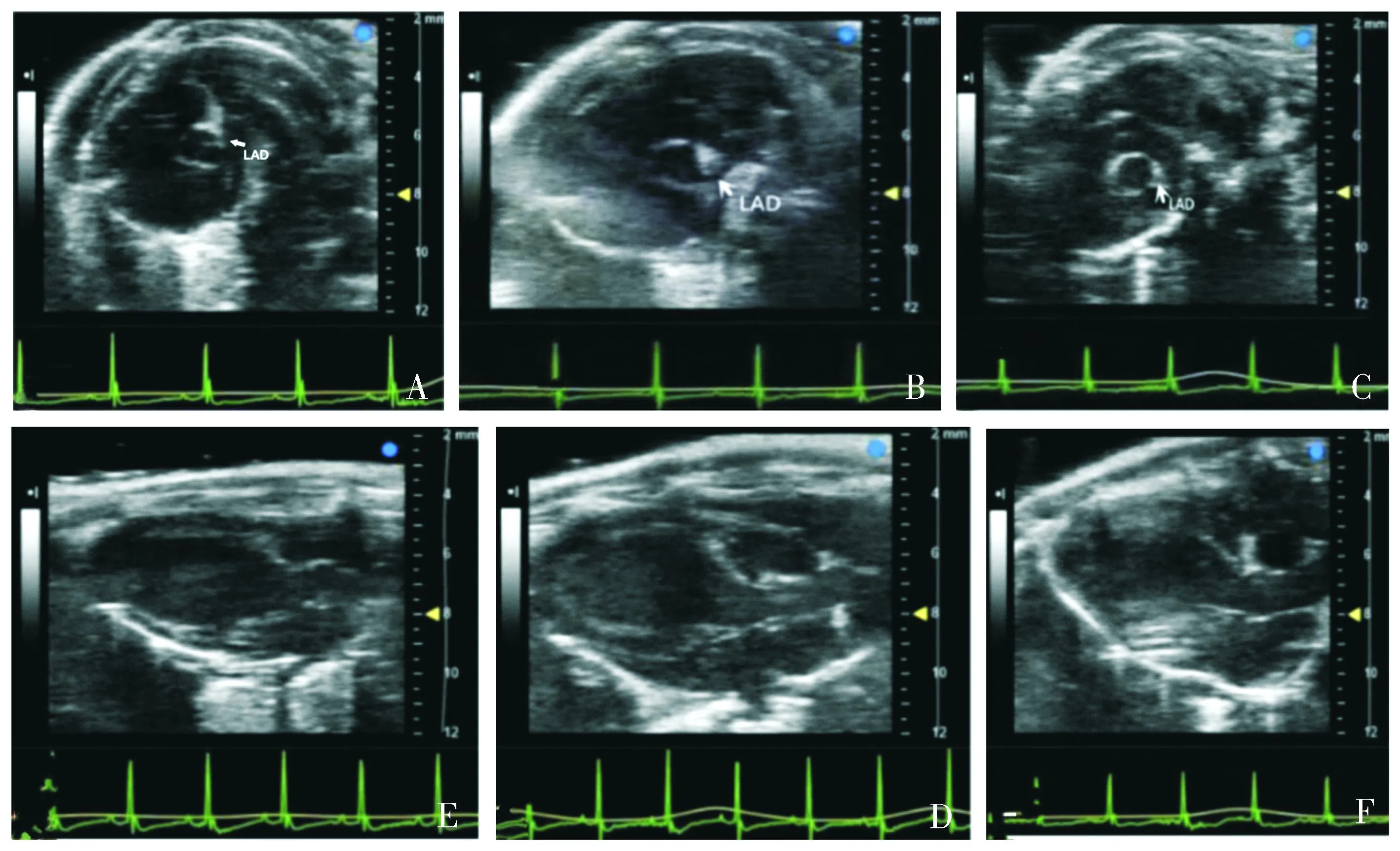
注:A.造模后15 d模型组小鼠表现为左冠状动脉血管内膜模糊;B.造模后21 d模型组小鼠表现为左冠状动脉管壁和管壁周围回声增强;C.造模后30 d模型组小鼠表现为左冠状动脉管壁和管壁周围仍有回声增强,管壁弥漫性增厚,管腔狭窄;D.造模后15 d模型组右冠状动脉血管内膜明显模糊、毛糙;E.造模后21 d模型组右冠状动脉管壁和管壁周围回声增强,部分呈冠状动脉瘤样扩张改变;F.造模后30 d模型组右冠状动脉管壁和管壁周围仍有回声增强,管壁弥漫性增厚,管腔狭窄。图1 模型组左、右冠状动脉的超声心动图Figure 1 Echocardiogram of left and right coronary artery in model group
2.3 冠状动脉内径值
对照组超声心动图显示冠状动脉形态正常,3个时间节点冠状内径无明显差异(见表1)。造模后21 d,模型组双侧冠状动脉内径明显大于对照组(均P<0.05);造模后15,30 d,左右冠状动脉内径与对照组比较差异均无统计学意义(均P<0.05,见表1)。
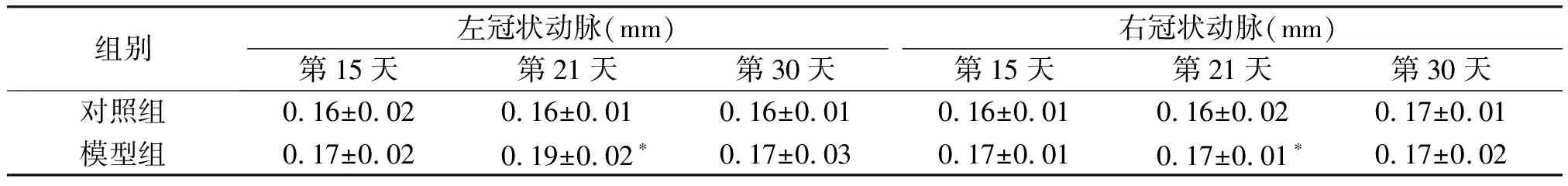
表1 造模后不同时点两组小鼠冠状动脉内径值比较
2.4 左心功能指标
造模后15 d模型组小鼠LVEDD、LVESD、LVEF及LVFS低于对照组(P<0.05);造模后21 d模型组小鼠LVEF及LVFS低于对照组(P<0.05);造模后30 d模型组小鼠LVEDD、LVEF及LVFS低于对照组(P<0.05,见表2)。

表2 造模后不同时点模型组与对照组心脏功能比较
2.5 病理检查结果
对照组小鼠心脏组织结构正常,间质无充血、出血及炎细胞浸润,肌壁间小型冠状动脉结构清楚,管壁无增厚,官腔无狭窄,腔内无血栓形成,内膜完整光滑无增厚,平滑肌细胞排列整齐,弹性纤维无断裂(见图2A)。模型组造模后15 d,小鼠心外膜间质水肿,可见少量淋巴细胞浸润及纤维结缔组织弥漫轻度增生,局部心肌纤维结缔组织增生并伴有固体钙盐沉着,其内的右冠状动脉管腔扩张及少量心肌细胞坏死崩解(见图2B);造模后21 d,小鼠心外膜局部可见多量淋巴细胞、嗜酸粒细胞、单核细胞浸润为主(见图2C);造模后30 d小鼠右冠状动脉管壁增厚,弹力纤维不连续,内膜轻度增厚,局部玻变,周围少数淋巴细胞浸润及纤维结缔组织增生,心外膜血管扩张,间质水肿,可见淋巴细胞浸润及纤维结缔组织弥漫轻度增生(见图2D)。

A.对照组 B.造模后15 d C.造模后21 d D.造模后30 d图2 对照组及模型组小鼠的心脏组织病理结果Figure 2 Pathological changes of heart tissue in control group and model group
3 讨论
KD发病机制及其病因目前尚不完全清楚,有研究认为川崎病是由免疫介导的,并由遗传易感因素与多种感染因子相互作用引起动脉炎症反应的结果[6]。由于患儿情况特殊,因此病理标本采集较为困难。近年来,国内外学者采用多种诱导剂构建KD动物模型[7],对深入研究KD的发病机制,发病诱因及治疗具有重大意义。到目前为止,许多研究者采用鼠、幼猪、幼兔和犬等动物模型研究KD血管病理改变引起的冠状动脉炎,但由于小鼠成本低,取材方便,所以目前国内外大多研究选择用小鼠构建模型,用于科研实验。干酪乳杆菌是定植在人类和哺乳动物肠道内的革兰阳性益生菌,不会导致致病作用。早在1983年,Lehman等[8]首次利用超声破碎法提取出LCWE,并将其单次腹腔注射于C57BL/6小鼠体内,成功诱导小鼠冠状动脉炎模型。随后,Noval Rivas等[9]通过多次实验该模型,结果表明LCWE诱导模型特征概括为炎性细胞浸润冠状动脉,冠状动脉中坏死性动脉炎,冠状动脉部分或完全阻塞等3个病理过程。LCWE诱导模型也可模拟KD冠状动脉狭窄,其特征是冠状动脉狭窄、严重的冠状动脉炎和弹性蛋白降解,且动脉腔内肌成纤维细胞增殖在冠状动脉狭窄的形成过程中至关重要[10],这与伴有冠状动脉瘤的KD患儿的组织学特征相似[11,12],因此我们可以得出小鼠模型是一种可靠反映KD冠状动脉炎的良好动物模型。
KD冠脉损伤是个动态演变的过程,但对于KD小鼠模型既往研究更多侧重于病理学方面,关于超声心动图或两者相关性的研究很少。目前判断小鼠KD模型是否成功主要通过病理检测结果,这种方法因为有创且不能重复、连续、动态地观察模型小鼠的冠脉损伤变化,因而对KD的进一步深入研究存在一定制约。超声成像因其安全、可重复、便捷等优点是KD评价的重要检查工具,可早期评估心脏功能,观察冠状动脉内径变化,成为临床上诊断和评估KD的首选方法,具有重大的临床价值[13,14]。超声成像因为空间分辨率和探查深度呈反比,在鼠类等小动物实验中成像质量上较为清楚,不受扫描深度的影响,因此可用高分辨率超声连续、反复、直观地观察小动物的心血管系统,并进一步监测冠脉内径、心脏的大小、心室壁的厚度、室壁运动、血流速度及瓣膜活动度等一系列反映心脏结构和功能变化的指标。本研究通过单次腹腔注射LCWE建立了炎症KD小鼠模型,并利用高频小动物超声心动图动态、全面观测及评价各阶段小鼠冠状动脉损伤情况,所有小鼠均可观察到清晰的冠状动脉图像,为评估KD小鼠模型冠状动脉损伤变化提供了有效的临床检查方法。
KD损害冠状动脉初期时多表现为起始处冠状动脉扩张,内膜增厚增强且管壁不光滑;急性期时超声改变为内径增大,伴管壁增厚毛糙,内膜回声不均匀增强;亚急性期时,动脉血管炎发生,形成动脉瘤及血栓阻塞,超声改变主要为形成较大的梭形、串珠形边界清楚的无回声暗区,冠状动脉内膜毛糙增厚,呈波浪样改变,暗区内可见有强或低回声的血栓形成。
本研究结果显示,腹腔注射LCWE后15 d,KD模型组小鼠冠状动脉主干内径与正常对照组比较无明显变化,冠状动脉管壁和管壁周围回声增强;LCWE注射后21 d其冠状动脉主干内径较正常对照组明显增宽,并呈内径增加的趋势,管壁内膜明显毛糙,管腔不规则;造模后30 d,KD模型组小鼠冠状动脉主干内径较前缩小,部分出现冠状动脉管壁弥漫性增厚。这一结果与临床KD患儿冠状动脉损伤的发病特点十分相似,说明该模型可成功模拟KD对冠状动脉血管及心脏功能的损伤作用,模型制备成功。通过高分辨小动物超声M型功能分析检测造模后15 d,模型组较对照组左室缩短率(FS)和射血分数(EF)显著减低,病理检查结果显示小鼠心外膜间质水肿,可见少量淋巴细胞浸润及纤维结缔组织弥漫轻度增生,说明该阶段模型组小鼠心脏已符合KD心肌炎表现。
综上所述,利用LCWE诱导KD小鼠建立模型,并通过高频小动物超声动态观察该模型小鼠冠状动脉及心功能变化,模拟KD对冠脉损伤的情况及对心脏功能的影响具有可行性[15]。同时,本研究结果证实了造模后小鼠冠状动脉的损伤及心脏功能变化的特征与患儿病程情况基本相似,可以很好地模拟KD心脏的变化,可以为KD的治疗、预防提供理论基础。

