下调DDX39A对食管鳞癌细胞生物学行为的影响及其机制
胡玮彬,孙玄子,张晓智,惠蓓娜
(西安交通大学第一附属医院肿瘤放疗科,西安 710061;*通讯作者,E-mail:zhangxiao-zhi@xjtu.edu.cn;#共同通讯作者,E-mail:nailpolish@126.com)
食管癌(esophageal cancer, EC)是全球排名第七的常见癌症,也是第六大癌症死亡原因[1]。食管癌的病理类型主要包括鳞癌(squamous cell carcinoma)和腺癌(adenocarcinoma),鳞癌占全球食管癌病例的70%,以中国北部及中亚、东南亚地区最常见[2]。尽管治疗手段不断改进,但食管癌的5年生存率仍不足10%,可手术切除患者的5年生存率仅为15%~40%[3]。因此,迫切需要寻找针对食管癌的潜在治疗靶点。
DEAD-box蛋白分子家族存在于从病毒到原核生物再到真核哺乳动物的多种物种中,是一类依赖于ATP的RNA解旋酶[4]。DEAD-box蛋白通过调节基因表达和RNA代谢,在生物体天然免疫功能的识别、细胞内信号通路的调控、RNA转录和剪接以及核表观遗传调控等方面发挥重要作用[5-7]。DDX39蛋白作为DEAD-box蛋白分子家族中的一员,已被越来越多的研究证实与肿瘤的发生发展密切相关。例如,在肝细胞癌中,DDX39可通过激活Wnt/β-连环蛋白途径(Wnt/β-catenin)促进肝癌细胞生长和转移[8]。Sugiura等[9]发现DDX39在肺鳞癌中上调,显示出RNA解旋酶活性和促癌作用。此外,还有研究表明DDX39是一种新的胃肠道间质瘤(gastrointestinal stromal tumors, GIST)预后生物标志物,为GIST的诊疗提供新思路[10]。DDX39A作为一类DDX39蛋白,同样也与肿瘤的形成紧密关联。少部分研究已报道DDX39A在神经母细胞瘤和乳腺癌中的促癌活性[11,12],然而,DDX39A在食管癌中的表达及生物学意义尚不清楚。
本研究拟从生物信息学角度出发,通过多种细胞功能实验,探究DDX39A对食管鳞癌细胞生物学行为的影响及其中可能的调控机制,以期为食管鳞癌的诊治提供新的分子靶点。
1 材料与方法
1.1 生物信息分析
从癌症基因组图谱(the cancer genome atlas, TCGA)获得82例食管鳞癌患者肿瘤样本和11例癌旁样本的转录组测序数据。从高通量基因表达数据库(gene expression omnibus, GEO)筛选出GSE38129数据集,该数据集通过GPL571平台采用Affymetrix Human Genome U133A 2.0 Array芯片对30例食管鳞癌患者的肿瘤组织和邻近正常组织进行了包含22 277个基因的转录组分析。使用R软件v4.0.3分别对TCGA和GEO的测序数据进行DDX39A基因的单基因表达差异性分析并得到相应的P值。
利用TCGA数据库中食管鳞癌患者的转录组测序数据,采用Spearman相关性分析,共检索到44 204个DDX39A相关基因,通过设定相关系数r>0.5且P<0.05,最终得到350个与DDX39A表达最相关的基因。使用KEGG rest API(https://www.kegg.jp/kegg/rest/keggapi.html)获取最新的KEGG Pathway的基因注释,并以此作为背景将基因映射到背景集合中,对相关基因进行基因集功能富集分析。从GSEA网站(http://software.broadinstitute.org/gsea/index.jsp)获得了GSEA软件(version 3.0),并从Molecular Signatures Database(http://www.gsea-msigdb.org/gsea/downloads.jsp)下载h.all.v7.4.symbols.gmt子集合,用以评估相关途径和分子机制。
1.2 细胞实验
1.2.1 细胞株及主要试剂 人食管鳞癌KYSE-150、TE-1细胞株由西安交通大学第一附属医院科研中心提供。RPMI-1640培养基、DPBS溶液以及Transwell试剂盒购自美国Corning公司,胎牛血清购自北京缔一生物科技有限公司,胰酶购自美国Gibco公司,Ham′s F-12完全培养基购自武汉Procell生命科技有限公司,Trizol购自上海普飞生物技术有限公司,结晶紫水溶液(0.5%)购自上海源叶生物科技有限公司,RIPA裂解液和MTT购自上海鼎国生物技术有限公司,DMSO购自上海试一化学试剂有限公司,凋亡试剂盒购自上海赛默飞公司,4%多聚甲醛购自国药集团化学试剂有限公司,PVDF膜购自美国Millipore公司,蛋白上样缓冲液购自武汉ASPEN生物技术有限公司,兔DDX39A一抗、兔CDH2一抗购自美国Abcam公司,HRP偶联Rabbit IgG二抗购自美国CST公司,鼠β-actin一抗购自美国Santa Cruz生物公司。以hU6-MCS-CMV-EGFP(GV115)为载体的RNA干扰(RNA interference, RNAi)阴性对照(Ctrl-RNAi)重组质粒和DDX39A-RNAi重组质粒由上海吉凯基因化学技术有限公司合成。针对目的基因DDX39A,为选择干扰效果较好的靶点进行后续实验,分别设计了3条特异性RNAi靶点序列。Ctrl-RNAi靶点序列:5′-TTCTCCGAACGTGTCACGT-3′;3条特异性RNAi靶点序列:①DDX39A-RNAi-1:5′-AGTTAATGTGGCAG-AACTT-3′;②DDX39A-RNAi-2:5′-GAGTCAACATCGTCTTTAA-3′;③DDX39A-RNAi-3:5′-AGGTGATAATCTTCGTCAA-3′。
1.2.2 细胞培养和慢病毒转染 将人食管鳞癌细胞KYSE-150和TE-1接种在含10%胎牛血清的RPMI-1640培养基中,于37 ℃、5% CO2的培养箱中培养,待细胞汇合度达80%左右传代培养。取处于对数生长期的细胞胰酶消化,完全培养基制成5×104个/mL细胞悬液接种于6孔板,待铺板量达到30%时分别加入适当比例Ctrl-RNAi和3种特异性DDX39A-RNAi重组慢病毒浓缩液,并将细胞分别定义为shCtrl组和shDDX39A-1、shDDX39A-2、shDDX39A-3组,无血清培养基培养2 h后加入RPMI-1640培养液继续培养72 h,荧光显微镜观察绿色荧光蛋白的表达,检测细胞状态和感染效率。细胞状态良好,感染效率达90%以上可收集细胞用于后续实验。
1.2.3 qPCR检测食管鳞癌细胞KYSE-150和TE-1中DDX39A的mRNA水平 靶向DDX39A不同序列的3种特异性重组慢病毒感染KYSE-150和TE-1细胞72 h后,利用qPCR检测DDX39A基因的敲减效率。根据Invitrogen公司的Trizol参考操作步骤提取总RNA,qPCR检测DDX39A mRNA的表达情况。DDX39A上游和下游引物序列分别为5′-CGTGCGGAATAGGAGCTTCAG-3′和5′-CTGCTTCTCGTGTGGTGTCA-3′,扩增大小为243 bp,以GAPDH为内参。反应条件为预变性95 ℃ 2 min;变性95 ℃ 15 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,40个循环。采用2-ΔΔCt法计算原始Ct值数据。
1.2.4 Western blot法检测食管鳞癌KYSE-150和TE-1细胞中DDX39A的蛋白表达水平 使用Western blot法检测靶向DDX39A不同序列的3种特异性重组慢病毒感染KYSE-150和TE-1细胞后DDX39A的蛋白表达水平。RIPA裂解液裂解shCtrl组和shDDX39A组的食管鳞癌细胞,离心并收集上清,加入蛋白上样缓冲液煮沸。根据DDX39A蛋白分子量大小配置好分离胶与浓缩胶后,将蛋白样品上样,在浓缩胶中进行电泳,分离,转至PVDF膜上,用封闭液封闭,加入兔DDX39A一抗(稀释度为1∶1 000)4 ℃过夜,TBST洗膜3次后加入HRP偶联Rabbit IgG二抗(稀释度为1∶5 000),孵育,TBST洗涤后加配制的ECL混合溶液(显色液A液和B液按1∶1等体积配制),于暗室中曝光,化学发光仪显影成像。
1.2.5 MTT法检测食管鳞癌细胞KYSE-150和TE-1的细胞活力 将处于对数生长期的shCtrl组和shDDX39A组(shDDX39A-3,敲减效率较好)的食管鳞癌细胞KYSE-150和TE-1使用胰酶消化并离心后,RPMI-1640完全培养基重悬成细胞悬液,细胞计数仪计数。在96孔板接种含细胞2 000个/孔的100 μL细胞悬液,每组设5个复孔重复铺板,待细胞完全沉淀后显微镜下观察细胞密度,随后放入培养箱中培养。铺板后第2天开始,于培养终止前4 h每孔中加入20 μL 5 mg/mL的MTT,无需换液,4 h后完全吸去培养液,加入100 μL DMSO溶液溶解甲瓒颗粒。将待测96孔板置于振荡器中振荡2~5 min,避光条件下酶标仪490 nm和570 nm检测OD值,进行数据统计分析。
1.2.6 Celigo法和克隆形成实验检测食管鳞癌细胞KYSE-150和TE-1的增殖能力 经慢病毒感染3 d后,将shCtrl组和shDDX39A组的KYSE-150和TE-1食管鳞癌细胞分别铺于96孔板,铺板数为1 500个/孔,每组3复孔,置于37 ℃、5% CO2培养箱培养。从铺板后第2天开始,每天使用Celigo仪检测读板1次,连续检测读板5 d,计算出每次扫描孔板中带绿色荧光的细胞的数量,进行统计分析,绘制细胞增殖曲线。
将shCtrl组和shDDX39A组的食管鳞癌细胞KYSE-150和TE-1制成单细胞悬液接种于6孔板(400~1 000个/孔),每组设3个复孔,培养到大多数单个克隆中细胞数大于50为止。每隔3 d进行换液并观察细胞状态。荧光显微镜下对细胞克隆进行拍照,PBS洗涤细胞1次。每孔加入1 mL 4%多聚甲醛,固定细胞60 min,PBS洗涤细胞1次。最后每孔加入结晶紫染液1 000 μL,染细胞10~20 min,ddH2O洗涤细胞数次,晾干,数码相机拍照,计数统计分析。
1.2.7 FACS检测食管鳞癌细胞KYSE-150和TE-1的凋亡水平 使用Annexin Ⅴ-APC单染法检测细胞凋亡。胰酶消化shCtrl组和shDDX39A组的食管鳞癌细胞KYSE-150和TE-1,完全培养基重悬成细胞悬液,与上清细胞收集于同一5 mL离心管中,每组设3个复孔,1 300 r/min离心5 min,弃上清,4 ℃预冷的PBS洗涤细胞沉淀。1×binding buffer洗涤细胞沉淀一次,1 300 r/min、3 min离心,收集细胞。200 μL 1×binding buffer重悬细胞沉淀,使细胞悬液最终密度为1×106~1×107/ml。加入10 μL Annexin Ⅴ-APC染色,室温避光10~15 min,上机检测。
1.2.8 Transwell实验检测食管鳞癌细胞KYSE-150和TE-1的迁移和侵袭能力 使用Corning转移试剂盒检测细胞迁移能力。将小室置于24孔板中,上室加100 μL无血清培养基,37 ℃培养箱中放置1 h。将shCtrl组和shDDX39A组食管鳞癌细胞KYSE-150和TE-1制备成无血清细胞悬浮液,除去上室中的培养基后加入100 μL细胞悬液,下室内加入600 μL 30% FBS培养基。37 ℃培养箱培养,倒扣小室于吸水纸上以去除培养基,用棉拭子移去小室内非转移细胞,将小室置于4%多聚甲醛固定液中固定半小时后,将小室捞出,用吸水纸吸干小室表面固定液,滴1~2滴染色液到膜的下表面染色转移细胞1~3 min后,将小室浸泡冲洗数次,空气晾干。每个Transwell小室随机选取视野,拍照计数,进行数据分析。
使用Corning侵袭试剂盒检测细胞侵袭能力。将小室置于24孔板中,上、下小室各加500 μL无血清培养基,37 ℃培养箱中放置2 h使Matrigel基质层再水化。将shCtrl组和shDDX39A组的食管鳞癌细胞KYSE-150和TE-1制备成无血清细胞悬浮液,待Matrigel基质层再水化完成后,将小室全部转移至新的孔板中,除去上室中培养基并加入200 μL细胞悬液,下室内加入750 μL 30% FBS培养基。37 ℃培养箱培养后,倒扣小室于吸水纸上以去除培养基,用棉拭子移去小室内非侵袭细胞,滴2~3滴染色液到膜的下表面染色侵袭细胞3~5 min后,将小室浸泡冲洗数次,空气晾干。每个小室随机选取视野,拍照计数,进行数据分析。
1.2.9 免疫印迹实验筛选DDX39A的下游分子 选择包括AKT、mTOR、ERK、MYC、CDH2等在内的部分肿瘤相关经典通路分子,探究敲减DDX39A对其蛋白表达水平的影响。RIPA裂解液裂解shCtrl组和shDDX39A组食管鳞癌KYSE-150细胞,离心并收集上清,加入蛋白上样缓冲液煮沸。根据各下游蛋白分子量大小配置好分离胶与浓缩胶后,上样,进行电泳分离,转至PVDF膜上,用封闭液封闭,加入各一抗稀释液4 ℃过夜,TBST洗膜3次后加入二抗稀释液,孵育,TBST洗涤后加配制的ECL混合溶液(显色液A液和B液按1∶1等体积配制),于暗室中曝光,化学发光仪显影成像。
1.2.10 回复实验检测过表达CDH2对shDDX39A细胞功能的回复作用 过表达Twist、c-Myc、Vimentin、CDH2这4个敲减DDX39A后蛋白表达明显下调的分子,利用Celigo法探究其对DDX39A敲减细胞增殖能力的影响。实验分组情况如下:①shCtrl+NC-OE组:转染shCtrl慢病毒和过表达空载对照病毒的KYSE-150细胞;②shDDX39A+NC-OE组:转染shDDX39A慢病毒和过表达空载对照病毒的KYSE-150细胞;③shDDX39A+Twist-OE组:转染shDDX39A慢病毒和过表达Twist病毒的KYSE-150细胞;④shDDX39A+c-Myc-OE组:转染shDDX39A慢病毒和过表达c-Myc病毒的KYSE-150细胞;⑤shDDX39A+Vimentin-OE组:转染shDDX39A慢病毒和过表达Vimentin病毒的KYSE-150细胞;⑥shDDX39A+CDH2-OE组:转染shDDX39A慢病毒和过表达CDH2病毒的KYSE-150细胞。Celigo法实验方法同1.2.6。
在DDX39A敲减的食管鳞癌细胞KYSE-150中过表达CDH2(对DDX39A敲减细胞的增殖能力回复作用最明显),按1.2.5和1.2.8项下内容利用MTT法以及Transwell实验探究其对DDX39A敲减细胞的细胞活力以及转移能力的影响。
1.3 裸鼠成瘤实验探究敲减DDX39A对体内癌细胞的作用
将20只裸鼠分为2组,每组10只。取处于对数生长期的shCtrl和shDDX39A的KYSE-150食管鳞癌细胞制成悬液,分别注射于裸鼠右侧腹股沟处,并分别命名为对照组(NC组)和DDX39A敲减组(KD组)。于接种细胞后第9天开始测量肿瘤的长短径并计算肿瘤体积(肿瘤体积=π/6×长径×短径2),之后分别于第12,15,18天再次测量并记录。至接种细胞后第21天处死小鼠,完整取出瘤块测量长短径、计算体积、称重并白板拍照。
1.4 统计学分析

2 结果
2.1 DDX39A在食管鳞癌肿瘤组织中表达显著上调
TCGA数据库差异性分析结果显示:DDX39A在食管鳞癌肿瘤组织中的表达明显高于正常组织(P<0.001,见图1A)。GEO数据库GSE38129数据集的单基因表达分析结果显示:相较于配对正常组织,DDX39A在食管鳞癌肿瘤组织中高表达(P<0.001,见图1B)。

注:与癌旁组织相比,***P<0.001。图1 DDX39A在食管鳞癌患者肿瘤组织和癌旁组织中的表达差异Figure 1 Differential expression of DDX39A in tumor tissues and paracarcinoma tissues from ESCC patients
2.2 DDX39A及其相关基因的富集分析
KEGG分析结果显示:DDX39A及其相关基因主要参与RNA剪接、切除修复以及核糖体的生物合成等过程(见图2A)。GSEA基因集富集分析的结果显示,癌症初始化(如原癌基因MYC标记)和细胞凋亡相关信号通路(如干扰素γ和PI3K-AKT信号通路)显著富集(见图2B)。

图2 DDX39A及其相关基因的功能富集分析Figure 2 Functional enrichment analysis of DDX39A and its related genes
2.3 转染慢病毒后食管鳞癌细胞中DDX39A的mRNA和蛋白水平
qPCR实验结果表明:在KYSE-150细胞系中,shDDX39A-1组、shDDX39A-2组和shDDX39A-3组DDX39A基因的mRNA表达丰度分别为0.202,0.194和0.172;在TE-1细胞系中,shDDX39A-1组、shDDX39A-2组和shDDX39A-3组DDX39A基因的mRNA表达丰度分别为0.453,0.275和0.239(见图3A)。免疫印迹实验结果表明:在KYSE-150和TE-1细胞系中,shDDX39A-2组DDX39A蛋白表达水平相对最低,shDDX39A-3组DDX39A蛋白表达水平也相对较低(见图3B)。综合考虑后选择敲减效率较好的shDDX39A-3组细胞进行后续实验。
2.4 敲减DDX39A抑制食管鳞癌细胞的增殖能力和活力
通过Celigo法分别获得了KYSE-150和TE-1细胞shCtrl组和shDDX39A组在不同时间点下细胞的生长情况,并绘制了基于细胞计数值的增殖曲线,结果显示:与shCtrl组相比,shDDX39A组细胞的增殖显著降低(P<0.001,见图4)。克隆形成实验结果表明:与shCtrl组相比,shDDX39A组细胞集落形成的数量明显减少(P<0.01,见图5)。MTT实验结果提示:shDDX39A组具有活力的细胞数量较shCtrl组减少,细胞活力降低(P<0.001,见图6)。

图4 Celigo法检测敲减DDX39A对KYSE-150和TE-1细胞生长的影响Figure 4 Effect of knocking down DDX39A on the growth of KYSE-150 and TE-1 cells detected by Celigo assay
2.5 敲减DDX39A促进食管鳞癌细胞凋亡
流式细胞术检测结果显示:shDDX39A组较shCtrl组发生凋亡的KYSE-150和TE-1细胞显著增加(P<0.01,见图7),提示DDX39A可抑制食管鳞癌细胞发生凋亡。
2.6 敲减DDX39A抑制食管鳞癌细胞迁移和侵袭
Transwell迁移实验结果显示:与shCtrl组相比,shDDX39A组发生迁移的KYSE-150和TE-1细胞数量降低,细胞的迁移能力受到抑制(均P<0.001,见图8)。同样,Transwell侵袭实验的结果显示:shDDX39A组侵袭至基质胶底部的细胞数较shCtrl组显著减少(P<0.001,见图9),表明敲减DDX39A也可抑制食管鳞癌细胞的侵袭能力。

注:与shCtrl组相比,***P<0.001。图8 敲减DDX39A对KYSE-150和TE-1细胞迁移能力的影响Figure 8 Effect of knocking down DDX39A on migration abilities of KYSE-150 and TE-1 cells
2.7 在体内敲低DDX39A可抑制食管鳞癌肿瘤生长
裸鼠移植瘤实验结果显示:相比于NC组,KD组小鼠瘤体的体积和质量均明显减少(P<0.001,见图10),提示敲低DDX39A在体内也可抑制肿瘤的生长。
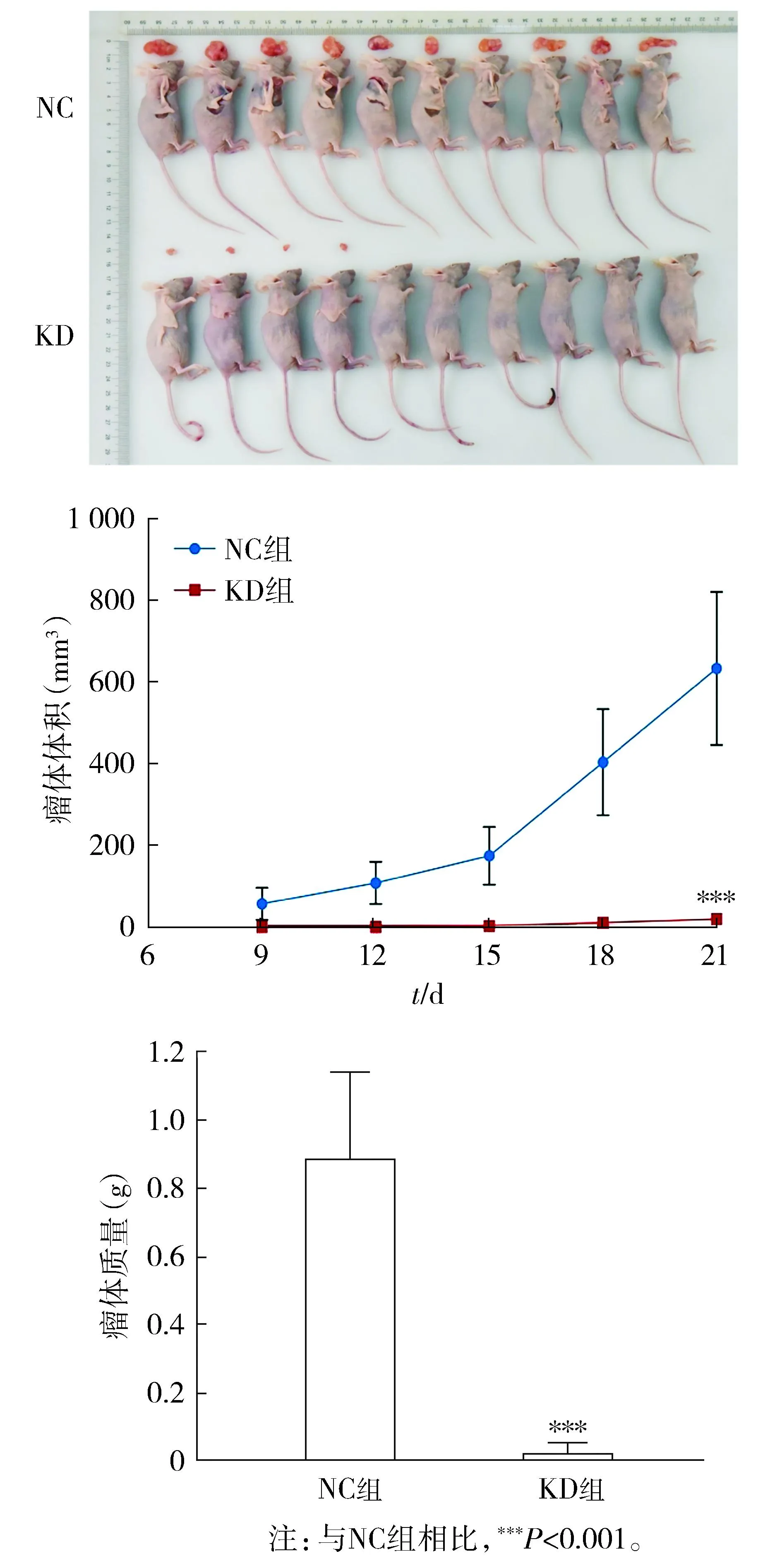
图10 食管鳞癌细胞KYSE-150移植裸鼠成瘤情况 Figure 10 The tumorigenesis of esophageal squamous cell KYSE-150 transplanted nude mice
2.8 DDX39A下游作用分子的筛选
免疫印迹实验结果显示:食管鳞癌KYSE-150细胞中DDX39A基因敲减后,下游CDH2(Cadherin 2),Twist,c-Myc,Vimentin,p-p38,p-AKT蛋白表达明显下调,而E-Cadherin蛋白表达明显升高(见图11)。选择Twist、c-Myc、Vimentin、CDH2这4个下调相对明显基因进行进一步筛选。基于Celigo法获得的细胞增殖曲线可见,相比shCtrl+NC-OE组,shDDX39A+NC-OE组细胞增殖水平明显减缓;相较于shDDX39A+NC-OE组,shDDX39A+Twist-OE组、shDDX39A+c-Myc-OE组和shDDX39A+Vimentin-OE组细胞增殖趋势没有明显回复,shDDX39A+CDH2-OE组细胞增殖趋势回复最明显(P<0.001,见图12)。

图11 KYSE-150细胞敲减DDX39A后部分肿瘤相关经典通路分子的蛋白表达水平Figure 11 Protein expression levels of tumor-associated classical pathway molecules in KYSE-150 cells after knocking down DDX39A
2.9 下游基因CDH2对目的基因DDX39A的功能回复作用
细胞增殖活力检测结果显示:相比shCtrl+NC-OE组,shDDX39A+NC-OE组KYSE-150细胞活力降低(P<0.001);与shDDX39A+NC-OE组相比,shDDX39A+CDH2-OE组细胞活力增加(P<0.001,见图13)。Transwell实验结果表明:相比shCtrl+NC-OE组,shDDX39A+NC-OE组KYSE-150细胞转移能力减弱(P<0.001);而相比于shDDX39A+NC-OE组,shDDX39A+CDH2-OE组细胞的转移能力增强(P<0.001,见图14)。

注:与同时点shCtrl+NC-OE组相比,###P<0.001;与同时点shDDX39A+NC-OE组相比,**P<0.01,***P<0.001。图13 MTT法检测过表达CDH2对DDX39A敲减细胞活力的影响Figure 13 Effect of overexpressing CDH2 on viability of KYSE-150 cells after DDX39A knockdown detected by MTT assay
3 讨论
食管癌是临床难治性恶性肿瘤之一,发病率高且早期症状不典型,尽管手术切除、放化疗、免疫治疗等治疗方式不断完善,但因其恶性程度较高,一部分患者在治疗后仍可复发,提示预后不良[13]。近年来随着分子生物学技术的不断进步,遗传分子水平因素在肿瘤发病机制中扮演的角色越来越受到关注[14]。有研究表明DDX39A在部分肿瘤中高度表达并与患者的预后相关,然而其在食管癌中的作用目前尚未报道。因此,本研究进行了生物信息学分析及细胞功能学相关实验,旨在探究DDX39A在食管癌中的表达及其对食管癌细胞生物学行为的影响和潜在的分子机制。
首先通过生物信息学方法证实了DDX39A在食管鳞癌中表达显著上调,进一步对DDX39A及其相关基因的富集分析提示DDX39A主要参与遗传信息的翻译与加工和细胞凋亡等过程。随后的Celigo法、克隆形成和MTT实验显示敲减DDX39A在体外可降低食管鳞癌细胞的增殖能力和活力。流式细胞分析的结果显示下调DDX39A的表达可以促进癌细胞发生凋亡。Transwell实验表明敲减DDX39A还可以抑制食管鳞癌细胞的迁移、侵袭能力。此外,我们还构建了移植瘤模型,证实了敲低DDX39A在裸鼠体内也可抑制肿瘤的生长。
先前大量的研究已表明,DEAD-box家族的蛋白可以促进癌细胞的异型增生和恶性转化[15],但其中具体的机制尚不清楚。作为DEAD-box家族中的一员,Karni等[16]曾报道DDX39可能通过与其他剪接因子如SF2/ASF相互作用而发挥致癌作用。Su-giura等[17]提出DDX39和CIP29(一种增殖与凋亡调节蛋白)结合形成的复合物可以通过与RNA结合蛋白FUS/TLS结合来调节细胞周期。此外,Pérez-Calero等[18]的实验结果提示UAP56/DDX39是维持RNA结构稳定的关键螺旋酶,干扰其合成可阻断癌细胞的转录和复制。本研究对下游可能作用分子的免疫印迹实验显示敲减DDX39A后,CDH2,Twist,c-Myc,Vimentin蛋白表达明显下调,而E-Cadherin蛋白表达明显升高,提示DDX39A很可能通过诱导上皮间充质转化促进肿瘤细胞的生长、迁移与侵袭。回复实验结果显示,过表达CDH2对DDX39A敲减细胞的增殖趋势回复最明显,且过表达CDH2的MTT和Transwell等实验均表明下游基因CDH2对目的基因DDX39A有功能回复作用,这表明CDH2很有可能是DDX39A促EMT的直接作用靶点,但相关具体机制仍需进一步探究。
总之,本研究首次揭示了DDX39A可通过调控EMT相关通路影响食管鳞癌细胞的恶性生物学行为,这将为后续分子机制的研究以及寻找有效的抗癌靶点提供参考。

