饲料中维生素A对黄鳝生长性能、肠道微生物组成和肠道组织结构的影响
黄广华,胡重华,周秋白,张锦华,陈希环,周磊涛,张文平,陈恺文
(1.江西农业大学动物科学技术学院,南昌 330045;2.南昌市特色水生生物营养生理与健康养殖重点实验室,南昌 330045)
适宜维生素A(VA )对鱼类正常生长、发育和繁殖有重要作用[1],在动物体内可维持细胞膜以及上皮组织的完整性、通透性[2];对鱼类免疫细胞以及鱼类体液免疫因子也能产生积极的作用[3]。研究表明,适宜VA可以提高牙鲆(Paralichthysolivaceus)子代幼鱼正常的比例[4],也可提高草鱼(Ctenopharyngodonidellus)[5]、青鱼(Mylopharyngodonpiceus)[6]、加州鲈(Micropterussalmoides)[7]的生长性能。然而,维生素缺乏或过量都会影响鱼类健康生长。当VA 缺乏时会影响与抗氧化能力相关的物理屏障功能,加剧细胞凋亡[8],从而导致花鲈(Lateolabraxmaculatus)[2]、尼罗罗非鱼(Oreochromisniloticus)幼鱼[9]等鱼类生长减缓、死亡率升高、皮肤充血、鳃盖扭曲等;当VA过量时可增加鱼类的死亡率、抑制生长或者使得鱼类出现脊椎异常生长,以及出现肝脏指数降低等一系列不良情况[7]。
黄鳝(Monopterusalbus)味道鲜美,营养丰富,常生活于水体底层,主要以各种水生动物为食。随着人工养殖规模和养殖密度的增加,环境及饵料等因素的胁迫均会影响黄鳝生长和免疫,而营养调控可作为一种有效改善黄鳝生长及提高其免疫能力的措施。动物的肠道是抵御病原体入侵的重要物理屏障[10],肠道微生物与宿主的健康、疾病密切相关[11],肠壁厚度、肠道皱襞高度也影响着宿主消化吸收营养物质[12]。因此本实验以1龄人工养殖黄鳝幼苗为实验对象,在饲料中添加不同量VA,分析其对黄鳝生长、肠道结构发育以及肠道微生物组成的影响,探究VA对黄鳝的影响机制,以期为黄鳝营养学研究提供基础。
1 材料与方法
1.1 实验设计及材料
实验所需黄鳝选自江西农业大学水产养殖基地,体质健壮、规格整齐[均重(7.32±0.02)g],实验分为7组,每组4个重复,每个重复45尾。本实验采用单因素实验设计,VA醋酸酯(50万IU/kg)作为添加源,添加水平分别为0(3 201)、500(3 620)、1 000(4 010)、2 000(4 730)、4 000(6 510)、8 000(9 720)、16 000(16 890)IU/kg(括号内为VA在饲料中的实测值),编号为A~G。所有饲料原料经80目过筛处理,饲料制粒后风干,保存于-20 ℃冰箱备用。饲料原料及配方见参考文献[13]。
1.2 饲养管理
实验于江西农业大学水产养殖基地进行。实验开始前将黄鳝暂养于养殖箱中7 d。正式实验养殖时间为70 d。整个实验期间水温为20.9~29.5 ℃,保持pH在6.5~7.4之间,溶解氧大于5 mg/L,氨氮浓度不高于2.0 mg/L,亚硝酸盐浓度不高于0.01 mg/L,每日18:00投喂1次,投喂量以大部分黄鳝停止摄食为止。
1.3 样品采集处理
养殖结束后,停止投喂24 h后,从每箱中随机选取4尾黄鳝运回实验室解剖取样。先将黄鳝称重、测量体长后尾静脉采血,采血完成后将黄鳝置于无菌冰盘上解剖。取黄鳝肠道内容物于1.5 mL无菌管中,液氮速冻后转移至-80 ℃超低温冰箱保存,将4尾黄鳝肠道内容物混为一个样,每组3~4个平行。取前肠于4%多聚甲醛中固定,用于苏木精-伊红染色。
1.4 测定方法
前肠经4%多聚甲醛固定后,用于HE切片制备。肠道内容物按照建库要求抽提样品DNA,1%的琼脂糖凝胶电泳检测抽提的基因组DNA,并将通过质量检验的DNA样品用338F和806R引物特异扩增细菌16S rRNA保守的V3-V4区域,于上海美吉生物科技有限公司进行测序,用于肠道微生物组成分析。每个实验组的黄鳝计数、称重,计算黄鳝的生长性能指标,增重率(WGR)、特定生长率(SGR)计算公式如下:
WGR=(W2-W1)/W1×100%
SGR=(lnW2-lnW1)/t×100%
式中W1、W2分别为实验鱼的初、末均体重(g),t为实验天数(d)。
1.5 数据处理与分析
应用Nikon ECLIPSE Ci观察拍照组织切片,用Image-Pro Plus6.0测量分析前肠组织的绒毛高度、微绒毛高度、肌层厚度、粘液细胞数量。对测序获得的原始数据进行过滤、质控等处理。以97%的相似性对数据进行去嵌合体和聚类后的OTU序列采用RDP Classifier进行分类学分析。根据SILVA数据库对每个OTU的代表序列进行筛选、标注信息。采用Mothur进行Alpha多样性分析,并绘制稀释曲线。用Qiime进行beta多样性分析,LEfSe多级物种判别分析,PICRUSt对OTU丰度表标准化并进行KEGG功能注释。采用SPSS22.0、STAMP等软件对数据进行差异分析,P<0.05为显著差异,有统计学意义。
2 结果
2.1 饲料不同VA水平对黄鳝生长性能的影响
如图1所示,B~D组黄鳝增重率、特定生长率显著高于A组。以特定生长率为评价指标,采用折线回归得出黄鳝对饲料VA适宜需求量为3 849.96 IU/kg(图2)。

图1 饲料不同VA水平对黄鳝生长性能的影响Fig.1 Effects of dietary vitamin A level on growth performance of M.albus

图2 饲料不同VA水平与黄鳝特定生长率的关系Fig.2 Relationship between dietary vitamin A level and SGR of M.albus
2.2 饲料VA水平对黄鳝肠道结构的影响
饲料VA水平对黄鳝肠道结构的影响如表1所示。随着饲料维生素A水平的升高,前肠绒毛高度、微绒毛高度以及肌层厚度呈先上升后下降的趋势。与A组相比,B~G组绒毛高度和C组微绒毛高度显著升高;C~D组肌层厚度和C~E组粘液细胞数量均显著升高。
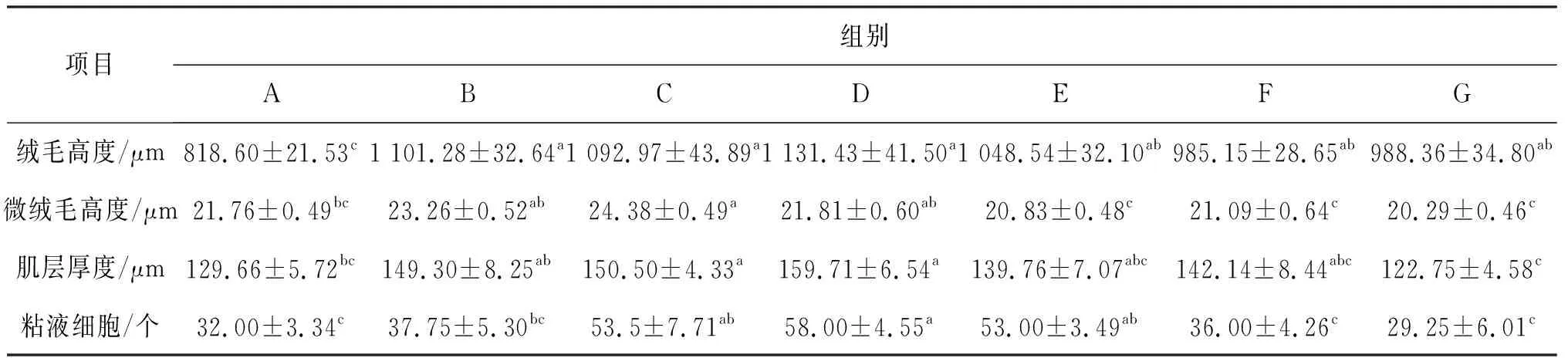
表1 饲料VA水平对黄鳝肠道结构的影响Tab.1 Effects of dietary VA levels on intestinal morphology of M.albus
2.3 饲料VA水平对黄鳝肠道菌群结构的影响
2.3.1 饲料VA水平的黄鳝肠道菌群Alpha多样性差异
综合考虑,选取A、D、G组黄鳝肠道内容物进行比较分析。稀释曲线(图3a)显示样品中大部分的OTU都能被检测到。由表2可知,Sobs指数、Chao1指数、ACE指数、Shannon指数均为D组最高,但三组的Alpha多样性无显著性差异。
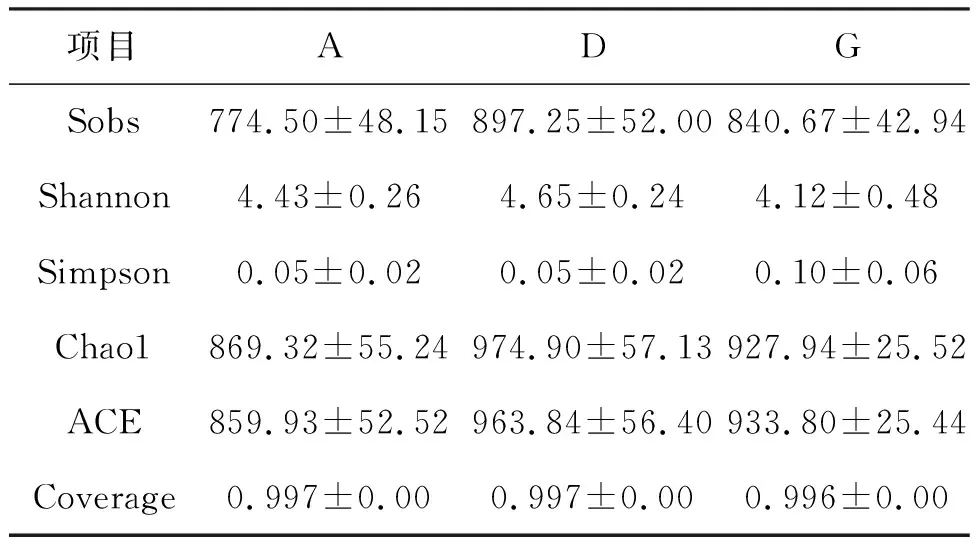
表2 三组样品菌群Alpha多样性差异Tab.2 Differences in Alpha diversity of three sample groups
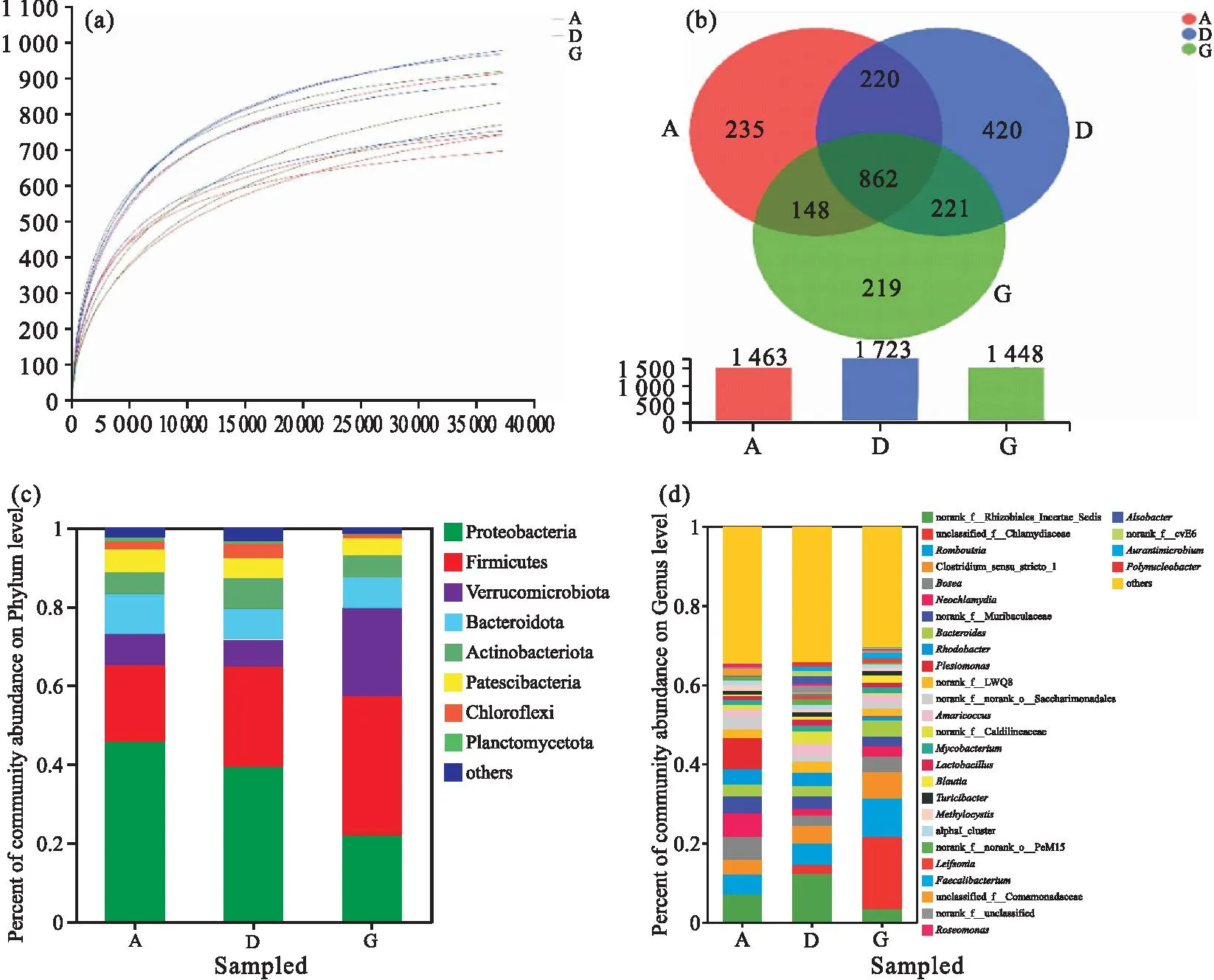
图3 三组样本黄鳝肠道菌群分析Fig.3 Intestinal microflora analysis of M.albus in three groups of samples(a)稀释曲线;(b)维恩图;(c)门水平物种组成;(d)属水平物种组成
2.3.2 饲料VA水平的黄鳝肠道菌群物种组成
基于OTU水平构建维恩图(图3b),结果显示,A组、D组、G组共有的OTU数量为 862 ,各组特有OTU数量分别为235、420、219,总OTU数量分别为1 463、1 723、1 448。
为了进一步了解饲料VA水平对黄鳝肠道菌群的影响,合并丰度小于1%的部分,分别比较在门、属水平黄鳝肠道菌群丰度差异。结果发现A组主要以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)为主;D组主要以变形菌门、厚壁菌门、拟杆菌门、放线菌门(Actinobacteriota)为主;G组以变形菌门、厚壁菌门、疣微菌门(Verrucomicrobiota)为主(图3c)。在属水平上发现所有样品集中在30个属上(图3d)。三个不同处理组的Others属占比都较大,D组黄鳝肠道属水平菌群多样性高于另两组。A组黄鳝肠道的根瘤菌属(Rhizobium,7.11%)、邻单胞菌属(Plesiomonas,7.85%)、Neochlamydia(6.09%)丰度较高,D组黄鳝肠道则以根瘤菌属(12.40%)、罗姆布茨菌属(Romboutsia,5.48%)为主;G组黄鳝肠道以衣原体(Chlamydia,18.24%)、罗姆布茨菌属(9.60%)、狭义梭菌属(Clostridiumsensustricto,6.78%)为主。
2.3.3 饲料VA水平的黄鳝肠道菌群差异分析
在采用bray curtis算法进行PCoA分析时(图4),三组不能分离开。而采用PLS-DA进行分析时(图5),三组都可以分离开来,说明饲料中不同VA水平显著影响了黄鳝肠道菌群组成。
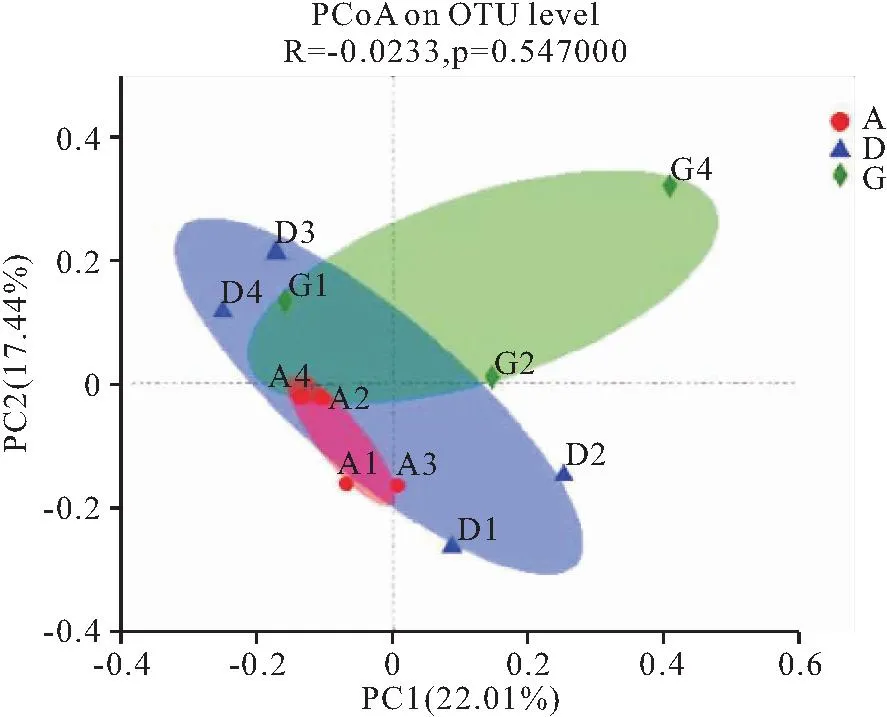
图4 PCoA图Fig.4 PCoA
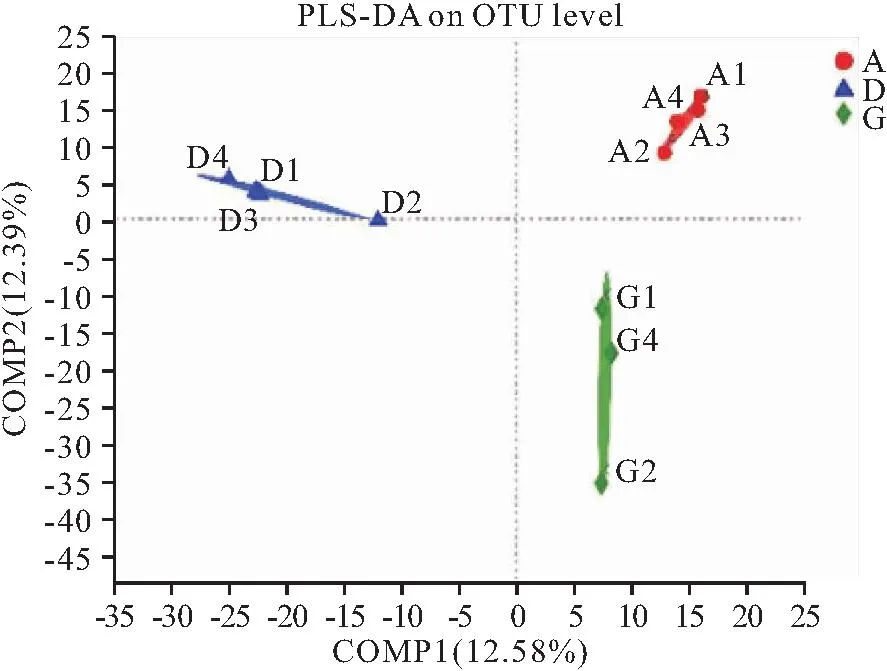
图5 PLS-DA图Fig.5 PLS-DA
为了进一步探究三组之间的主要差异物种,采用Kruskal-Wallis秩和检验进行组间差异检验,发现D组在组间拥有较多的显著差异物种。在门水平上,unclassified_k_norank_d_Bacteria在组间差异显著(图6a)。在属水平上(丰度前15的差异物种),γ-变形菌科(Gammaproteobacteria)、军团菌科(Legionellaceae)、假单胞菌属(Pseudomonas)、侠义梭菌属(Clostridiumsensustricto)、水小杆菌属(Undibacterium)、Hypnocyclicus、井杆菌属(Phreatobacter)、脱氯菌属(Dechloromonas)、光合红螺菌科(Rhodospirillaceae)、Solitalea、沉积菌科(Sedimentibacter)、脱硫肠状菌属(Desulfohalotomaculum)、少盐芽孢杆菌属(Paucisalibacillus)等在组间存显著差异(图6b)。
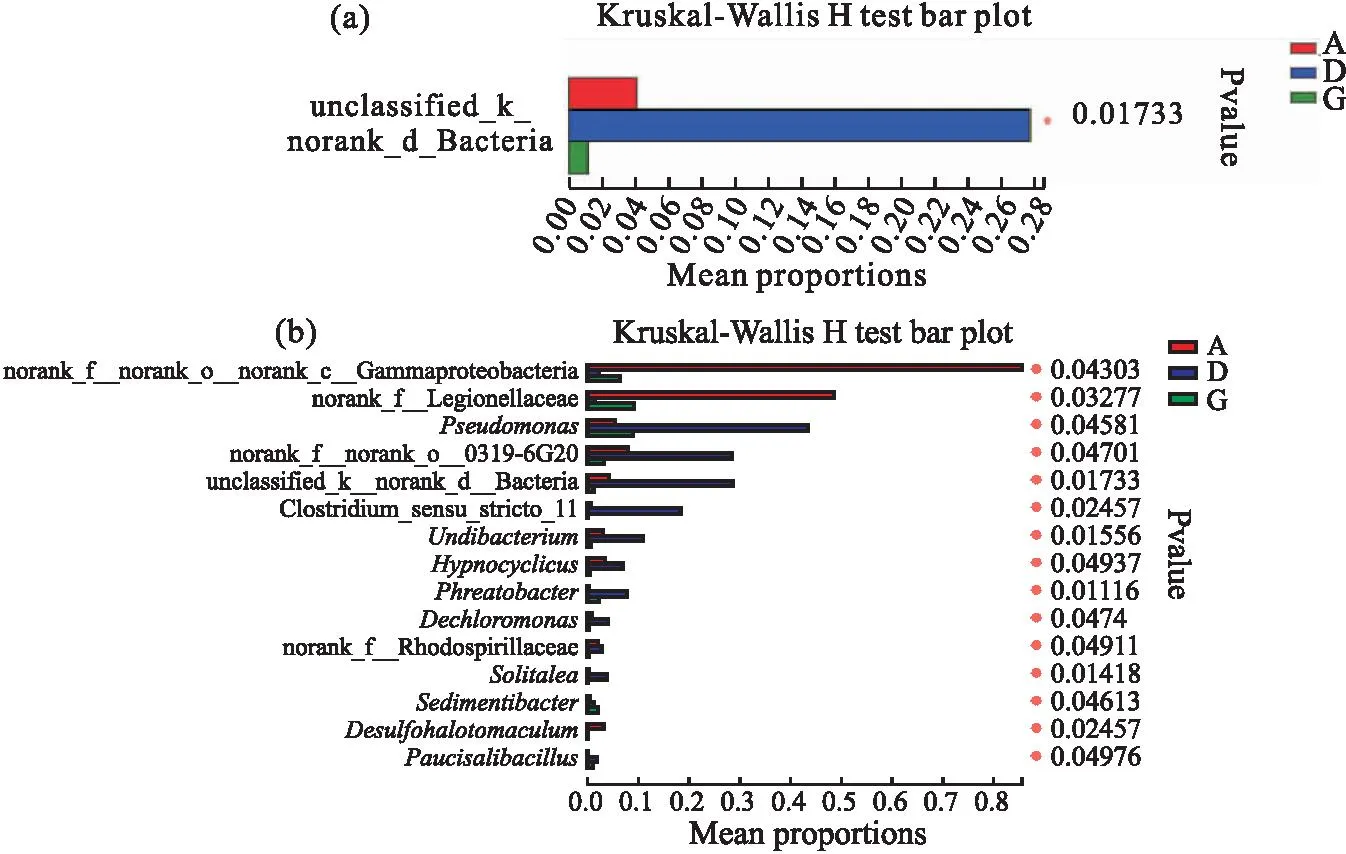
图6 三组肠道菌群差异分析Fig.6 Differential analysis of intestinal flora in three groups of samples(a)门水平,(b)属水平。图中*表示P<0.05
使用LEFSe来识别在各组之间具有显著作用的物种,寻找生物标记物,LDA得分阈值为2分。LEFSe多级物种差异判别分析(图7)显示,D组以假单胞菌科(Pseudomonadaceae,LDA得分=3.34,P=0.046)、草酸杆菌科(Oxalobacteraceae,LDA得分=2.85,P=0.028)为差异代谢物种,A组以γ-变形菌目(Gammaproteobacteria,LDA得分=3.63,P=0.043)、γ-变形菌科( Gammaproteobacteria,LDA得分=3.60,P=0.043)、 奈瑟菌科(Neisseriaceae,LDA得分=2.35,P=0.014)为差异优势物种,G组以沉积菌科(Sedimentibacteraceae,LDA得分=2.32,P=0.040)为差异代谢物种。

图7 LEFSe多级物种差异判别分析Fig.7 LEFSe multilevel species difference discriminant analysis(a)分支图,(b)得分图(LDA>2)
2.3.4 饲料VA水平黄鳝肠道生物群落功能预测
使用PICRUSt2对三组肠道微生物群落的潜在功能进行预测,采用Welch’st-test检验对各组间肠道菌群KEGG通路(level2)进行丰度组成差异分析(图8a),发现D组与碳水化合物代谢、内分泌系统和其他氨基酸的代谢相关功能基因显著性高于A组,其余两组组间无显著性差异。进一步在KEGG通路(level3)上分析,发现所有样品共有405个KEGG通路,对丰度前50的进行差异分析,发现D组与糖酵解/糖异生(ko00010,Glycolysis / Gluconeogenesis)代谢相关功能基因显著高于A组(图8b);A与甘氨酸、丝氨酸和苏氨酸代谢(ko00260,甘氨酸、丝氨酸和苏氨酸代谢)相关功能基因显著高于G组(图8c);D和G组无显著性差异。

图8 各组KEGG通路差异分析Fig.8 Analysis of KEGG pathway difference among groups(a)A、D组KEGG通路(level2)差异分析;(b)A、D组KEGG通路(level3)丰度前50差异分析;(c)A、G组KEGG通路(level3)丰度前50差异分析
3 讨论
3.1 饲料VA水平对黄鳝生长性能的影响
VA具有维持动物正常生长发育、调节免疫力等多种生理功能[14],可不同程度促进养殖鱼类的生长[15-18]。在本实验中,B~D组(VA水平3 620~4 730 IU/kg)显著提高了黄鳝特定生长率和增重率。本实验以特定生长率为评价指标,采用折线模型分析,得出黄鳝[(7.32±0.02)g]适宜需求量为3 849.96 IU/kg。研究表明,饲料中VA缺乏或者过量时养殖动物会表现相应的VA缺乏症和毒害表现,如死亡率增加等[5,19,20]。在本实验中,低水平VA(3 201 IU/kg)时未见黄鳝明显VA缺乏症,可能是本实验饲料原料的VA在一定程度上被黄鳝利用,设置的最低VA水平未达到黄鳝缺乏VA水平。有研究表明,南美白对虾(Penaeusvannamei)[21]、幼鲍(Haliotisdiscushannai)[22]缺乏VA时生长明显下降,但对其死亡率无显著影响。在本实验的高水平VA(16 890 IU/kg)中,黄鳝的生长减缓,但未明显见其它高VA时的毒害表现,这可能与VA的添加水平、黄鳝的短期饲养及发育阶段等有关[20,23]。HILTON[24]研究发现虹鳟(Salmogairdneri)VA水平在904 000 IU/kg时,虹鳟死亡率仅1%;当饵料VA添加水平高达8 104 000 IU/kg时,死亡率14.5%。由此推测当黄鳝饲料VA水平处于更高水平时方可见显著的毒害表现。关于饲料中更低和更高水平的VA是否会对黄鳝生长产生显著的负面影响尚有待进一步的研究。
3.2 饲料VA水平对黄鳝前肠结构的影响
肠道是动物体消化吸收营养成分的主要场所,其结构及黏膜的生长对动物体吸收营养物质有很大的影响[25]。小肠绒毛是决定消化吸收的重要结构基础,常用来评价肠道形态[26],动物体对营养物质的吸收率与小肠绒毛高度、肠吸收面积呈正相关关系[27]。研究表明饲料中适量增加VA可增加鸭肠道的绒毛长度[28],可显著增加断奶仔猪小肠绒毛宽度和绒毛高度[29],提高生产性能。但是过高浓度的VA对动物体会产生负面影响,梁达智[30]发现过量的VA会降低珍珠龙胆石斑鱼幼鱼的绒毛高度和肌层厚度,导致生长性能下降。在本实验中随着饲料VA水平的提高,黄鳝肠道绒毛高度、肠壁厚度、微绒毛高度以及粘液细胞数量先升高后下降,可见饲料适宜VA水平(3 620 ~4 730 IU/kg)可通过改善肠道结构促进肠道对营养物质的吸收和消化,从而促进生长;但高水平VA(16 890 IU/kg)不利于肠道结构的发育,降低了黄鳝的生长性能。
3.3 饲料VA水平对黄鳝肠道菌群影响
肠道菌群组成对宿主健康、新陈代谢、营养物质消化吸收和免疫等有重要影响[31]。在淡水养殖鱼类肠道中,变形菌门、厚壁菌门和拟杆菌门较为常见[32]。王颖[33]在分析黄鳝肠道菌群时发现变形菌门、厚壁菌门、梭杆菌门和拟杆菌门为黄鳝核心菌门。与此结果类似,在本实验中黄鳝优势菌门为变形菌门、厚壁菌门、拟杆菌门。Alpha多样性分析可以反映样本群落的丰富度和多样性。Chao1和ACE指数越大则物种丰富度越高;Shannon指数越大,Simpson指数越小则物种多样性越高。本实验中,摄食不同VA水平饲料的黄鳝肠道微生物Alpha多样性先增加后减少,Sobs指数、Chao1指数、ACE指数、Shannon指数均在D组(4 730 IU/kg )最高,D组物种多样性和丰富度最高。进一步分析发现,D组饲料VA水平下差异代谢物种为草酸杆菌科、假单胞菌属,G组(16 890 IU/kg)差异代谢物种为沉积菌科。研究表明,铁元素在微生物新陈代谢过程中非常重要[34],假单胞菌Bfr蛋白可能是一种重要的储铁蛋白[35],促进细菌生长。沉积菌属可代谢氨基酸形成乙酸和丁酸[36],乙酸、丁酸等短链脂肪酸有抑菌的作用。
从饲料不同VA水平对黄鳝肠道物种组成的结果分析可知,饲料VA水平对菌群组成有较大的影响,添加适量水平VA(4 730 IU/kg)可改善黄鳝肠道菌群结构,过量添加(16 890 IU/kg)则增加了潜在致病菌的丰度。本实验中,一定程度上提高VA水平,提高了厚壁菌门、放线菌门、根瘤菌、罗姆布茨菌等菌群丰度。研究表明肠道厚壁菌门可促进脂肪酸、碳水化合物的代谢[37];罗姆布茨菌则可利用不同种类简单碳水化合物合成氨基酸和维生素[38];放线菌门可产生多种活性天然产物(淀粉酶、脂肪酶和蛋白酶等水解酶[39];根瘤菌可能和寡营养生境中氮的分解和矿化有关,促进氮源利用[40]。胡重华等[13]前期研究发现饲料适宜VA水平对黄鳝组织蛋白酶和脂肪酶活性有显著影响,所以适宜的VA水平可能是通过提高益生菌的益生作用,如产生酶类或者提高对营养物质的消化吸收来促进机体生长。本实验也发现一定程度提高VA水平后降低了变形菌门、邻单胞菌属等菌群丰度,而在添加高水平VA后增加了疣微菌门、衣原体属等菌群丰度。研究表明,变形菌门丰度过高可能导致机体更易患病,其丰度增加可作为疾病的潜在诊断标准[41];邻单胞菌属中多为条件致病菌,其中类志贺邻单胞菌对大布氏鲟有较强的致病性可导致其患病死亡[42];衣原体则可造成幼体和稚扇贝生长缓慢[43]。可见适量的VA水平可通过菌群的益生作用提高消化酶或者增强脂肪酸和碳水化合物代谢,促进机体对营养物质的吸收来提高自身的生长性能,并在减小黄鳝生长过程中患病风险方面有重要的意义。
3.4 饲料VA水平黄鳝肠道生物群落功能预测分析
鱼类利用碳水化合物的能力较差,曾被称为天生的糖尿病患者[44];糖酵解/糖异生是碳水化合物代谢的主要途径之一,而大部分鱼类因未及时有效地将碳水化合物转化为肝糖原、肌糖原和脂肪进而导致出现持续高血糖[45]。对KEGG功能分析发现,D组的碳水化合物代谢、内分泌系统、糖酵解/糖异生相关代谢基因丰度显著高于A组,A、G组无显著性差异。可见,适宜饲料VA水平可促进碳水化合物代谢,有利于黄鳝对碳水化合物的吸收利用。G组甘氨酸、丝氨酸和苏氨酸代谢相关代谢基因丰度显著低于A组。从营养平衡角度,饲料中VA水平为 4 730 IU/kg有利于促进黄鳝碳水化合物代谢,从而减少其对氮源的需求。
4 结论
饲料中适宜VA水平可改善黄鳝肠道结构,增加肠道菌群丰富度和多样性,提高碳水化合物代谢相关基因丰度,提高黄鳝生长性能。以特定生长率为评价指标,采用折线模型得出体质量(7.32±0.02)g黄鳝VA适宜需求量为3 849.96 IU/kg;综合考虑黄鳝生长性能和肠道健康,本实验饲料中适宜VA水平为3 620 ~4 730 IU/kg。

