恩诺沙星及其代谢物环丙沙星在牛蛙体内的残留消除规律研究
董 军,张思雨,房 迪,苏泽辉,舒 锐,雷小婷,胡 鲲
(1.水产科学国家级实验教学示范中心(上海海洋大学),上海 201306;2.国家水生动物病原库(上海海洋大学),上海 201306;3.农业部淡水水产种质资源重点实验室(上海海洋大学),上海 201306;4.广东省星蛙农业科技有限公司,广东肇庆 526000)
恩诺沙星是一种具广谱性的喹诺酮类药物,因其具有强效抗菌性,在水产养殖中被广泛使用[1]。恩诺沙星在生物体内的主要代谢产物为环丙沙星,《食品安全国家标准食品中兽药最大残留限量 》(GB31650—2019)将水产动物中恩诺沙星(含环丙沙星)的总残留限量定为100 μg/kg[2]。针对鱼类和甲壳类水产生物中恩诺沙星的药代动力学研究已经有较多成果,如斑节对虾(Penaeusmonodon)[3]、俄罗斯鲟(Acipensergueldenstaedti)[4]、石斑鱼(Epinephelusspp)[5]、斑点叉尾(Ietaluruspunetaus)[6]等。
牛蛙(Lithobatescatesbeiana)作为两栖动物,原产于北美洲地区,由古巴引入中国[7]。近年来牛蛙养殖产量不断增大,由2020年、2021年和2022年中国渔业统计年鉴数据可知[8-10],2018-2021年间蛙类养殖产量增幅为41.54%,而在追求高密度、高产量、高生长速度的养殖过程中,常出现恩诺沙星滥用现象,通过中国质量新闻网检索发现,2021-2022年两年检出牛蛙产品中恩诺沙星超标1 184例。足以说明近年来恩诺沙星在牛蛙养殖过程中的使用存在较大问题,但是至今为止,不曾有相关研究为牛蛙养殖过程合理使用恩诺沙星提供技术支持和科学指导。因此,本研究旨在探明恩诺沙星在牛蛙体内药代动力学原理与生物转化规律,并结合恩诺沙星药效学规律推测其最大残留限量,为其休药期的制定和安全合理用药提供科学依据。
1 材料与方法
1.1 实验试剂
恩诺沙星粉(水产用)规格为10%,购于南华千牧有限公司(兽药GMP验收通过企业);恩诺沙星标准品Enrofloxacin和环丙沙星标准品Ciprofloxacin(纯度≥99.0%),购于北京meilunbio公司;色谱纯乙腈、甲醇、异丙醇均购于上海合勒化学科技有限公司,正己烷、三乙胺均购于天津市大茂化学试剂厂;2 mol/L、0.5 mol/L磷酸标准溶液购于平根科技检测技术服务中心;肝素钠为上海源叶生物科技有限公司产品。
1.2 实验仪器
液相色谱仪(Agilent 1100,美国);超声波清洗机(D-78224 Singen/Htw,德国);水浴氮吹仪(ST-48,上海户析实业有限公司);电子分析天平(上海光正医疗器械有限公司);高速冷冻离心机(TG16 YQ-087,上海卢湘仪离心机仪器有限公司);旋涡混合器(XW-80A,上海驰唐电子有限公司);一次性无菌1 mL注射器(江苏治宇医疗器材有限公司);一次性油系滤器(BS-QT-013,北京兰杰柯科技有限公司);0.22 μm微孔滤膜(上海吉至生化科技有限公司)。
1.3 实验设计
实验用牛蛙购自四川内江市某养殖场,蛙体质量(100±20)g。直径100 cm、高70 cm的养殖缸,水深4 cm,水温控制在25 ℃左右,准备100只牛蛙,暂养7 d,分为给药组和空白对照组两组,给药组将10%恩诺沙星粉(水产用)用水混成匀浆,以20 mg/kg bw恩诺沙星浓度药悬液从口灌入牛蛙体内。所有实验严格遵守上海市有关动物工作管理法规,并符合上海海洋大学实验动物伦理委员会的审核标准。
1.4 实验方法
1.4.1 取样
空白组随机取7只牛蛙作为空白对照,确定其体内无恩诺沙星和环丙沙星残留后,对各牛蛙进行口灌给药,分别于0.5、1、2、4、8、12、24、48、96、192、336、480 h对各组取样,每次每组随机取7只牛蛙分别进行采样测定,用1 mL注射器用肝素钠抗凝剂润湿后,从腹壁静脉抽取1 mL左右血液,注入用肝素钠抗凝剂润湿的2 mL离心管,上下混匀后于8 000 r/min离心5 min,取上层血浆置于-20 ℃保存;同时采集肝脏、肌肉、脑和肾脏等组织,装入5 mL离心管,置于-20 ℃保存。
1.4.2 样品前处理
冷冻保存的样品在室温下自然解冻。解冻的血浆摇匀,取500 μL上清液置于2 mL离心管中,加入500 μL的甲醇,用漩涡混合仪震荡混合2 min后,用高速冷冻离心机以13 000 r/min转速离心6 min,用1 mL注射器吸取上清液,经0.22 μm微孔滤膜过滤,用于HPLC分析。肌肉、肝脏、肾脏和脑样品室温解冻后,称取0.2 g样品置于5 mL离心管中,匀浆后加入3 mL酸化乙腈(1 mol/L盐酸 ∶乙腈=4∶500,V/V),涡旋混匀后超声10 min,9 000 r/min转速离心5 min,重复提取两次移入15 mL离心管中,于氮吹仪上40 ℃氮吹至干,用1 mL甲醇溶液溶解,超声2 min后转入2 mL离心管,10 000 r/min转速离心5 min,用1 mL注射器吸取上清液,经0.22 μm微孔滤膜过滤,用于HPLC分析。
1.4.3 色谱条件
色谱柱为Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm);流动相为乙腈∶0.05 mol/L磷酸(用三乙胺调pH至2.5)=19∶81(体积比),使用前进行抽滤、超声脱气;流速1.0 mL/min;荧光检测器检测波长:激发波长Ex=280 nm,发射波长Em=450 nm;柱温35 ℃;进样量:10 μL。
1.4.4 标准曲线
10 mg恩诺沙星标准品和10 mg环丙沙星标准品分别用流动相0.05 mol/L磷酸溶液配置成100 μg/mL的标准工作液,放于4 ℃备用,然后依次稀释为0.01、0.05、0.1、0.5、1、5、10、20 μg/mL标准稀释液,均取10 μL进样检测。标准曲线以药物的峰面积作为纵坐标(Y),标准质量浓度C(μg/mL)作为横坐标,计算回归方程及相关系数。
1.4.5 回收率和精密度
取空白血液、肌肉、肾脏、脑和肝脏,添加标准稀释液,使得各组织恩诺沙星和环丙沙星药物浓度为0.05、0.5、5 mg/kg,每个质量浓度重复测定3次,计算回收率和相对标准偏差RSD。
1.5 数据处理
采用Microsoft Excel 2016进行处理取得药物标准曲线和药时曲线图,采用DAS 3.0.5软件分析取得药动学参数,采用WT 1.4软件进行分析计算休药期。
2 结果
2.1 色谱行为
恩诺沙星和环丙沙星的出峰时间分别为6.053、4.851 min,目标药物峰出峰明显且尖锐,基线平稳(图1)。本方法可以有效地分离恩诺沙星和环丙沙星,并且与实验样品中的其他色谱峰明显分离,无干扰峰(图2)
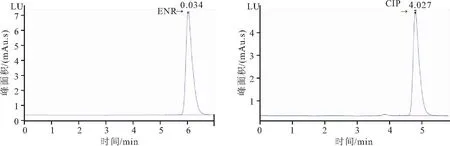
图1 恩诺沙星(ENR)和环丙沙星(CIP)标准溶液色谱图(0.5μg/mL)Fig.1 Chromatograms of enrofloxacin (ENR)and ciprofloxacin (CIP)standard solutions(0.5 μg/mL)
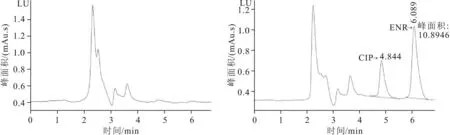
图2 空白色谱图和加标色谱图(0.05 μg/mL)Fig.2 Blank chromatogram and spiked chromatogram (0.05 μg/mL)左为空白图,右为加标图
2.2 分析方法验证
本实验方法条件下,在0.01~20 μg/mL的浓度范围内具有良好的线性关系,恩诺沙星和环丙沙星的标准曲线方程分别为Y=229.99X-0.493 7,Y=127.27X-2.018 8,相关系数R2均大于0.99,如图3所示。如表1所示,各组织中恩诺沙星和环丙沙星的平均回收率均在77.89%~124.05%,RSD<10%,且该方法检出限为0.01 μg/mL,定量限为0.05 μg/mL,均低于欧盟(0.1 μg/mL)规定的最高残留限量,说明本方法具有较高的精密度,适用于测定牛蛙体内恩诺沙星和环丙沙星的浓度。
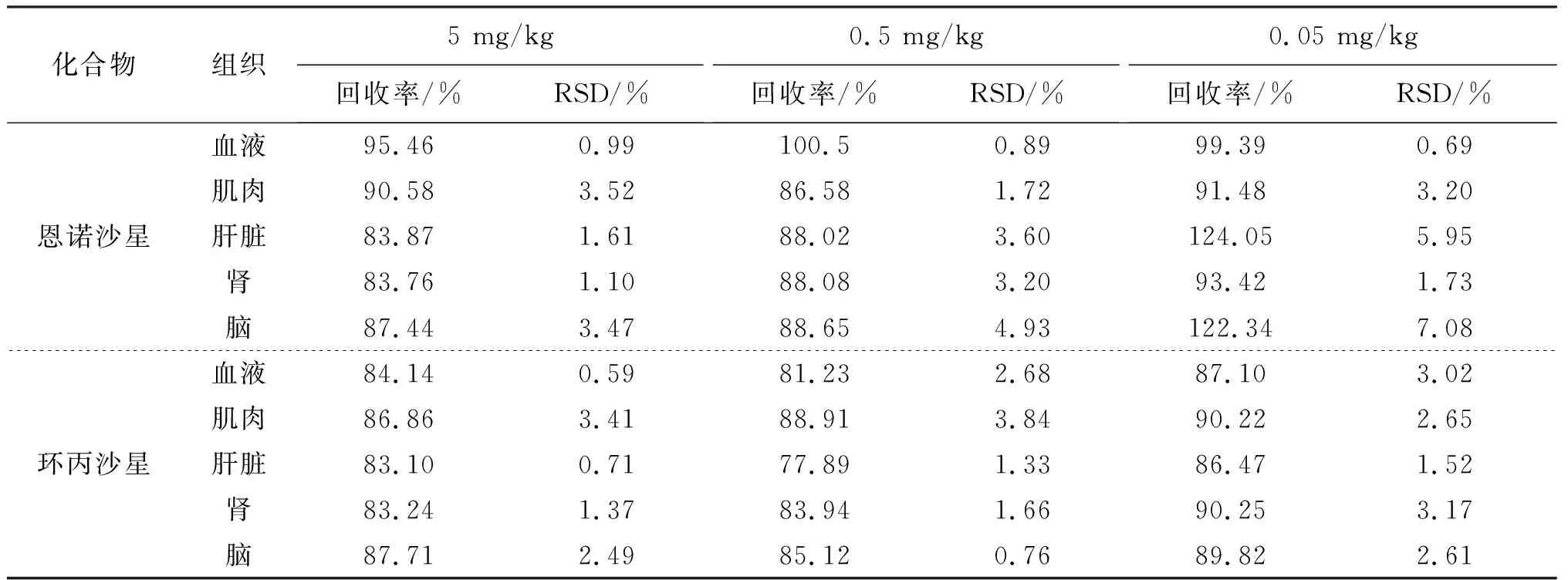
表1 恩诺沙星和环丙沙星在各组织中回收率和精密度实验结果Tab.1 Recovery and precision test results of Enrofloxacin and Ciprofloxacin in various tissues

图3 恩诺沙星和环丙沙星的标准曲线Fig.3 Standard curves of Enrofloxacin and Ciprofloxacin
2.3 恩诺沙星及其代谢产物环丙沙星在牛蛙体内的药-时变化规律
口灌给药后,恩诺沙星和环丙沙星在牛蛙各组织的药-时曲线见图4。由图 4-①所示,血液中恩诺沙星和环丙沙星浓度在给药后1 h同时达到峰值,分别26.592 μg/mL和2.256 μg/mL,血液中恩诺沙星随后快速下降,给药2 h后呈现缓慢下降趋势,在480 h达到最低浓度0.044 μg/mL;血液中的环丙沙星浓度在给药1~2 h快速降低后,在2~12 h再次回升达到第二个峰值1.688 μg/mL,随后呈缓慢降低趋势,在给药480 h后未检测出环丙沙星,数据统计分析发现血液中环丙沙星占恩诺沙星的百分比为14.42%。由图4-②所示,在给药后,肌肉中的恩诺沙星浓度呈快速上升趋势,在给药8 h达到峰值10.21 mg/kg,在8~48 h呈快速降低趋势,48 h后恩诺沙星浓度缓慢降低,在480 h达到最低值0.037 5 mg/kg;在给药4 h后肌肉中检测出环丙沙星,随后快速上升,在12 h达到峰值1.362 mg/kg,随后呈快速降低趋势,在给药480 h未检测出环丙沙星,数据统计分析发现肌肉中环丙沙星占恩诺沙星的百分比为10.89%。由图4-③所示,肝脏中的恩诺沙星和环丙沙星浓度0~2 h快速上升,在2 h分别达到13.63 mg/kg和8.54 mg/kg,2~4 h略有降低,在8 h达到峰值,分别为13.84 mg/kg和20.46 mg/kg,在8~48 h恩诺沙星浓度呈快速降低趋势,48 h后呈缓慢降低趋势,在480 h达到最低值,分别为0.81 mg/kg和0.16 mg/kg,数据统计分析发现肝脏中环丙沙星占恩诺沙星的百分比为82.14%。由图4-④所示,肾脏中的恩诺沙星浓度在0~2 h呈快速上升趋势,在2 h达到16.69 mg/kg,在2~4 h略有降低后升高,在8 h达到峰值17.52 mg/kg,在8~48 h呈快速降低趋势,48 h呈缓慢降低趋势,在480 h达到最低值0.29 mg/kg;肾脏在给药0.5 h检测出环丙沙星,环丙沙星浓度在0.5~4 h缓慢上升,4~12 h快速上升,在12 h达到峰值4.07 mg/kg,在12~96 h呈快速降低趋势,96 h后呈缓慢降低趋势,在480 h达到最低值0.14 mg/kg,数据统计分析发现肾脏中环丙沙星占恩诺沙星的百分比为14.02%。由图4-⑤所示,脑中未检测出环丙沙星,恩诺沙星在0.5~2 h呈缓慢上升趋势,在2~8 h呈快速上升趋势,在8 h达到峰值3.95 mg/kg,在8~48 h呈快速降低趋势,48 h后呈现缓慢降低趋势,在480 h达到最低值0.38 mg/kg。
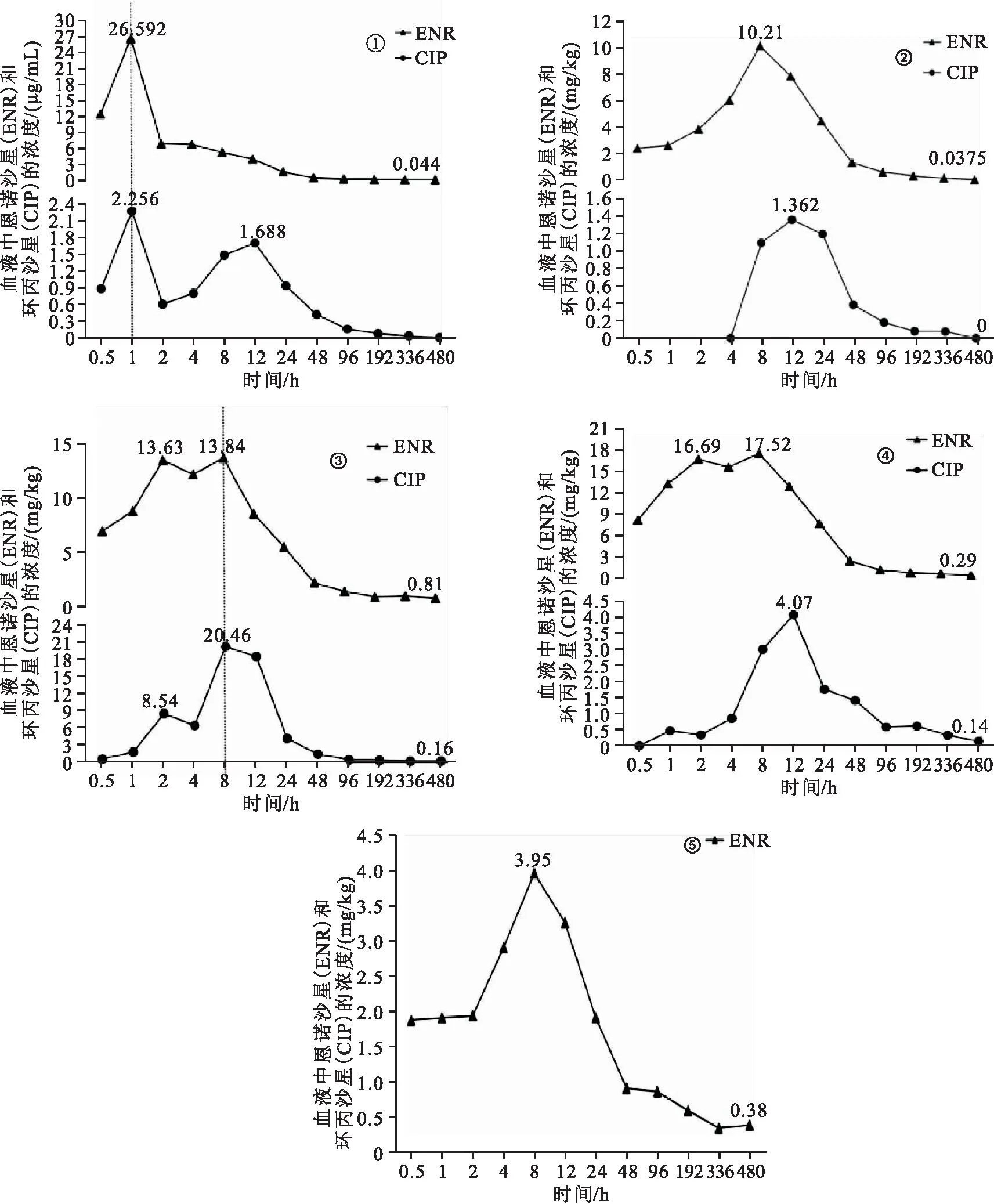
图4 牛蛙口灌给药下血液、肌肉、肝脏、肾脏和脑的药-时曲线Fig.4 Drug time curves of blood,muscles,liver,kidneys and brain in L.catesbeiana administered orally
如图5所示,牛蛙血液中恩诺沙星(含环丙沙星)浓度在给药1 h达到峰值28.85 μg/mL,1~48 h呈快速降低趋势,48 h后呈缓慢降低趋势,在480 h达到最低值0.044 μg/mL;而牛蛙的肌肉、肝脏、肾和脑均在给药8 h达到峰值,分别为11.30、34.30、20.51、3.945 mg/kg,均在8~48 h呈快速降低趋势,在48 h呈缓慢降低趋势,均在480 h达到最低值,分别为0.037 5、0.975、0.430、0.378 mg/kg。
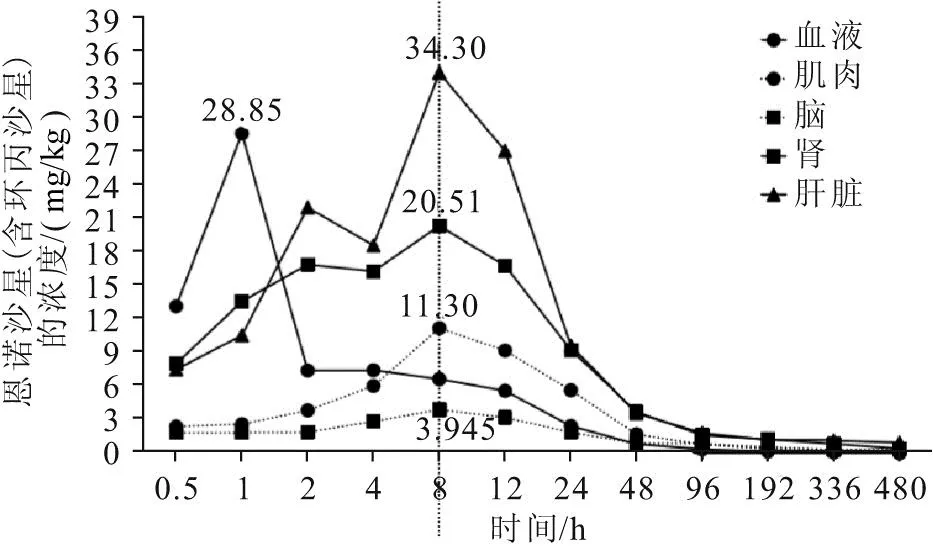
图5 牛蛙口灌给药后的恩诺沙星(含环丙沙星)的药-时曲线Fig.5 Drug time curve of Enrofloxacin(including Ciprofloxacin) administered orally to L.catesbeiana
2.4 药代动力学特征
采用DAS 3.0.5房室模型的统计矩原理推算出恩诺沙星和环丙沙星在牛蛙体内的药代动力学参数,分析其药物动力学特征,如表2和3所示。
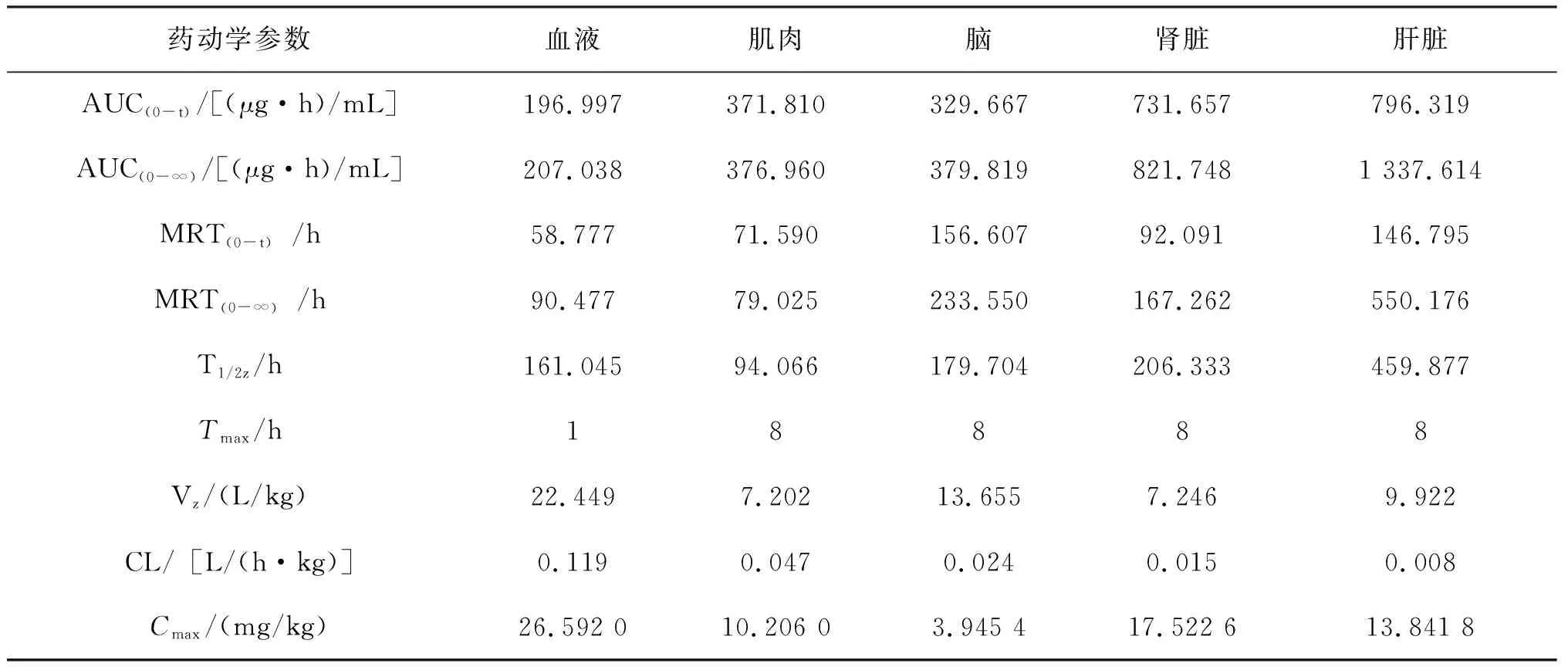
表2 恩诺沙星在牛蛙体内的药代动力学参数Tab.2 Pharmacokinetic parameters of enrofloxacin in L.catesbeiana
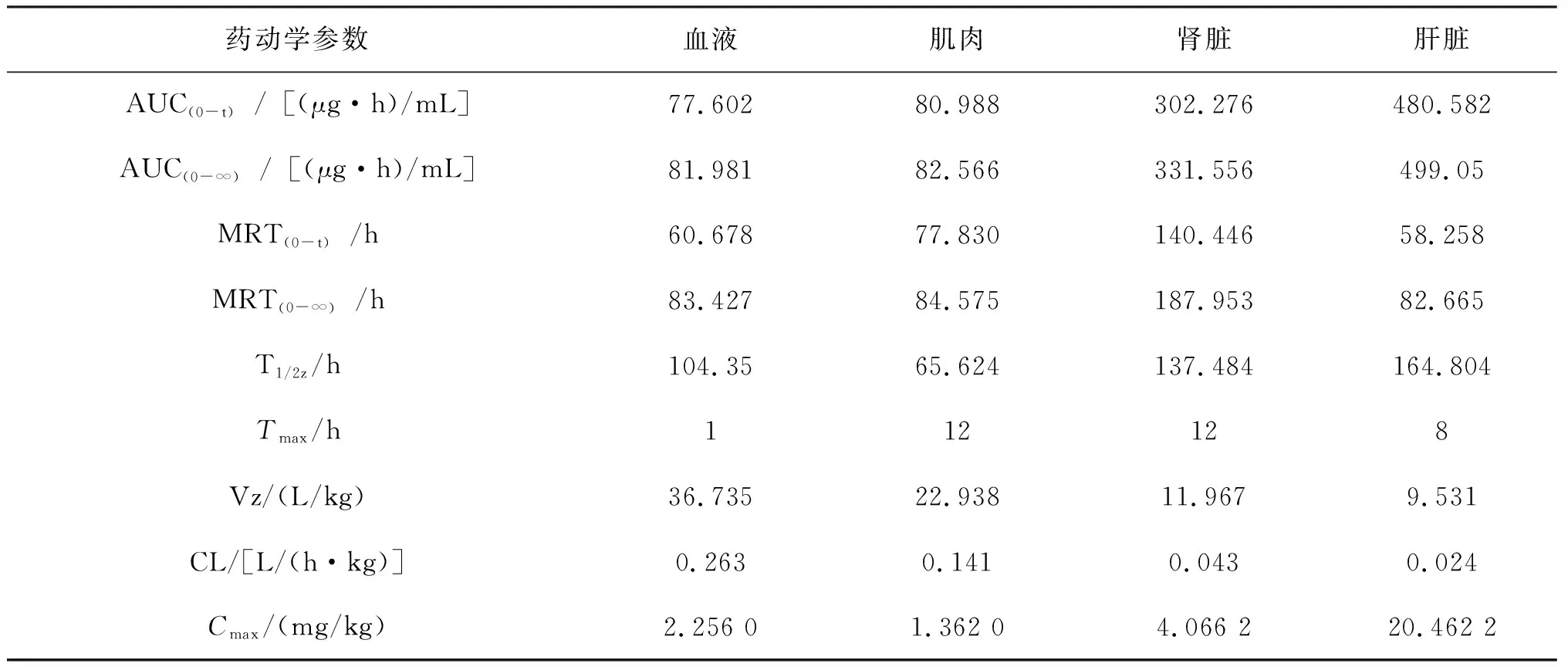
表3 环丙沙星在牛蛙体内的药代动力学参数Tab.3 Pharmacokinetic parameters of ciprofloxacin in L.catesbeiana
恩诺沙星在牛蛙血液中的Tmax为1 h,在肌肉、脑、肾脏和肝脏中最大达峰时间均为8 h;药物最大达峰浓度Cmax:血液>肾脏>肝脏>肌肉>脑;消除半衰期T1/2z:肝脏>肾脏>脑>血液>肌肉;总体清除率CL:血液>肌肉>脑>肾脏>肝脏;药时曲线下面积AUC:肝脏>肾脏>肌肉>脑>血液;药物平均保留时间MRT:肝脏>脑>肾脏>肌肉>血液。
环丙沙星最大达峰时间Tmax分别为血液1 h、肝脏为8 h、肌肉和肾脏均为12 h;药物最大达峰浓度Cmax:肝脏>肾脏>血液>肌肉;消除半衰期T1/2z:肝脏>肾脏>血液>肌肉;总体清除率CL:血液>肌肉>肾脏>肝脏;药时曲线下面积AUC:肝脏>肾脏>肌肉>血液;药物平均保留时间MRT:肾脏>肌肉>血液>肝脏。
2.5 肌肉组织最大残留限量和休药期
由于牛蛙的肌肉是主要的可食用部位,因此把肌肉作为药物残留的靶组织,对肌肉组织的恩诺沙星和其代谢物环丙沙星的药-时数据进行整合,以100 μg/kg为残留标准,通过WT1.4软件进行处理分析,结果如图6所示,恩诺沙星(含环丙沙星)在肌肉中的残留浓度在514.24 h达到残留标准100 μg/kg。
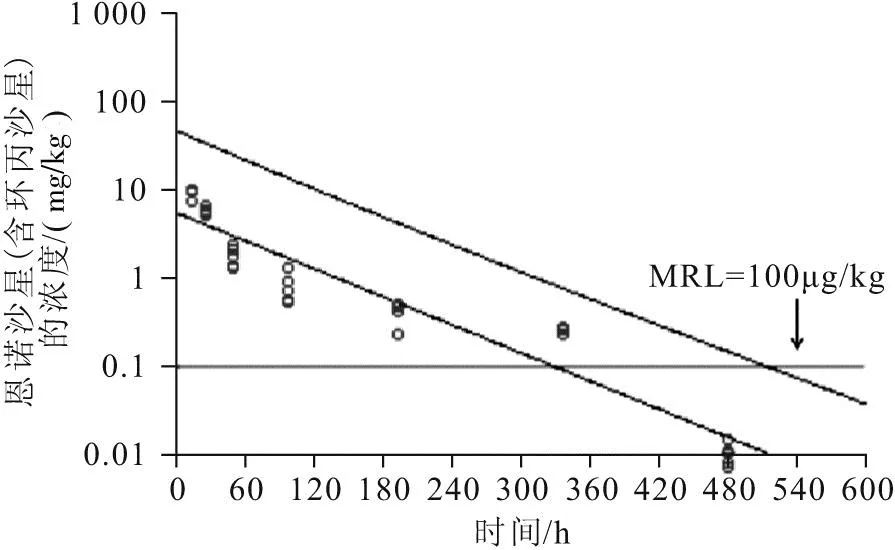
图6 肌肉中恩诺沙星(含环丙沙星)浓度—时间关系曲线Fig.6 Concentration time relationship curve of enrofloxacin(including ciprofloxacin)in muscle
3 讨论
3.1 恩诺沙星在牛蛙体内的代谢规律
Tmax是评价药物在生物体内吸收速率的重要参数。恩诺沙星在牛蛙血液Tmax为1 h,肌肉、肝脏、肾脏和脑Tmax均为8 h,说明与其他组织相比,牛蛙血液对恩诺沙星吸收速率最快,最早达到峰值,这一结果与鲫鱼(Carassiusauratus)[11]、罗非鱼(Oreochromismossambicus)[12]、大黄鱼(Larimichthyscrocea)[13]体内恩诺沙星在血液中吸收速率较其他组织快的结论一致,即恩诺沙星最先进入牛蛙血液,通过血液运输至各个组织。其中,恩诺沙星在牛蛙的肝脏、肾脏均在2 h、8 h出现两次浓度高峰,即双峰现象,与异育银鲫(C.gibel)[14]、虹鳟(Oncorhynchusmykiss)[15]变化规律相似,推测牛蛙体内存在相同的肝肠循环现象。
AUC(0-∞)是表示生物体各组织对药物吸收和药物分布量大小,决定生物利用度的参数[16]。牛蛙各组织的恩诺沙星AUC(0-∞):肝脏>肾脏>肌肉>脑>血液,其中肝脏、肾脏的AUC(0-∞)分别为:1 337.61、821.75(μg·h)/mL,肝脏对恩诺沙星的吸收量是血液吸收量的6.46倍,肾脏对恩诺沙星的吸收量是血液吸收量的3.97倍,说明牛蛙各组织对恩诺沙星的利用能力有较大差别,其中肝脏、肾脏对恩诺沙星的利用率较高,恩诺沙星在肝脏和肾脏中分布广,与杂交鲟(施氏鲟Acipenserschrenckii♂×达氏鳇Husodauricus♀)[17]、红笛鲷(Lutjanuserythropterus)[18]体内恩诺沙星的分布结论相似,且符合药物经由肝脏代谢、通过肾脏排泄的理论[19]。
消除半衰期T1/2z是表现药物在生物体内消除快慢的主要参数。恩诺沙星在牛蛙各组织中的消除半衰期T1/2z:肝脏(459.88 h)>肾脏(206.33 h)>脑(179.70 h)>血液(161.05 h)>肌肉(94.07 h),说明恩诺沙星在牛蛙肌肉中的消除速率最快,与牙鲆(Paralichthyslethostigma)(67.76 h)[20]、杂交鲟(114.90 h)[17]消除速率最快的结论一致。
3.2 环丙沙星在牛蛙体内的代谢规律
实验中使用的10%恩诺沙星粉剂(水产用)在前期测定并未检测出环丙沙星,而在0.5 h时,在血液和肝脏中检测出环丙沙星含量分别为0.872、0.516 mg/kg,由于血液主要起到循环转运的作用,而肾脏、肌肉和脑在0.5 h并未检出环丙沙星,因此说明血液中的环丙沙星为肝脏代谢恩诺沙星的产物[21]。而肾脏和肌肉分别在1、8 h检测出环丙沙星,推测检测出的环丙沙星主要为肝脏代谢经由血液转运蓄积在肾和肌肉中,其中肾脏作为牛蛙主要的恩诺沙星排泄器官[22],并不直接参与恩诺沙星代谢为环丙沙星的过程,由于环丙沙星具有较强的亲脂性,因而磷脂含量高的肾脏较脂质少的肌肉,对环丙沙星的蓄积能力更强,更早检测出环丙沙星[23]。
环丙沙星在牛蛙血液、肌肉、肾脏和肝脏中的Cmax分别为2.26、1.36、4.07和20.46 mg/kg,其中肝脏的环丙沙星含量最高,说明牛蛙肝脏具有较丰富的代谢酶,具有较强的去乙基代谢能力,是牛蛙主要的恩诺沙星代谢场所[21]。恩诺沙星进入水生动物体内,主要以原药形式存在[22、26],环丙沙星与恩诺沙星AUC(0-∞)比值如罗非鱼(肝:5.98%)[12]、中华草龟(Chinemysreevesiis)(血液:6.1%)[27]、鳗鲡(Anguillajaponica)(血液:9.9%、肌肉:5.54%、肝脏:40.3%)[28]等,但由于水生动物种群差异性和养殖环境不同,恩诺沙星代谢水平不同,如俄罗斯鲟(血浆:51.6%、肝脏22.6%、肾脏27.4%、肌肉16.7%)[4],而本实验中牛蛙血液、肌肉、肾脏和肝脏的环丙沙星与恩诺沙星AUC(0-∞)比值分别为:39.60%、21.90%、40.35%和37.31%,推测牛蛙作为两栖动物,且其养殖环境为水陆并存,导致其恩诺沙星代谢能力比水生动物强,与陆生动物相似[29、30]。环丙沙星在血液、肌肉和肾脏中的平均保留时间MRT(0-∞):83.43、84.58、187.95 h,和恩诺沙星在血液、肌肉和肾脏中的平均保留时间MRT(0-∞):90.48、79.03、167.26 h相近,但是牛蛙肝脏中恩诺沙星平均保留时间MRT(0-∞):550.18 h是环丙沙星平均保留时间MRT(0-∞):82.67 h的6.65倍,恩诺沙星在牛蛙肝脏中保留时间最长,并且肝脏中环丙沙星含量也最高但保留时间短,进一步说明牛蛙主要利用肝脏将恩诺沙星转化为环丙沙星排出体外,与虹鳟类似[15]。
牛蛙的脑中可检测出低浓度的恩诺沙星(Cmax:3.95 mg/kg),血液中恩诺沙星(Cmax:26.59 mg/kg)为其6.73倍,说明恩诺沙星可突破牛蛙的血脑屏障,但是透过性较差,与鱼类不同[12],而牛蛙脑中未检测出环丙沙星,推测牛蛙脑部不含恩诺沙星转为环丙沙星的酶,且环丙沙星不易透过牛蛙的血脑屏障。环丙沙星的消除半衰期T1/2z:肝脏(164.80 h)>肾脏(137.48 h)>血液(104.35 h)>肌肉(65.62 h),牛蛙肌肉中的环丙沙星消除速率最快,与其恩诺沙星消除规律一致,且与25 ℃温度下的克氏原螯虾具有相同的消除规律[31],并且与恩诺沙星相比,环丙沙星更易消除,各组织的消除半衰期都更短,与罗非鱼的消除规律相反[12]。
3.3 恩诺沙星在牛蛙肌肉中的最大残留限量
根据FAO/WHO下属的食品添加剂联合专家委员会(JECFA)的评估结果[32],恩诺沙星的ADI(每日安全摄取量)为0~2 μg/kg·bw,以60 kg成人计算,即每人每日安全摄取量为120 μg,在水产养殖中恩诺沙星拌饲投喂10~20 mg/kg,在高剂量(20 mg/kg)的条件下牛蛙肌肉中恩诺沙星占总残留量的90.18%,其代谢产物环丙沙星占总残留量的9.82%,因此根据《动物性食品中兽药残留限量标准制订技术规范(试行)》,结合食物消费系数确定恩诺沙星MRL,即恩诺沙星MRL牛蛙(肌肉)=120×90.18%=108.22 (μg/kg),取整之后为100 μg/kg,该结论与《食品安全国家标准食品中兽药最大残留限量》(GB 31650-2019)规定的恩诺沙星(含环丙沙星)的最大残留限量≤100 μg/kg[2]一致。
3.4 恩诺沙星的给药方案
牛蛙主要致病菌嗜水气单胞菌[33],恩诺沙星对嗜水气单胞菌的MIC为0.25 μg/mL[34],从同批病蛙中提取出的嗜水气单胞菌,测得恩诺沙星的MIC为0.1 μg/mL,而牛蛙单次口灌10%恩诺沙星粉混悬液(20 mg/kg bw),血液中恩诺沙星在192 h后低于0.1 μg/mL,肌肉中的恩诺沙星在336 h后低于0.1 μg/mL,并且恩诺沙星(含环丙沙星)的最大残留限量≤0.1 mg/kg,本实验测得低于0.1 μg/mL的时间(即休药期时间)为514.24 h,因此在本实验剂量(20 mg/kg bw)下的恩诺沙星药剂浓度适用于治疗由于嗜水气单胞菌致病的病蛙,且能够在休药期内保持牛蛙健康。

