维氏气单胞菌拮抗菌株J2-2的筛选、鉴定与效果评价
程心怡,孙正祥,苏应兵,周 燚
(1.长江大学农学院,湖北荆州 434025;2.长江大学动物科学学院,湖北荆州 434025)
泥鳅(Misgurnusanguillicaudatus)是我国重要的淡水经济鱼类之一,因其肉质鲜美,营养价值丰富,而深受消费者喜爱。近年来,随着养殖面积的扩大,病害发生也愈加频繁,严重制约了泥鳅养殖业的发展。泥鳅病害主要为泥鳅出血病[1]、泥鳅腐皮病[2]、泥鳅溃疡病[3]等,致使其发病的病原菌主要有维氏气单胞菌(Aeromonasveronii)[4]、霍乱弧菌(Vibriocholerae)和腐败希瓦氏菌(Shewanellaputrefaciens)[5]等,其中维氏气单胞菌感染所引起的病例占比较高[6]。
维氏气单胞菌是一种条件致病菌,能够产生溶血素、气溶素、细胞毒性肠毒素等[7]。相关研究表明,该病原菌在环境胁迫或条件合适的情况下,可引起如罗非鱼(Oreochromisniloticus)、鲈(Micropterussalmoides)、鲫(Carassiusauratus)和泥鳅(Misgurnusanguillicaudatus)、黄颡鱼(Pelteobagrusfulvidraco)、锦鲤(Cyprinuscarpio)等经济类鱼种的感染性菌血症和溃疡性疾病[8-13],并给水产养殖业造成了巨大经济损失[14]。
我国在水产养殖动物细菌性疾病的防治中主要使用化学药物防控,而过度使用此类药物容易使细菌耐药性增强,造成水体污染、药物残留等问题[15-16]。近年来,生物防治成为研究热点,拮抗菌以其无残留、绿色安全等优点逐渐替代化学药物,受到越来越多的关注。针对气单胞菌的生物防治国内外已有报道,KEEREELANG等[17]发现在饲料中添加植物乳杆菌(Lactobacillusplantarum)可以提高黑野鲮(Labeochrysophekadion)对嗜水气单胞菌(A.hydrophila)的抗病能力;陆婷巍等[18]从泥鳅养殖塘中分离出一株对杀鲑气单胞菌(A.salmonicida)有抑菌活性的解淀粉芽孢杆菌(Bacillusamyloliquefaciens)X8。而目前国内外对维氏气单胞菌拮抗菌的研究主要集中在耐药性、抑菌谱、动物安全性以及生长条件等[2,6,9,19,20]部分生物学特性的探究方面,对抑菌机理以及生产应用方面研究较少。本试验从泥鳅养殖池塘底泥中分离筛选获得了一株对维氏气单胞菌LCB-1有较好抑菌作用的芽孢杆菌J2-2,并对其抑菌活性物质进行了初步分析,以期为泥鳅水产养殖中维氏气单胞菌病的生物防治以及相关生物制剂的开发奠定基础。
1 材料与方法
1.1 试验材料
维氏气单胞LCB-1(由实验室前期从公安泥鳅养殖池塘患病泥鳅中分离获得,登录号:OQ781151)、嗜水气单胞菌N-2、杀鲑气单胞菌HY-2、米尔伊丽莎白菌(Elizabethellamilieri)WQ1、哈维氏弧菌(V.harveyi)YQW3、迟缓爱德华菌(Edwardsiellatarda)UP23由长江大学动科院水产研究实验室提供。
1.2 主要仪器与培养基
1.2.1 试剂和仪器来源
OMEGA DNA细菌基因组购自上海朗顿生物科技有限公司;细菌鉴定引物购自华大基因股份有限公司;无菌脱纤维羊血购自比克曼生物公司;扫描电镜VEGA 3 SBU;酶标仪SENSE425-301。
1.2.2 主要培养基
5%绵羊血琼脂平板:蛋白胨10 g,蛋白胨5 g,氯化钠5 g,琼脂15 g,蒸馏水1 L,高压灭菌冷却至50 ℃左右时加入体积分数5%无菌脱纤维羊血,混匀;Luria-Bertani(LB)培养基:蛋白胨10 g,氯化钠10 g,酵母提取物5 g,蒸馏水1 L。
1.3 实验方法
1.3.1 拮抗细菌的分离纯化
从湖北公安县泥鳅养殖基地的池塘中采取表层底泥样品,称取10 g倒入灭菌锥形瓶中,并在瓶中加入90 mL无菌水,混匀制备悬浊液。采用平板稀释法,将混浊液分别梯度稀释获得浓度为10-5、10-6、10-7的样品溶液,移取0.1 mL均匀涂布于LB固体培养基中。置于28 ℃恒温培养箱培养24 h后,挑选不同形态、颜色、大小的单菌落平板划线,进行分离纯化。
1.3.2 拮抗菌株的筛选
(1)初筛:以维氏气单胞菌LCB-1为指示菌株,采用滤纸片法对拮抗菌株进行初筛。之后将指示菌株菌液浓度培养至1×107CFU/mL,取100 μL均匀涂布于LB固体培养基上,再分别吸取5 μL浓度为1×107CFU/mL的拮抗菌菌液点种,每个重复3次,于28 ℃ 恒温培养箱培养24~48 h,记录抑菌圈的大小,挑选抑菌圈直径大的菌株为后续研究菌株。
(2)复筛:采用牛津杯法对上述抑菌圈直径大的分离菌株进行复筛。参照初筛制备菌液的方法,将指示菌株菌液浓度培养至1×107CFU/mL,并取100 μL均匀涂布到LB固体培养基上。用无菌打孔器打孔,孔直径约6 mm,每个孔加入50 μL的分离菌株菌液,重复三次。置于28 ℃恒温培养箱培养24~48 h,观察并测定抑菌圈直径,选定目标拮抗菌株。
1.3.3 拮抗菌株的形态观察和分子鉴定
(1)形态鉴定:将菌株J2-2划线于LB平板,28 ℃培养48 h,观察菌落的形态、大小、表面、湿润度等。挑取平板上的单菌落,经涂片、固定和革兰氏染色,显微镜下观察菌体形态。
(2)分子鉴定:严格按照Omega生物细菌基因组DNA提取试剂盒的操作步骤进行。将获得拮抗菌的细菌基因组DNA作为模板,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。参考王亚军等[21]的扩体系和程序,将PCR扩增产物送至华大生物工程股份有限公司进行测序,所获序列在NCBI中经BLAST进行同源性比较分析,利用MEGA X构建系统发育树。
1.3.4 拮抗菌株J2-2的抑菌谱
参考1.3.2的初筛方法,采用滤纸片法对常见鱼类致病菌的抑菌谱进行测定,测定拮抗菌的抑菌直径,所用指示菌包括:维氏气单胞LCB-1、嗜水气单胞菌N-2、杀鲑气单胞菌HY-2、米尔伊丽莎白菌WQ1、哈维氏弧菌YQW3、迟缓爱德华菌UP23。
1.3.5 拮抗菌株J2-2的药敏试验
参考王倩楠等[6]的方法,将拮抗菌培养至1×107CFU/mL,取100 μL稀释菌液,均匀涂布于LB固体培养基上,用K-B纸片扩散法检测拮抗菌株对青霉素、氨苄西林等15种抗生素的敏感性。根据杭州滨河微生物试剂有限公司的《纸片法药敏试验抑菌圈直径判断标准》判定拮抗菌对各种抗生素的耐药性[19]。
1.3.6 拮抗菌株J2-2的抑菌作用分析
(1)发酵产物抑菌试验:将拮抗菌株接入LB培养基中,30 ℃ 转速为180 r/min培养48 h并用0.22 μm无菌滤器进行过滤。取200 mL无菌滤液冷冻干燥并最终溶于10 mL无菌水中保存备用。采用牛津杯法测定发酵产物对维氏气单胞菌的抑制作用。分别将浓缩发酵液按体积倍比稀释至5个梯度(1、2、4、8、16、32倍)并取100 μL放入孔中,根据其抑菌圈直径评估其抑菌作用。
(2)发酵产物与维氏气单胞菌共培养:将维氏气单胞菌培养至1×107CFU/mL,加入不同比例稀释的浓缩发酵液继续培养。分别于0、2、4、6、8、10、12 h取100 μL,用酶标仪检测600 nm波长下的吸光值,绘制生长曲线。以同浓度等体积的维氏气单胞菌单独培养作对照组。
(3)扫描电子显微镜(SEM)观察:将维氏气单胞菌LCB-1和拮抗菌株分别培养至1×107CFU/mL。取2 mL维氏气单胞菌液加入到1 mL拮抗菌株的无菌滤液中,对照组则加入等体积LB培养基。30 ℃摇床培养1 h 后,离心去上清,2 mL 2.5%的戊二醛固定样品6 h后,用1 mL 30%、50%、60%、70%、80%、90%的乙醇以及无水乙醇按次序分别梯度脱水1次,每次脱水15~20 min。最后干燥、涂片、喷金,观察。
1.3.7 拮抗菌株J2-2的安全性与保护性评价
(1)溶血性实验:采用滤纸片法,以5%绵羊血琼脂平板为培养基,吸取5 μL菌液浓度为108CFU/mL拮抗菌株菌液点种。置于28 ℃培养箱,24 h后观察溶血情况。
(2)拮抗菌株对泥鳅的急性攻毒实验:活化的拮抗菌株接种至50 mL LB培养基在30 ℃摇床培养24 h。设3个试验组和1个对照组,每组重复三次,并在每箱加入 10 尾泥鳅。处理组分别腹腔注射终浓度为1×107、1×108、1×109CFU/mL的100 μL拮抗菌菌液,对照组注射相同体积的LB溶液,连续7 d观察并记录泥鳅的存活状态。
(3)拮抗菌株对泥鳅的保护性评价:参考王琳晶等[22]的方法并进行改善。将拮抗菌株和维氏气单胞菌LCB-1分别培养至107CFU/mL。处理组腹腔注射50 μL(107CFU/mL的拮抗菌菌液)+50 μL(107CFU/mL的维氏气单胞菌液)的混合液,对照组分别注射50 μL(107CFU/mL的拮抗菌菌液)+ 50 μL(LB)、50 μL(107CFU/mL的维氏气单胞菌液)+ 50 μL(LB),连续7 d观察并记录泥鳅的存活状态。
1.3.8 菌株J2-2抑菌物质的提取与检测
参考1.3.5的方法制备拮抗菌的无菌滤液并保存备用。以没有处理过的无菌滤液为对照,将拮抗菌的无菌滤液分别进行40、60、80、100、121 ℃热处理30 min,各取5 μL用于抑菌实验。蛋白酶K(20 mg/mL)于36 ℃下处理30 min,各取5 μL用于抑菌测试。pH梯度1、3、5、7、9、11处理2 h后调pH值至中性,各取5 μL用于抑菌测试,每个样本做3个重复,28 ℃培养24 h,观察其抑菌效果。活性物质的提取和色谱分析参考文献[23]。
1.3.9 数据分析
使用EXCEL2019和Sigmaplot 10.0、MEGA 7.0软件进行数据统计分析。
2 结果与分析
2.1 拮抗菌株的分离和筛选
通过对20株分离菌株的初筛、复筛试验,发现一株对维氏气单胞LCB-1效果最明显的菌株J2-2,其抑菌圈直径分别为(30.5±0.4)mm(图1-a)、(34.58±0.25)mm(图1-b)。
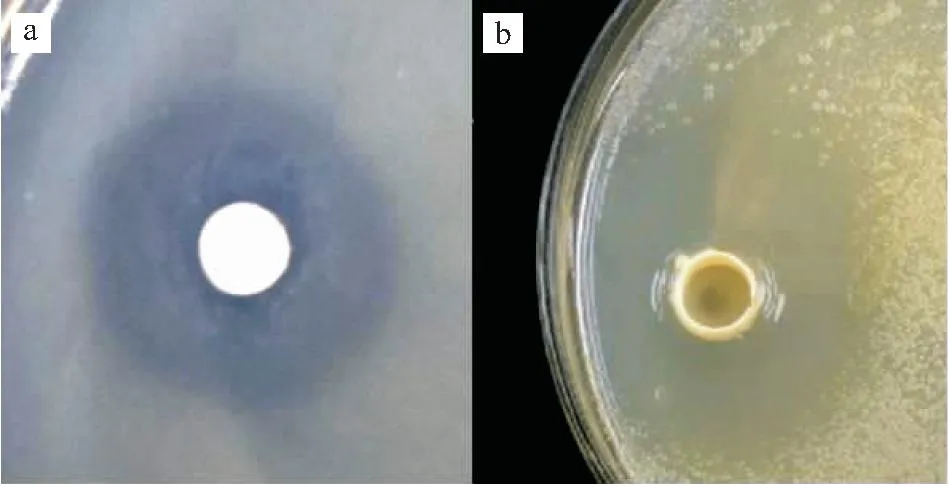
图1 菌株J2-2对维氏气单胞菌的抑菌作用Fig.1 The inhibition of strain J2-2 against A .veronii a:初筛;b:复筛
2.2 拮抗菌株J2-2的鉴定
2.2.1 形态鉴定
在LB培养基上的菌株J2-2菌落不透明,湿润,具有粘性。中间较厚,形状接近圆形、表面粗糙、边缘缺刻状。菌体呈短杆状,为革兰氏阳性菌(图2)。
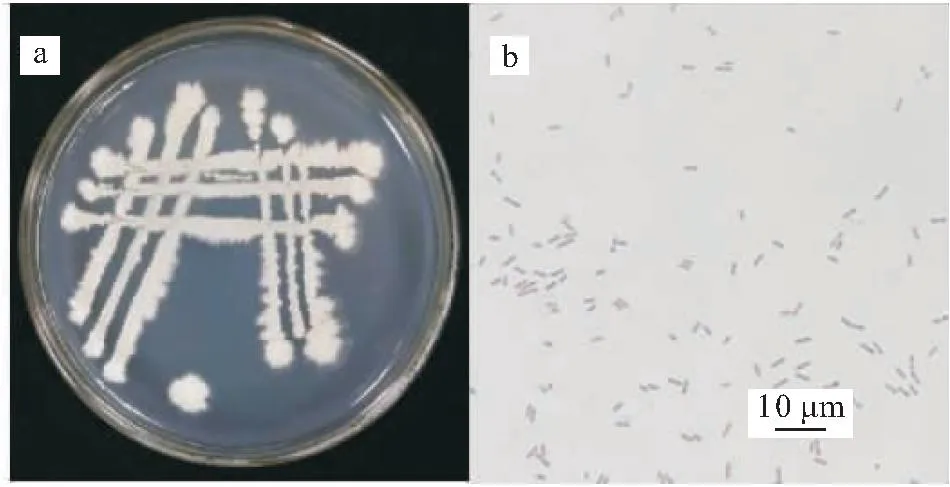
图2 菌株J2-2的形态观察Fig.2 Morphological observation of strain J2-2 straina:菌落形态;b:革兰氏染色
2.2.2 16S rDNA序列分析
将拮抗菌J2-2测序序列提交至 GenBank数据库进行BLAST比对,结果显示,拮抗菌J2-2与解淀粉芽孢杆菌同源性达到99.88%。由MEGA 7.0 系统构建系统发育树,与解淀粉芽孢杆菌归为一支(图3),因此,将J2-2初步鉴定为解淀粉芽孢杆菌,登陆号为 OQ781150。

图3 菌株16S rDNA系统发育分析Fig.3 16S rDNA phylogenetic analysis of strains
2.3 拮抗菌株J2-2的抗菌谱
解淀粉芽孢杆菌J2-2对不同的病原菌表现出不同的拮抗作用,具有较好的抑菌广谱性(表1)。

表1 菌株J2-2的抑菌试验Tab.1 Antibacterial test for strain J2-2
2.4 拮抗菌株J2-2对抗生素的抗性测定结果
解淀粉芽孢杆菌J2-2对青霉素、氨苄西林等15种抗生素的抗性结果见表2。解淀粉芽孢杆菌仅对氨苄西林、青霉素有耐药性,对克林霉素中度敏感,对头孢他啶、头孢曲松等12种抗生素高度敏感。
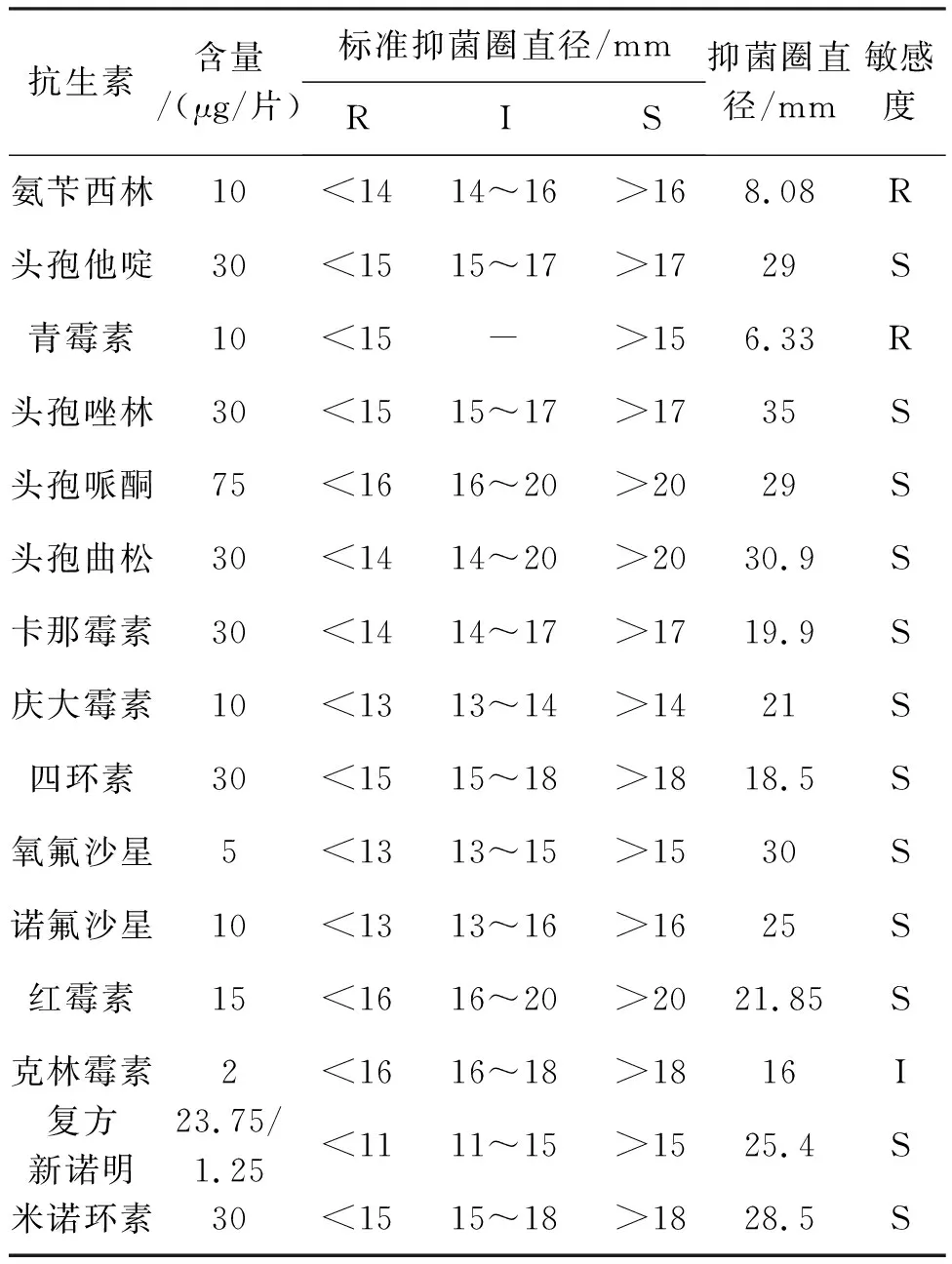
表2 药敏试验结果Tab.2 The results of drug sensitivity test
2.5 拮抗菌株J2-2对维氏气单胞菌的抑制作用
菌株J2-2的无菌浓缩发酵液对维氏气单胞菌LCB-1具有较强的抑制作用,随着浓缩发酵液浓度的增加其对维氏气单胞菌的抑菌圈也不断增大。当加入浓缩发酵液原液时对维氏气单胞菌的抑菌圈直径可以达到25.8 mm,将浓缩发酵液稀释32倍时仍具有一定的抑制效果(图4,5)。

图4 菌株发酵液对维氏气单胞菌的抑制作用Fig.4 The Antibacterial effect of strains of fermented liquids on A.veroniia:发酵液原液;b-f:将发酵液稀释2,4,8,16,32倍

图5 维氏气单胞菌与J2-2不同浓度发酵液共培养下的生长曲线Fig.5 Growth curve of A.veronii co-cultured with extracts of J2-2 strain culture
2.6 菌株J2-2对维氏气单胞形态的影响
维氏气单胞LCB-1经J2-2无菌上清液处理1 h后,其细胞显微形态发生了变化。对照组(图6-b)中维氏气单胞菌的菌体细胞呈现均匀的短杆状结构,菌体细胞边缘整齐,轮廓清晰,细胞结构完整丰满,为典型维氏气胞菌显微细胞形态[36];而处理组(图6-a)中维氏气单胞菌菌体细胞有明显内含物溶出,菌体轮廓模糊,而且大部分菌体结构明显被破坏,出现菌体破裂。

图6 维氏气单胞菌的扫描电镜图Fig.6 Scanning electron microscopic results of A.veroniia:处理组;b:对照组
2.7 拮抗菌株J2-2的安全性与保护性情况
2.7.1 拮抗菌株J2-2的溶血性实验
拮抗菌J2-2在血液琼脂培养基上培养24 h后,菌落周围未出现溶血现象(图7)。
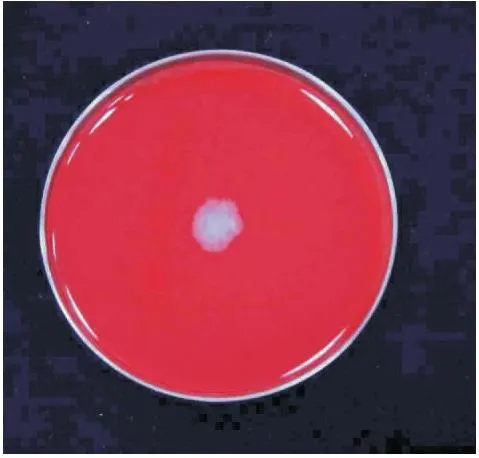
图7 J2-2的溶血性实验Fig.7 Hemolytic experiments for J2-2
2.7.2 拮抗菌株J2-2对泥鳅的急性攻毒试验
分别以终浓度107、108、109CFU/mL的菌株J2-2菌液100 μL腹腔注射泥鳅,连续观察7 d,发现泥鳅游动、摄食正常,未出现游动缓慢、打圈、离群独游、腹腔或体表出血腐烂等死亡现象,并且对照组也未出现不正常或死亡现象。
2.7.3 拮抗菌株J2-2的拮抗性验证
菌株LCB对泥鳅有较强的致病性,死亡率达73%。注射相同剂量的菌株LCB-1与J2-2混合液的泥鳅死亡率为26.7%,说明拮抗菌株J2-2对泥鳅有较好的保护作用(表3)。

表3 菌株J2-2对维氏气单胞菌的体内拮抗试验Tab.3 The inhibitory effect against A.veronii by strain J2-2 in vivo
2.8 抑菌物质的理化性质分析
当发酵液在pH 1~11时均具有良好的抑菌活性,仅在pH 1时抑菌活性显著降低(图8-a,P<0.05),说明活性成分的pH范围很广且具有较好的酸碱稳定性。温度(图8-b)在 80 ℃、100 ℃和 121 ℃时抗菌活性显著下降(P<0.05),但仍有较强的抗菌活性,说明该抗菌物质具有一定的热稳定性。活性发酵液经蛋白酶 K(图8-c)处理后发酵液抑菌活性没有显著变化,抑菌圈直径仍在 20 mm以上,表明抗菌物质对蛋白酶也具有很好的稳定性。

图8 理化因素对活性成分抑菌活性的影响Fig.8 Effects of physical and chemical factors on antimicrobial activity of active componentsa:pH;b:温度;c:蛋白酶K
LC-MS分析结果显示,菌株J2-2的活性物质中至少含有15种不同的有机化合物。匹配度高的化合物有Bacillaene、Fengycin A、Bacillomycin D、表面活性素A、表面活性素B、10-姜酚、甘氨胆酸、银杏酸和积雪草酸、尿苷、大黄酚等。其中,表面活性素A的质荷比为1 006.644,出峰时间在15.491~15.693 min(图9-a);表面活性素B的分子质量的质荷比为1 034.675,出峰时间在17.470~17.863 min(图9-b);Fengycin A的出峰时间在11.696~11.936 min,分子质量的质荷比为1 461.79(图9-g)[23]。

图9 菌株J2-2的抑菌活性物质中部分成分的质谱图Fig.9 Mass spectrogram of some components in antimicrobial active substances of strain J2-2a:表面活性素A;b:表面活性素C;c:大黄酚;d:亚油酸;e:尿苷;f:积雪草酸;g:Fengycin A;h:Macrolactin
3 讨论
3.1 J2-2对维氏气单胞菌的抑菌效果
芽孢杆菌作为水产养殖中一种常见的微生物制剂,具有净化水质、抑制病原菌生长,还能对鱼的抗病能力有一定促进作用[24]。本研究筛选获得一株对维氏气单胞菌有良好抑菌效果的解淀粉芽孢杆菌J2-2,抑菌直径可达到29 mm以上,与龙梦等[19]从红树林筛选获得的具有很强抑菌活性的解淀粉芽孢杆菌(抑菌圈直径20 mm)以及杨乔乔等[2]分离获得对泥鳅腐烂皮病具有良好抑菌效果的解淀粉芽孢杆菌(抑菌圈直径14.8 mm)类似。本研究结果表明该菌株对维氏气单胞菌具有较好的拮抗效果,菌株对大多数抗生素高度敏感,安全可靠,预计会有较好的市场接受度。但由于同一菌株在不同生长条件下,拮抗效果可能会有所差异[25],还需在生产实践中进一步评估。
3.2 抑菌活性物质的研究
解淀粉芽孢杆菌作为重要的生防菌其抑菌活性非常广泛[26]。本研究对菌株J2-2的抑菌活性进行了初步研究,发现抑菌活性物质在80 ℃以下没有显著变化,这一结果与何涛[9]的研究相似,且基本不受pH、蛋白酶K的影响。初步判断抑菌活性物质可能为脂肽类物质,具有较好的稳定性。
已有研究报道,解淀粉芽孢杆菌的抑菌机制主要包括产生拮抗作用和溶菌作用等方面[27]。徐红梅[28]报道解淀粉芽孢杆菌M1分泌的表面活性素可以通过破坏鳗弧细菌的细胞结构、改变细胞通透性来杀死病原菌。陆晓岑等[29]发现枯草芽孢杆菌BA015能够分泌Iturin、Bacillomycin类脂肽同系物,并对无乳链球菌有防治作用。陈永兴[30]筛选获得一株芽孢杆菌JCL16能够通过分泌Surfactin和Fengycin来抑制诺卡氏菌的生长;本研究通过液相色谱分析发现该菌株J2-2的抑菌活性物质中至少含有15种不同的脂肽类化合物,其中匹配度高的化合物有Bacillaene、Fengycin A、Bacillomycin D、表面活性素A、表面活性素B等,与前人研究相似[23]。推测扫描电镜中拮抗菌株作用于病原菌体表面出现的溶解现象,可能是解淀粉芽孢杆菌产生的抑菌物质如脂肽类抗生素等造成的[31-36],具体的抑菌机制还有待进一步研究。
4 结论
本试验获得的一株解淀粉芽孢杆菌J2-2对维氏气单胞菌有显著抑菌效果,抑菌直径可达(29.5±0.8)mm,对嗜水气单胞菌、杀鲑气单胞菌等多种水产致病细菌也有较好的抑制作用。解淀粉芽孢杆菌J2-2不但能够产生多种脂肽类抗生素,且对鱼类无致病性,不产生溶血素,安全可靠,在泥鳅水产养殖中具有一定应用潜力。

