电针干预去势骨质疏松大鼠“骨微生态”的作用机制研究
屈媛媛,杨添淞,孙忠人,冯楚文,林楚华,王庆勇,马 帅,秦鸿宇,鲍圣涌△
1.深圳市人民医院,广东 深圳 518020;2.黑龙江中医药大学第二临床医学院,黑龙江 哈尔滨 150040;3.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;4.黑龙江省针灸临床(脑病)神经生物学重点实验室,黑龙江 哈尔滨 150040
绝经后骨质疏松症(Postmenopausal osteoporosis,PMOP)以全身骨量减少、骨微观结构退化为特征,主要发生在女性绝经后[1]。社会老龄化加剧了医疗资源和医疗需求之间的失衡[2]。因此,PMOP的临床防治必须高度重视。PMOP的西医治疗主要包括药物疗法、雌激素替代疗法与营养疗法等,其中大多数药物存在服药周期长、不良反应多且使用不便等缺点[3]。研究证实针灸防治PMOP有效[4-5],在改善骨密度(Bone mineral density, BMD)、激素水平和骨代谢等方面疗效显著。前期研究证实电针“关元”和“后三里”可以改变去势骨质疏松大鼠的骨矿物质含量、BMD及炎症因子等指标。
肠道微生物组成的“虚拟器官”在生理和病理过程中发挥着调节作用[6],Ohlsson等提出的“骨微生物学”更是直接阐明了肠道菌群在骨健康中的重要性[7]。为深入研究电针干预机制,本研究从“骨微生物”角度入手,纳入16S rRNA测序技术。16S rRNA测序技术是最常用的高通量测序依赖的组学技术之一,实现了对复杂样品中混合菌种的分类学鉴定和精确定量,并通过生物信息学分析获得实验样品中细菌物种组成、物种丰度与群落比较等诸多信息[8-10]。因而本研究应用去势雌性大鼠建立骨质疏松模型,利用生物力学实验检测骨质,结合16S rRNA测序技术,试图从肠道菌群的丰度及构成变化层面阐释电针对去势骨质疏松大鼠的作用机制。
1 材料与方法
1.1 实验动物
雌性SPF级大鼠80只,6月龄,体质量(320±30)g,购自青岛市实验动物和动物实验中心[许可证编号:CXK (鲁)2014 0001]。于SPF级实验室适应性饲养7 d,在此期间大鼠自由饮水进食,环境温度22~24 ℃,相对湿度 40%~60%,昼夜节律12 h光/12 h暗。每日定期更换垫料,清洗大鼠饮水器并补充饲料及饮用水。本实验经深圳市人民医院医学伦理委员会批准(批件号:LL-KY-2019170)。
1.2 实验材料
1.2.1 仪器 电针仪(HANS-200A,南京济生医疗科技有限公司);20 kN电子万能试验机(AGXplus,岛津);核酸电泳仪(DYCP-32C,北京市六一仪器厂);超声波破碎仪(Covaris S2 System, Massachusetts);Qubit Fluorometric Quantification (Qubit 2.0, Thermo Scientific);生物分析仪(Agilent 5400, Agilent Technologies Co Ltd.);PCR仪(T100PCR, Bio-Rad);测序仪(Novaseq 6000, Illumina,San Diego)。
1.2.2 试剂 CTAB方法提取样本DNA(Nobleryder);Phusion© High-Fidelity PCR Master Mix with GC Buffer (M0531S, New England Biolabs);Phusion© High-Fidelity DNA polymerase (M0530S, New England Biolabs);2% agarose gels (111860, biowest);PCR产物纯化Universal DNA纯化回收试剂盒(DP214, TianGen);NEB Next© Ultra DNA Library Prep Kit (E7370L, Illumina, San Diego)。
1.3 建模
将80只6月龄、体质量(320±30)g的雌性大鼠随机平均分为两组,假手术组(Con)20只和造模组60只。3%戊巴比妥钠(1 mL/100 g)腹腔注射麻醉后,Con组大鼠切除卵巢周围部分脂肪组织(大小同卵巢)后缝合;造模组切除双卵巢。保温待麻醉苏醒。术后肌注青霉素生理盐水(4万单位/mL)抗炎,每天注射1.5 mL,连续3 d。自由摄水和进食标准饲料,其中钙和磷含量分别为0.6%和0.4%,饲养12周[11],期间不给予任何干预,造模成功。
1.4 分组与干预
将造模成功大鼠随机分为模型组(Mod)20只、电针A组(MA)20只与电针B组(MB)20只。MA和MB大鼠接受电针治疗,取穴“关元”“后三里”,连接电针,正极接“后三里”(两侧隔日交替连接电针),负极接“关元”疏密波,2 Hz/15 Hz,1 mA[12- 13]。电针治疗1次/d,每次15 min,留针10 min,连续治疗6 d后休息1 d。MA连续治疗4周后取材,MB连续治疗8周后取材。
1.5 标本收集
每组随机选取10只大鼠,将其置于代谢笼中收集粪便,放入-80 ℃低温冰箱保存,待进行16S rRNA测序。随后各组所有大鼠接受3%戊巴比妥钠(1 mL/100 g)麻醉,颈椎脱臼法处死后,取右侧胫骨、第5腰椎体。注意在不损伤骨质的情况下,去除附着的肌肉和结缔组织,用PBS生理盐水浸透的纱布包裹摘出的骨骼,装入密闭冻存管中并编号,将标本放置于-80 ℃冰箱留待生物力学检测。
1.6 生物力学检测
1.6.1 椎骨压缩实验 L5椎体解冻至室温(22~35 ℃),注意维持骨骼湿润。将椎弓根等附件从椎体分离,使用砂纸打磨椎体上下表面使之平行,以暴露松质骨为限。将打磨后椎体置于电子万能试验机上,确认上下表面紧贴平行的不锈钢板,以0.05 mm/s的速度进行压缩,达到极限载荷,即出现骨折为限。记录载荷变形曲线及最大载荷、弹性模量。
1.6.2 三点抗弯实验 右胫骨解冻至室温,在电子万能试验机上完成三点抗压最大载荷检测。支点跨距为30 mm,加载跨距10 mm,加载速率为0.5 mm/min,至胫骨折断瞬间电脑自动采集到三点抗压最大载荷。记录载荷变形曲线及最大载荷、弹性模量。
1.7 粪便16S rRNA测序
1.7.1 DNA抽提和PCR扩增 采用CTAB提取样本基因组DNA,利用1%琼脂糖凝胶电泳检测DNA纯度和浓度,取适量样品于离心管中,无菌水稀释样品至1 ng/μL。用341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)引物对V3+V4可变区进行PCR扩增。
1.7.2 PCR产物纯化和混样 根据PCR产物浓度等量混样,混匀后用1xTAE 2%琼脂糖凝胶电泳纯化PCR产物,使用纯化回收试剂盒回收目的条带。
1.7.3 文库构建和上机测序 使用NEB Next© Ultra DNA Library Prep Kit进行文库构建,将构建好的文库使用安捷伦5 400检测和Q-PCR定量;文库合格后使用NovaSeq 6000上机测序。
1.7.4 信息分析 将原始序列fastq文件导入为可进行QIIME2后续处理的文件格式。然后运用QIIME2 dada2插件进行质控、修剪、去噪、拼接和去除嵌合体后,得到了最终特征序列表格[14]。运用QIIME2 feature-classifier插件将ASV的代表序列比对到预先训练好的13_8版本99%相似度的GREENGENES数据库(根据341F/806R引物对将数据库修剪到V3V4的区域),得到了物种的分类信息表[15]。用QIIME2 feature-table插件剔除所有污染性的线粒体和叶绿体序列。LEfSe和DEseq2方法鉴定分组和样本间丰度有差异的细菌[16-18]。应用R软件包“mixOmics”,偏最小二乘判别分析(PLS-DA)揭示微生物群落与样品类别之间的关系模型来实现对样品类别的预测[19]。
1.8 统计学处理
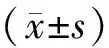
2 结果
2.1 生物力学分析结果
2.1.1 各组椎骨压缩实验比较 与Con相比,Mod大鼠的椎骨最大载荷、弹性模量均下降,差异具有统计学意义(P<0.01),证实造模成功;与模型组比较,MA和MB的椎骨最大载荷、弹性模量均升高(P<0.05或P<0.01);且MB的椎骨最大载荷、弹性模量优于MA,差异具有统计学意义(P<0.05或P<0.01)。见表1。
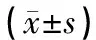
表1 椎骨压缩实验结果
2.1.2 各组三点抗弯实验比较 与Con比较,Mod大鼠的胫骨最大载荷、弹性模量均下降,差异具有统计学意义(P<0.01),证实造模成功;与模型组比较,MA和MB的胫骨最大载荷、弹性模量均升高;且MB的胫骨最大载荷、弹性模量优于MA,差异具有统计学意义(P<0.05或P<0.01)。见表2。

表2 胫骨三点抗弯实验结果
2.2 粪便菌群测序结果分析
2.2.1 样品共有物种分析 Con和Mod共有OUT(Operational Taxonomic Unit,即分类操作单元)数目879;Mod和MA共有OUT数目1061;Mod和MB共有OUT数目979。Con、Mod、MA与MB各自特有OUT数目分别为604、446、610和1035。4组共有OUT数目为699。见图1。

图1 共有或特有物种韦恩图
2.2.2 物种组成分析 从门级别的分布情况来看,共检测出20种主要细菌门类,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)位列前3。与假手术组比较,模型组厚壁菌门、放线菌门丰度增加,拟杆菌门减少,电针干预后出现不同程度的回调。见图2。
2.2.3 组间OTU差异显著性分析 LEfSe分析各组特征微生物结果:在属水平上,假手术组中的特征微生物是Jeotgalicoccus属和考拉杆菌属(Phascolarctobacterium);模型组的特征微生物是乳杆菌属(Lactobacillus)和Akkermansia属;电针治疗A组的特征微生物是颤螺旋菌属(Oscillospira)、罗氏菌属(Roseburia)、螺杆菌属(Helicobacter)和梭菌属(Clostridium);电针治疗B组的特征微生物是假单胞菌属(Pseudomonas)、Dysgonomonas属、乳球菌属(Lactococcus)、紫色杆菌属(Janthinobacterium)、链球菌属(Streptococcus)、丁酸弧菌属(Butyrivibrio)、Paludibacter属、肠球菌属(Enterococcus)和罗思氏菌属(Rothia)。见图3、表3。

图3 LEfSe分析LDA柱形图(genus属)(LDA>2)
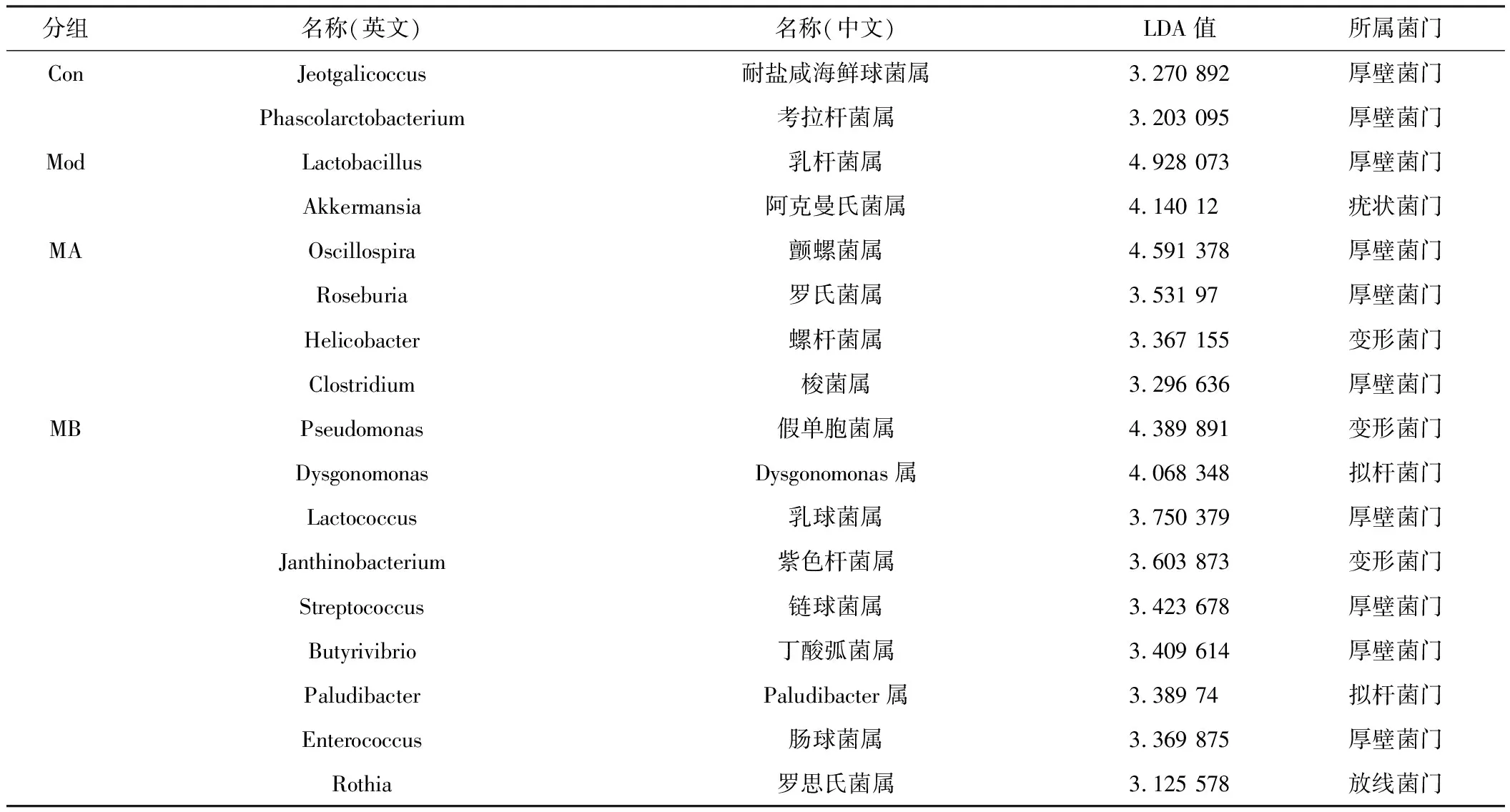
表3 各组特征微生物(LEfSe分析LDA值>2物种,genus水平)
DESeq2分析组间差异菌属结果:比较假手术组与模型组,在属、科、目、纲与门水平上的差异OUT分别为5种、2种、2种、1种和1种,矫正后P值均<0.05。其中具有显著统计学差异的考拉杆菌属、耐盐咸海鲜球菌属为LEfSe分析的假手术组优势菌属。见表4。

表4 Con和Mod之间的DESeq2差异丰度
比较模型组与电针A组,在属、科、目、纲与门水平上的差异OUT分别为6种、7种、6种、4种和1种,矫正后P值均<0.05。其中具有显著统计学差异的螺杆菌属、颤螺菌属为LEfSe分析的电针A组优势菌属。见表5。

表5 Mod和MA之间的DESeq2差异丰度
比较模型组与电针B组,在属、科、目、纲与门水平上的差异OUT分别为7种、12种、9种、4种和2种,矫正后P值均<0.05。其中具有极显著统计学差异的假单胞菌属、Dysgonomonas属和紫色杆菌属为LEfSe分析的电针B组优势菌属。见表6。
分析以上表格发现,DESeq2分析结果中Mod与MB比较结果具有显著性统计学差异的菌群包含了所有Mod与MA比较组具有显著性统计学差异的相关菌群。
2.2.4 Beta多样性指数统计分析 同一分组的样本彼此之间距离较近,不同分组的点之间距离较远,表明分类模型效果越好。见图4。所得到曲线下面积值均接近于1,说明区分效果好,有多个微生物在分组间丰度有差异。见图5。

图4 PLS-DA坐标图

图5 PLS-DA AUC曲线图
3 讨论
本研究对大鼠的胫骨和椎骨分别进行了骨质疏松表型研究的经典实验[20]三点抗弯实验和椎骨压缩实验,两种检测结果的最大载荷和弹性模量均在造模后出现下降,在电针干预后出现不同程度的回调,说明骨受力和骨韧性显著改善,从生物力学角度证实模型建立成功及电针干预对去势大鼠骨质疏松有效,其中干预8周的数据优于4周,肯定了模型制备的可靠性和电针的疗效。选穴“关元”“足三里”两穴,选穴思路来源于“双固一通”针灸理论[21]。天癸和气血正常运行在维持女性的生理功能方面发挥了重要作用[22],“双固”即固护先天和后天之本,恰合围绝经期女性生理特点。关元穴功能补肾培元,“肾主骨生髓”,补益先天;足三里健运脾胃,调理后天,二者固护正气、以治为防,充分体现了“治病求本”的中医治疗观。配合疏密波电针治疗,放大针灸治疗效果,操作方便。
大量研究证实肠道菌群失调与人类和啮齿动物的骨关节炎和骨质疏松发展相关[23]。作为肠道菌群中最主要的门[24-26],调节厚壁菌门和拟杆菌门的比例有利于抑制肌肉骨骼组织中因年龄增加引起的慢性炎症和氧化损伤[23]。可见骨质与肠道菌群之间联系密切。本研究各分组之间菌群差异明显,随着电针治疗时间延长,各个层面具有显著差异的肠道菌群数量均上升,表明电针治疗呈时效累加性改善骨质疏松大鼠肠道菌群状态。
从门级别的分布情况而言物种组成,本研究检测出的20种主要细菌门类中,厚壁菌门、拟杆菌门和放线菌门位列前3。与假手术组比较,模型组的厚壁菌门、放线菌门丰度增加,拟杆菌门减少,电针干预后出现不同程度的回调。查阅文献发现,厚壁菌门和拟杆菌门在骨代谢中发挥的作用可能与雌激素抑制有关[27]。研究指出厚壁菌门在去势术后8周内下降,随后明显增加,而且增加幅度和去势前比较差异有统计学意义(P<0. 05)[28],趋势变化与本研究一致。肠道微生物组及其发酵副产物与骨代谢有关,能量缺乏、雌激素不足可致骨骼健康受损,神经性厌食症者厚壁菌门减少[29]。老年人群厚壁菌门细菌减少导致短链脂肪酸含量下降,影响其发挥抗炎、抗肿瘤活性等作用[30]。
拟杆菌门为多囊卵巢综合征(Polycystic ovary syndrome,PCOS)优势菌[31]。而在来曲唑联合高脂饮食诱导的PCOS大鼠肠道菌群中,各分类水平的拟杆菌丰度均减少[32]。而且拟杆菌门可以异常增殖产生脂多糖[33],降解肠黏膜上黏蛋白[34],诱导和维持肠道微环境慢性炎症状态。由此证实拟杆菌门可诱导炎症反应,但对激素水平呈现出双向调节作用,此外其与骨质状态也存在一定联系。研究发现万通筋骨片可以显著改变类风湿关节炎大鼠肠道菌群门水平上的拟杆菌、软壁菌和脱铁杆菌的菌群相对丰度,恢复拟杆菌与厚壁菌的相对丰度比值到正常水平[35];去势后拟杆菌(门/纲/目)逐渐增加到术后8周,随后显著下降[28],趋势与本研究一致。
放线菌门同样是PCOS患者肠道菌群的主要优势菌门[31]。在探讨骨质疏松模型大鼠肠道菌群结构多样性特征及固本增骨方作用靶点菌种的研究中发现,模型对照组、空白对照组、戊酸雌二醇组及固本增骨方的菌群存在差异,差异菌群主要集中在放线菌门、螺旋菌门、变形菌门、厚壁菌门和拟杆菌门等[36]。
进一步查阅LEfSe和DESeq2结果综合分析出的具有显著统计学差异的各组属水平上特征微生物与PMOP发病相关病理特点发现,假手术组中的考拉杆菌属在卵巢功能低下大鼠中为显著差异菌群[37],为PCOS患者与健康人群的差异菌群[38],队列研究指出其丰度与骨质疏松正相关[39]。耐盐咸海鲜球菌属为穴位埋线干预PMOP的显著差异菌群[40]。结合两菌属为空白组中的显著特征微生物,可以推测其菌群特征可能用于区分雌激素分泌健康与非健康人群,同时后者与骨质疏松相关。电针A组中的螺杆菌属在雌性大鼠去势后12周显著增多[28]。颤螺菌属丰度与骨质疏松正相关[39],与抗骨质疏松作用负相关[41];其在去势大鼠中显著富集,可能是核因子-κB受体激活剂和抗酒石酸酸性磷酸酶显著上调和骨保护素下调的原因之一[42]。电针B组中,假单胞菌属归属于变形菌门,变形菌门为PCOS优势菌[31],在HIV/AIDS 患者免疫重建不良、免疫重建良好和健康人群的3组间肠道菌群丰度差异有统计学意义(P<0.05)[43],证实该菌属丰度与炎症及女性机体代谢相关。Dysgonomonas属隶属于拟杆菌门,紫色杆菌属为部分市售牛奶中含有的菌属[44]。
通过分析各组特征微生物发现,假手术组的特征微生物均归属于厚壁菌门,模型组的归属于厚壁菌门和疣状菌门,电针干预后的主要集中在厚壁菌门和拟杆菌门,其中治疗8周的大鼠肠道菌群的特征微生物更多,与物种组成分析结果一致。综上可以得出结论,去势大鼠的肠道菌群存在菌种失调现象,电针可以改善;各组属水平上特征微生物主要归属于厚壁菌门、拟杆菌门和放线菌门,与骨代谢、炎症反应和激素水平密切相关;电针可能通过调节肠道菌群丰度和组成结构来发挥抗骨质疏松作用,且治疗效果在一定时间范围内具有累加性。
本研究发现了“双固”针法干预所影响的特异性肠道菌群,同时从时间上纵向证实针灸疗效的产生并非偶然,而是随治疗时间的增加逐步提高的。但尚存不足之处:其一,仅利用生物力学实验结果证实模型建立的有效性,未结合病理切片进行佐证;其二,本研究选穴关元和足三里两穴,虽契合针灸多靶点干预的特点,但未能细致阐明单穴对“骨微生态”的影响,较之单穴研究意义稍逊;其三,未对上述特征微生物进行体外或体内实验验证。

