耐碳青霉烯类铜绿假单胞菌的耐药机制及特征分析
王亚平 麦吾丽旦·居来提 张中文 李玉珍 徐令清 温伟洪
1 广州医科大学附属第六医院//清远市人民医院 广东清远 511518; 2 广东医科大学 广东东莞 523000
铜绿假单胞菌(pseudomonas aeruginosa,PA)是一种重要的革兰阴性杆菌病原体,经常导致人类严重感染。其中,耐碳青霉烯类铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa,CRPA)为临床常见且重要的多重耐药革兰阴性杆菌,在世卫组织公布的急需新型抗生素的重点病原体列表中,CRPA被列为优先 I 级(危急),仅在美国每年就有51000例院内感染和400例死亡病例是多重耐药铜绿假单胞菌的引发的[1]。在中国,对铜绿假单胞菌菌株的监测是近二十年来每年实施的医院感染控制战略计划的一部分。碳青霉烯类抗生素是目前抗菌谱最广、抗菌活性最强的β内酰胺类抗生素,但随着其频繁使用,碳青霉烯类耐药革兰阴性杆菌检出率日益增加。头孢他啶/阿维巴坦(ceftazidime-avibactam,CZA)是一种新型β-内酰胺酶抑制剂合剂,在临床上CZA主要用于治疗不产B类金属β-内酰胺酶的碳青霉烯类耐药肠杆菌目细菌和CRPA引起的感染[2],但近年CZA耐药CRPA逐渐增加。基于此,本文对本院近年临床分离的CRPA进行耐药性分析,重点关注CRPA对CZA耐药状况,同时了解本院CRPA对碳青霉烯类耐药机制,旨在为临床治疗CRPA感染提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源
依据微生物标本采集规范,收集广州医科大学附属第六医院2020—2022年临床分离的非重复CRPA共22株,质控菌株为铜绿假单胞菌ATCC27853,每批号试剂必须进行质控,确保试剂性能在控。
1.1.2 仪器试剂
BD phoenix M50全自动鉴定药敏分析仪、革兰阴性细菌鉴定药敏复合板等配套耗材、阳离子调节MH(cation adjusted mueller hinton broth,CAMHB)肉汤(美国BD公司),碳青霉烯酶检测试剂盒(天津一瑞生物公司),头孢他啶粉剂、阿维巴坦粉剂(北京索莱宝公司),血琼脂平板、MH平板(郑州安图公司)。
1.2 方法
1.2.1 CRPA菌株鉴定与药敏检测
采用BD Phoenix M50全自动药敏分析仪进行PA菌株鉴定与药敏分析,实验操作严格按照仪器操作规程进行,药敏判读标准参考2022 CLSI抗微生物药物敏感性试验标准,CRPA判断标准:PA对亚胺培南MIC8 μg/mL或美罗培南MIC8 μg/mL判读为CRPA。
1.2.2 CRPA菌株CZA最低抑菌浓度检测
1.2.2.1 菌液配备 用无菌棉拭子蘸取培养16~18 h新鲜CRPA菌落,使用无菌生理盐水调配成0.5麦氏浓度菌悬液(菌落数约1.5×108CFU/mL),然后用CAMHB肉汤稀释50倍(菌落数约3×106CFU/mL)。
1.2.2.2 抗菌药物溶液配备 配备头孢他啶及阿维巴坦贮存液,头孢他啶溶剂为碳酸钠,稀释液为水,贮存液药物浓度为32 768 μg/mL;阿维巴坦溶剂、稀释液均为水,配置的贮存液药物浓度为16 μg/mL。
1.2.2.3 微量肉汤稀释法检测CZA的MIC 用相应稀释液将头孢他啶抗菌药贮存液稀释至相应浓度,头孢他啶共12个稀释浓度,每孔分别加相应浓度头孢他啶50 μL及阿维巴坦溶液25 μL,每孔加稀释后菌液25 μL菌液,最终菌液浓度为7.5×105CFU/mL,阿维巴坦浓度为4 μg/mL,总体积为100 μL,置35℃培养箱培养16~18 h后观察结果,判读CZA的MIC。
1.2.3 CRPA菌株碳青霉烯酶检测
1.2.3.1 采用改良碳青霉烯类灭活试验(mCIM)试验筛查CRPA菌株碳青霉烯酶,结果判断操作严格按照2022 CLSI抗微生物药物敏感试验执行标准进行。实验步骤:①取10 μL接种环满环的铜绿假单胞菌于血琼脂平板上过夜培养纯菌落。②取过纯菌落于TSB肉汤中混匀,每管放入含10 μg美罗培南的无菌纸片完全浸入菌悬液。③孵育结束后用生理盐水制备0.5麦氏浊度大肠埃希菌ATCC25922悬液。④将美罗培南纸片从肉汤中挤去多余水分,贴于已涂布ATCC25922的MH平板上,然后倒置平板孵育18~24 h,量取抑菌圈直径。美罗培南抑菌圈直径≤15 mm或者直径为16~18 mm但抑菌圈内有散在菌落判断为碳青霉烯酶阳性,抑菌圈直径≥19 mm则判断为阴性。
1.2.3.2 采用胶体金免疫层析法筛查CRPA菌株5种碳青霉烯酶酶型,包括IMP、VIM、NDM、KPC、OXA-48,酶免疫层析法筛查CRPA菌株5种碳青霉烯酶,包括IMP、VIM、NDM、KPC、OXA-48,操作方法:于试管中滴加5滴细菌裂解液,挑取一接种环新鲜纯培养菌于裂解液中,轻轻混匀后滴加100 μL裂解后的菌液于样品孔中,15 min观察结果,结果判读:根据检测条上红色线条位置判断碳青霉烯酶种类。
1.2.3.3 采用全基因组测序对碳青霉烯酶筛查阳性菌株进行碳青霉烯酶耐药基因检测,菌株外送广东美格基因科技有限公司进行全基因组测序,对于返回的全基因组测序数据,使用fastq v0.20软件对数据进行质控[3],确保测序数据质量符合要求。随后使用SPAdes v3.13.1软件将测序后的双端序列组组装[4]。经过组装后,使用contig-tools软件(https://gitlab.com/antunderwood/contig_tools)去除长度小于500 bp的contigs;接着使用kraken2 v 2.1.2软件将组装完成的contigs与kraken2物种分类数据库进行对比完成菌种鉴定[5]。获得组装完成的contigs后,ABRicate v0.8.7软件(https://github.com/tseemann/abricate)基于ResFinder用于对样本含有的耐药基因进行鉴定[6]。mlst v2.23.0 软件(https://github.com/tseemann/mlst - Torsten Seemann)用于比对管家基因从而鉴定菌株的ST分型。
2 结果
2.1 CRPA临床分布特征
在22株CRPA中,男性患者20例(90.9%)高于女性患者2例(9.1%);年龄分布范围为39~89岁,平均68.3岁,60岁及以上患者17例(77.3%)显著高于60岁以下的患者;科室分布主要是危重医学科13例(59.1%),其次是呼吸内科4例(18.2%)、神经内科3例(13.7%)、神经外科和普通外科各1例(4.5%);标本类型中最常见的是痰液标本14例(63.8%),其次是肺泡灌洗液标本4例(18.2%),尿液、胆汁和腹腔引流液标本各1例(4.5%)。
2.2 CRPA耐药特征及碳青霉烯酶检测结果
在收集到的22株临床分离CRPA菌株中,耐药率最低的为头孢他啶/阿维巴坦(22.7%),其次为庆大霉素和阿米卡星(27.3%),哌拉西林/他唑巴坦(59.1%),头孢吡肟(63.6%)。耐药率在70%以上的依次是头孢他啶和氨曲南(77.3%),环丙沙星(86.4%),左氧氟沙星(95.5%)。mCIM试验初筛碳青霉烯酶阳性共5株,胶体金免疫层析法检测产碳青霉烯酶CRPA共5株,两者结果一致,详情见表1。
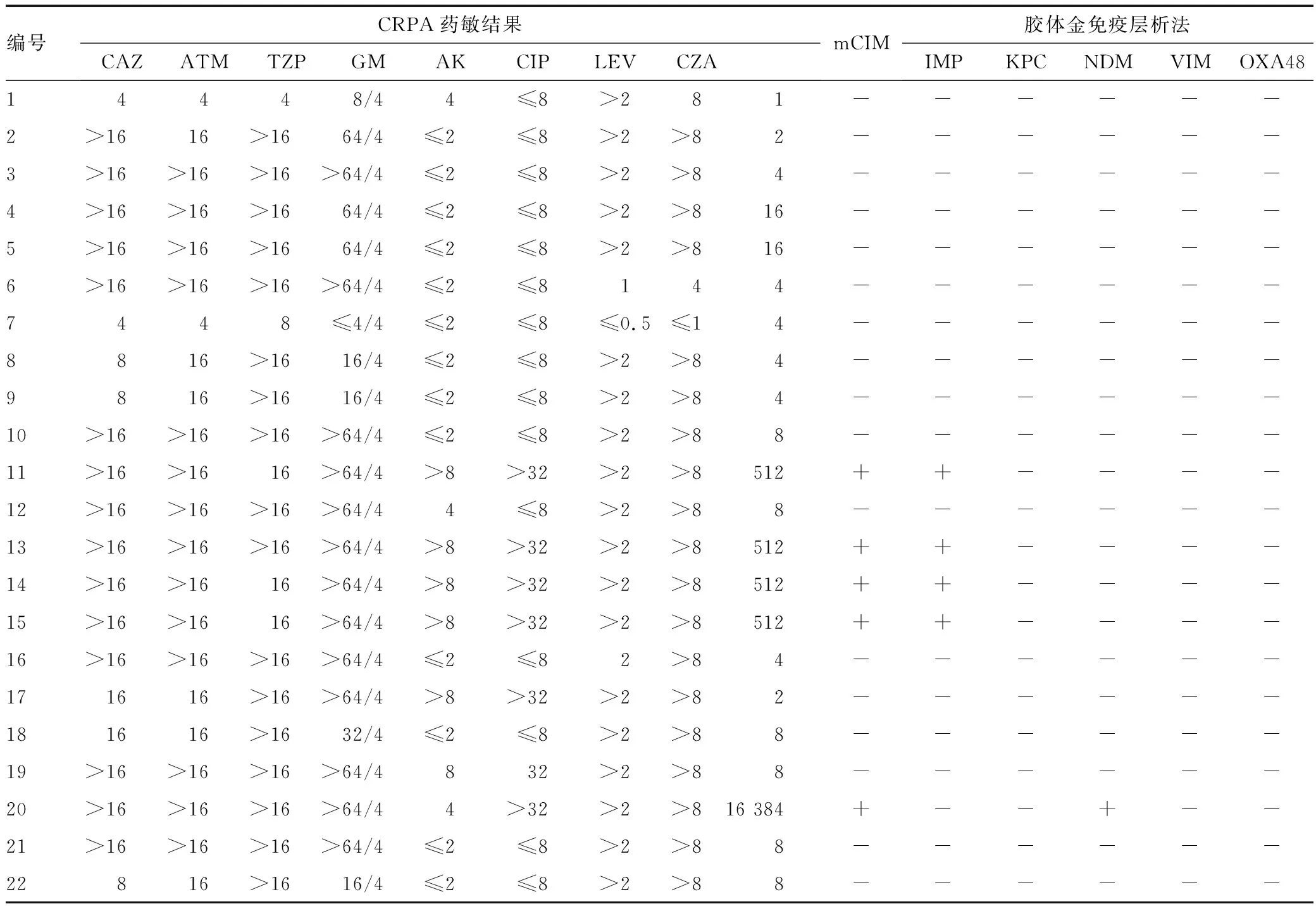
表1 CRPA耐药特征及碳青霉烯酶检测结果
2.3 CRPA全基因组测序结果
全基因组测序结果显示,在5株碳青霉烯酶筛查阳性的CRPA中,4株产金属β-内酰胺酶IMP-45及丝氨酸酶OXA-1,OXA-50,且均为ST549型,1株产金属β-内酰胺酶NDM-1,为ST245型,而CZA耐药CRPA菌株均产金属β-内酰胺酶,这与胶体金免疫层析法检测结果与mCIM结果一致。此外,5株CRPA全部携带与铜绿假单胞菌的毒力密切相关的ExoS、ExoT和ExoY基因。
3 讨论
PA耐药机制包括天然耐药、获得性耐药、适应性耐药,耐药表型可呈多重耐药(Multiple drug-resistance,MDR)、广泛耐药(Extensively drug-resistant,XDR)、全耐药(Pan drug-resistance PDR),难治耐药性(Difficult-to-treat resistance DTR),其中CRPA为临床上常见且重要的多重耐药菌。据我国细菌耐药监测网数据显示,PA在2005至2018年期间对碳青霉烯类药物的耐药率保持在25%-30%,2022年对亚胺培南和美罗培南的耐药率分别为22.1%和17.6%[7],近几年呈缓慢下降趋势。Zhao等[8]收集了广东省10家医院的416株PA,CRPA占比96.9%,MDR和XDR多达64.8%和15.7%。以上种种证据表明,CRPA感染和治疗的形势依旧严峻。此外,相对于碳青霉烯类敏感铜绿假单胞菌,CRPA感染给患者带来更长的住院时间及更高的死亡率[9-10]。Khalili等[11]纳入了7家医院患者的116株研究发现,入住ICU、机械通气及菌株全耐药是CRPA感染导致死亡率上升的最重要因素。Hu等[12]研究数据显示CRPA感染危险因素包括年龄≥60岁患者、住院尤其是入住ICU。本研究中,22株CRPA中≥60岁患者17例,分布科室主要是危重医学科,这与国内外的研究结果相一致。原因可能主要是患者基础疾病多、病情危重、自身抵抗力低及各种侵入性操作频繁等造成了CRPA的产生。
头孢他啶/阿维巴坦(CZA)是一种新型β-内酰胺酶抑制剂合剂,阿维巴坦可抑制A类、C类、部分D类(如OXA-48)丝氨酸β内酰胺酶而不能抑制B类金属β-内酰胺酶[13],因此在临床上CZA主要用于治疗不产B类金属β-内酰胺酶的碳青霉烯类耐药肠杆菌目细菌和CRPA引起的感染[2],相对于粘菌素B,CZA治疗CRPA具有更低的死亡率和更高的细菌清除率[14]。但随着CZA应用,CZA耐药PA随之出现,国内外报道逐渐增多。Yin等[15]报道34.3% CRPA对CZA耐药,Frieder等[16]报道50.9% XDR的PA对CZA耐药,Zhu等[17]报道49.7% 携带blaKPC基因的CRPA对CZA耐药。本次研究的22株CRPA中,CZA耐药率最低,仅为22.7%,且后续检测菌株均未携带blaKPC基因,这可能与研究地域有关,此外样本量不足也是本院CRPA菌株体外实验对CZA耐药率低的原因之一,需要我们后续加大菌株数量进一步证实。CZA耐药PA的出现进一步增加临床选择抗菌药物治疗CRPA的难度。本研究中,仅有CZA、庆大霉素和阿米卡星耐药率低于30%,其他抗菌药物耐药率均超过50%,但由于氨基糖苷类药物静脉给药时在肺泡浓度较低,一般不作为单药治疗。粘菌素也常常用于治疗CRPA引起的感染,但由于粘菌素肾毒性较大同时存在异质性耐药。这些均体现了院内感染CRPA耐药的严重形势。基于此,我们建议本院临床可将CZA可作为治疗CRPA感染经验用药,为临床提供新的治疗思路。另外,本组实验结果显示,本院CRPA主要分离自呼吸道标本,由于呼吸道标本来源细菌难以区分感染或定植,因而为了结果接近临床,实验室人员宜对呼吸道标本进行涂片镜检质量评估,合格呼吸道标本来源CRPA为感染可能性较大,临床医生对此类呼吸道标本来源CRPA需综合评估其属致病菌可能性,避免抗菌药物不合理使用。

本全基因组测序的结果显示,在5株碳青霉烯酶筛查阳性的CRPA中,4株产金属β-内酰胺酶IMP-45及丝氨酸酶OXA-1,OXA-50,1株产金属β-内酰胺酶NDM-1,这与胶体金免疫层析法检测结果及mCIM结果一致,体现了现有胶体金试剂盒可以作为临床快速精准判断的一种手段。此外,OXA属于D类碳青霉烯酶,有不同的β-内酰胺酶类抗生素水解谱,大多数属于窄谱β-内酰胺酶[30]。有研究指出OXA可能对β-内酰胺酶的内在敏感性水平有影响,尽管在耐药性仍需要进一步阐明[31]。OXA-50是唯一存在于PA中的D类碳青霉烯酶,滥用β-内酰胺酶会造成OXA-50变体的出现,这会改进的亚胺培南的水解光谱[32]。因此,突变体的出现会导致逃逸现象的产生,进而造成更多耐药菌株的的出现。CRPA具有非常多样化的适应性特征和毒性机制,感染过程的第一步是PA与上皮宿主细胞结合,与宿主细胞接触后,III型分泌系统被激活,将分泌的毒素(ExoS、ExoY、ExoT和ExoU)直接注入宿主的细胞质,在这种细菌的入侵和传播期间,这些效应蛋白在不同程度上参与细胞毒性[33-34]。全基因组测序的5株菌株均含有与毒力相关ExoS、ExoT和ExoY基因。研究表明,ExoS编码一种具有GTP酶激活蛋白活性的细胞毒素和腺苷二磷酸核糖基转移酶活性[35]。ExoY是一种腺酰环化酶,其作用破坏肌动蛋白细胞骨架,抑制宿主细胞的细菌吸收,并增加内皮渗透性;然而,ExoY在感染中的重要性仍不清楚[36]。ExoT是PA临床和环境菌株基因组中最普遍的效应剂[37]。毒力基因的存在和缺失的变异可能也是耐药机制中最为明显的效应蛋白。但由于本次实验菌株量有限,所以不能确定碳青霉烯类抗生素耐药与毒力基因的存在之间是否有直接关系。另外,全球流行的高毒力铜绿假单胞菌克隆株ST型主要为ST111、ST175、ST235[38-39],广东地区主要流行ST244、ST274、ST1971和ST313等[8]。本组实验结果显示5株产金属β-内酰胺酶的CRPA的ST型为ST549型(4株)和ST245型(1株),并未出现上述高毒力克隆株。国内学者从慢阻肺患者体内分离出ST549[40],国外学者在墨西哥一家医院也分离出了ST549[32]。此外,国外一项关于50个多重耐药革兰氏阴性菌分离株抗菌药物耐药基因的研究发现了1株ST245型PA[41],2019年巴西也首次发现了ST245[42]。
综上所述,本院CRPA对头孢他啶/阿维巴坦耐药率低,产碳青霉烯酶不是CRPA对碳青霉烯类耐药主要机制,而产金属β-内酰胺酶可能是CRPA对头孢他啶/阿维巴坦耐药主要机制。但本研究仍存在一定的不足之处,1.收集的CRPA菌株量较少、未对菌株进行粘菌素药敏检测,CRPA耐药数据不够详细;2.本组实验只对5株碳青霉烯酶初筛阳性菌株进行全基因组测序分析其碳青霉烯酶耐药基因和ST分型,日后应对不产碳青霉烯酶CRPA进行碳青霉烯类耐药机制分析及分子流行病学分析,协助临床更好防治CRPA感染。

