p16INK4a 联合人乳头瘤病毒及液基细胞学检查在宫颈上皮内瘤变临床诊断中的应用
肖 雪 王宇琦 景 尉 钟绍涛 赵翠柳 刘 丹 谭荣韶 赖晓岚
1 暨南大学附属广州红十字会医院 广东广州 510220; 2 广州市越秀区妇幼保健院 广东广州 510060
宫颈癌对女性健康构成严重威胁,其在全球女性肿瘤中的发病率(6.6%)和死亡率(7.5%)均排名第四[1]。近年来,我国的宫颈癌新发病例和死亡病例呈现上升趋势[2-3],这使得宫颈癌的防控工作变得至关重要。由于宫颈癌具备可预防和可控制的特性,对其癌前病变的筛查尤为重要,尤其是针对宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)的早期筛查,已成为防控工作的关键环节。在过去的30年里,广泛开展的筛查活动使得美国宫颈癌发病率降低了至少50%,死亡率也随之下降。欧美指南[4-6]和中国优生科学协会阴道镜和宫颈病理学分会(CSCCP)[7]推荐采用高危型人乳头瘤病毒核酸检测(hrHPV)和宫颈细胞学联合筛查方法。此外,美国病理学家学会和美国宫颈和阴道镜病理协会联合发布指南,推荐使用细胞周期素依赖性激酶-4抑制蛋白(p16INK4a)检测来筛查宫颈癌癌前病变[8]。然而,这些筛查方法各自存在一定的局限性。液基细胞学测试优点在于其对早期宫颈病变的识别能力,但其准确性受到病理学家经验和专业技能的影响,且可能出现假阴性和假阳性结果。hrHPV测试具有较高的敏感性,能够检测到大部分宫颈癌的病原,但其特异性相对较低,可能会引起一些不必要的医学干预,如过度的活检和治疗。p16INK4a检测则被视为CIN2+病变的一个重要标志,其优点在于对高级别宫颈病变的高敏感性,但阴性结果不能排除CIN2+的存在,仍需结合其他测试结果综合判断。因此,有必要对这些筛查方法单独和联合应用的诊断效能进行评估,以便选择最佳、适合我国国情的临床筛查方法,从而提高临床诊断价值。
为探究p16INK4a、液基细胞学检测和hrHPV三者在宫颈癌前病变筛查中的应用价值,本研究对139例同时接受了p16INK4a免疫细胞化学双染色、液基细胞学(LCT)和高危型人乳头瘤病毒核酸检测(hrHPV)的妇女进行了分析,目的是比较这三种方法在筛查宫颈上皮内瘤变(CIN)方面的效能。通过对这些数据的研究,我们期望为建立适合中国国情的筛查技术和策略提供依据,从而能够及时采取干预措施,降低宫颈癌的发病率和死亡率。
1 对象与方法
1.1 调查对象
在本研究中,我们选择了2019年1月—2020年6月期间在本院妇科住院接受检查且具有性生活史的妇女作为研究对象。我们排除了有妊娠、宫颈锥切术、子宫切除术、骨盆放射治疗史、自身免疫疾病及正在接受免疫抑制治疗的妇女。研究共纳入139例妇女,其中组织病理学确诊为不同等级CIN的有111例,宫颈炎性疾病的有28例。研究对象的平均年龄为39.26±8.13岁。
1.2 标本采集
首先常规暴露宫颈,使用消毒棉拭子去除宫颈口的多余分泌物。然后,将一次性采样器插入受检者的子宫颈管内约1厘米深度,保持适当压力并旋转3圈,停留10秒钟,以采集宫颈脱落细胞。随后,将采集到的细胞置于专用保存液中,用于液基细胞制片和HPV核酸检测。
1.3 试剂及仪器
LCT及P16INK4a检测采用广州江元医疗科技有限公司JY-6000全自动液基细胞制片染色系统(沉降式)和P16抗体检测试剂盒(免疫细胞化学法),生物微流控芯片法检测HPV核酸检测试剂及自动化核酸检测仪由北京博晖创新生物技术有限公司提供。
1.4 检测方法
利用全自动JY-6000液基细胞制片染色系统进行液态细胞学(LCT)检测,制备液基薄层细胞样本。接着,资深病理科医生根据伯塞斯达系统(TBS)宫颈细胞学分类法进行阅片,最后得出诊断结果[9-10]。p16INK4a免疫细胞化学法的液基薄层细胞制备方法与LCT相同,按照说明书进行染色,胞核/胞质呈现棕黄色表示阳性,无色或不显色表示阴性。HPV核酸检测采用生物微流控芯片方法。首先,根据试剂盒说明书对样本进行预处理,然后将样本加入生物微流控芯片中。在芯片内,按顺序完成核酸提取、PCR扩增和反向斑点杂交等步骤。最后,通过CCD自动扫描分析实验结果。该方法可以同时检测和区分18种高危型HPV(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82和83型)及6种低危型HPV(6、11、42、43、44和81型)。
1.5 方法学评价及质量控制
p16INK4a免疫细胞化学染色检测及LCT检查均由两名固定的资深病理医师共同阅片诊断。生物微流控芯片通过空白质控点、阴性质控点及内参质控点进行质量控制,可排除由于磁珠提取和PCR反应失败导致的假阴性结果,同时通过显色质控点保证杂交体系有效。
1.6 统计学方法
使用SPSS 23.0统计软件进行数据分析。以百分比(%)表示计数资料,并使用χ2检验进行组间比较。P值小于0.05表示统计学上具有显著性差异。以组织病理诊断作为金标准,研究p16INK4a、LCT和HPV核酸检测单独或联合应用时,筛查CIN的灵敏度和特异性。使用MedCalc软件(v20.1.0)绘制受试者工作特征曲线(ROC),并计算AUC值。
2 结果
2.1 p16INK4a、LCT及hrHPV检测对宫颈病变检出情况
本研究纳入139位妇女,其中CIN 1患者12例、CIN 2患者95例,CIN 3患者4例,宫颈炎性疾病患者28例。以组织病理诊断为金标准,分析p16INK4a、LCT及HPV核酸检测单独及联合应用时筛查CIN的灵敏度和特异性。单独应用时,HPV核酸检测检出CIN的灵敏度最高(94.59%),但特异性最低(17.86%);p16INK4a的灵敏度和特异度均高于LCT;p16INK4a的阳性预测值(98.08%)和阴性预测值(74.29%)均为三者中最高(表1)。将此三种方法两两比较,p16INK4a与的对CIN检出率优于LCT及HPV(P<0.05),而LCT与HPV则无差异(表2)。

表1 p16NK4a 、LCT及HPV对宫颈病变检出情况 (%)

表2 p16NK4a 、LCT及HPV的ROC曲线比较
2.2 联合检测对宫颈病变的检出情况
在联合筛查中,只要有一个检测方法呈阳性结果,就被认定为阳性;若所有检测方法均显示阴性,则被认定为阴性。将三种检测方法分别两两组合时,p16INK4a+hrHPV组合的灵敏度(97.30%),特异性(92.86%)最高,阳性预测值(98.18%)和阴性预测值(89.66%)均高于其他的组合方式。此外,当三种方法联合应用时,灵敏度(99.10%)、特异性(92.86%)、阳性预测值(98.21%)和阴性预测值(96.30%)是所有组合中最高的(表3)。三种方法联合应用的诊断效率明显高于其他组合方式;不同两两组合方式间没有差异(表4)。

表3 联合应用对宫颈病变检出情况 (%)

表4 四种联合应用模型检出率的区别
2.3 三种方法筛查CIN病变的效能
单独检测时,p16INK4a、HPV和LCT检出CIN及以上病变的曲线下面积(AUC)分别为0.75、0.56和0.66,其中p16INK4a筛查效能最高(图1)。而p16INK4a+LCT、p16INK4a+hrHPV、LCT+hrHPV和p16INK4a+hrHPV+LCT的AUC分别为0.91、0.95、0.92和0.96。三种方法联合应用时筛查效能明显高于单独或两两联合检测(图2)。
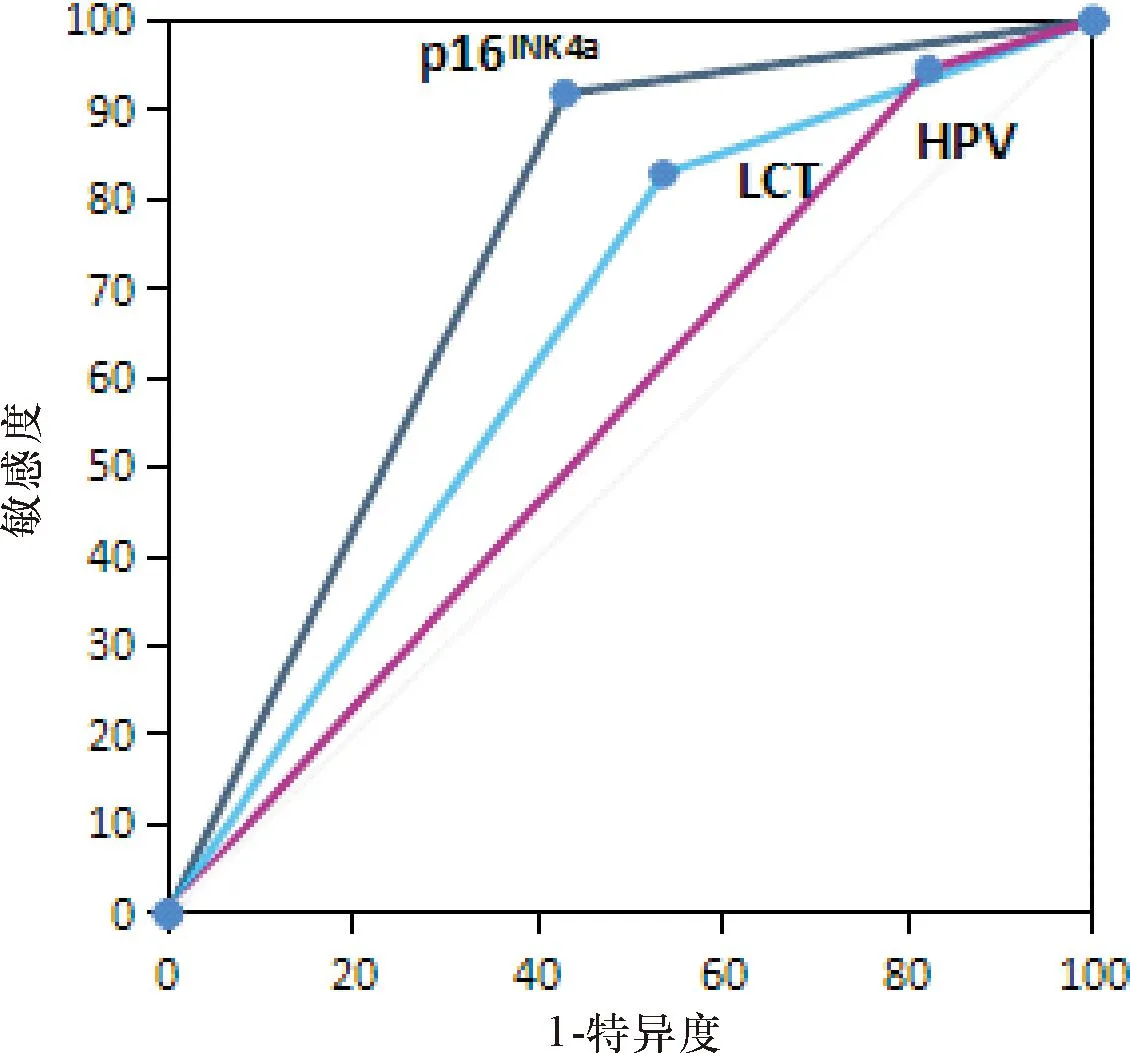
图1 三种方法单独检测CIN病变的ROC曲线

图2 三种方法联合应用检测CIN病变的ROC曲线注:A. LCT+hrHPV; B. p16INK4a+LCT; C. p16INK4a+hrHPV; D. p16INK4a+hrHPV+LCT
3 讨论
宫颈癌筛查的主要目标是发现癌前病变,尽早进行治疗。近年来,临床应用高危型HPV检测提高了筛查的灵敏度和质量。根据SWEDESCREEN(瑞典)[11]、COMPASS(澳大利亚)[12]和FOCAL(加拿大)[13]和北欧[14]的分析结果,基于HPV的筛查与巴氏细胞学相比,筛查间隔可延长至5年以上[15]。然而,由于80%的性活跃女性可能曾经感染过HPV,这些感染与宫颈癌的发病关系并不密切。在这项研究中,虽然HPV检测敏感度较高,但特异度仅为17.86%, AUC仅为0.56。因此,HPV DNA检测可以用于CIN的初筛,在筛查分流之后需要其它方法予以补充。
ASCCP和CSCCP推荐30~65岁女性采用hrHPV联合细胞学检查进行筛查[6-7]。传统的宫颈细胞学筛查存在敏感性和特异性较低的问题,现阶段更为准确的LCT和TCT方法已逐渐取代了较为传统的巴氏涂片法[16]。在应用液基薄层制片技术后降低了因制片操作不当而造成的误差,提高了检测准确率。然而,液基薄层制片方法往往需要技术和专业知识丰富的检验者,但仍可能受到其他因素的干扰,导致结果的误判[17-18]。在这项研究中,LCT检测灵敏度较低,但与hrHPV联合应用后,检测灵敏度和特异度均得到了提高。因此hrHPV联合细胞学检查可以作为一种有效的宫颈癌筛查手段,可以帮助降低筛查成本并增加准确率。
为了提高宫颈癌筛查的准确性,研究人员不断探索新的宫颈癌标志物。p16INK4a是一种细胞周期调节蛋白,能够组织视网膜母细胞瘤蛋白(RB)磷酸化,阻止细胞从G期进入S期,从而对有丝分裂进行负调节[19]。当机体持续感染hrHPV时,HPV的DNA存在整合到宿主基因中的可能性,最后产生致癌蛋白E7。E7蛋白可以与宿主细胞中的RB蛋白结合,使得转录因子E2F游离,促进细胞增殖基因的转录翻译及改变细胞周期。同时,HPV感染也可能造成RB-E2F复合物形成不足,导致p16INK4a过度表达[19-20]。由于正常的宫颈上皮细胞几乎不表达p16INK4a,因此p16INK4a过度表达可能提示宫颈鳞状上皮病变[21]。因此,p16INK4a是一种新的宫颈癌标志物,可作为一种辅助手段帮助诊断宫颈鳞状上皮病变,提高筛查的准确性[22]。我们的研究也证明p16INK4a免疫细胞化学染色法检测CIN等宫颈病变灵敏度较高,其特异度也明显高于LCT和HPV检测。此外,将p16INK4a分别和LCT或HPV组合均能获得不错的筛查效能(AUC:0.91/0.95)。
本研究发现,三种方法联合使用具有最佳的宫颈鳞状上皮内瘤变(CIN)诊断效能,但在临床成本和患者负担方面较高。相较之下,使用“p16INK4a+hrHPV”方法与使用“p16INK4a+hrHPV+LCT”的方法在检出能力上相差无几,且均优于“p16INK4a+LCT”和“LCT+hrHPV”组合。“p16INK4a+hrHPV”筛查策略在灵敏度和漏诊率方面都优于其他的组合,这有可能使其成为一种理想的临床筛查工具,可以提高宫颈癌的早期诊断和治疗。已有的研究表明,hrHPV筛查可以将筛查间隔延长至5年。因此,“p16INK4a+hrHPV”策略在理论上可以提供更长的筛查间隔,进一步降低患者的负担。
选择临床最适合的筛查策略应综合考虑多种因素,包括筛查的准确性、成本效益比、患者接受程度、以及筛查程序对患者生活质量的影响等。根据本研究的结果,我们提出一种筛查分流策略。首先是完成LCT的初步筛查。随后对于液基细胞学筛查结果异常的女性,接下来应进行hrHPV测试。对于hrHPV阳性的女性,可以进行p16INK4a测试。如果p16INK4a测试阳性,这可能表示患者有宫颈癌前病变,应该进行进一步的活检确认。如果活检结果证实了癌前病变或癌症,可以进一步考虑适当的治疗策略,例如手术、放疗或化疗。这种策略结合了LCT,hrHPV和p16INK4a测试,以提高宫颈癌筛查的敏感性和特异性。然而,具体的策略可能因个体、地区和资源的不同而变化。例如,对于资源有限的地区,可能只进行hrHPV测试和/或LCT。对于高风险人群,可以直接进行p16INK4a和hrHPV的联合测试。最终的决策应考虑个体的风险因素,如年龄、性行为、HPV疫苗接种状态、以及之前的筛查和测试结果。本研究存在一定局限性。由于入组病例数不足,需要进一步扩大病例进行研究与验证。在推广任何筛查策略之前,都需要进行更深入和全面的研究。
综上所述,“p16INK4a+hrHPV”应用于宫颈上皮内瘤变的临床诊断,可以提高诊断的准确性和早期发现率,从而使得能更早进行干预或治疗。通过这种联合应用,可以更准确地鉴别出低级别和高级别的宫颈上皮内瘤变,为个性化的病患管理提供更多信息。

