国产枸橼酸托法替布片的药动学及生物等效性研究*
鲁萍,王杰,尹小丽,张顺芝,吴蔚
(1.中南大学湘雅医学院附属长沙医院、长沙市第一医院Ⅰ期临床研究中心,长沙 410011;2.湖南泰新医药科技有限公司,长沙 410000)
托法替布是一种Janus激酶(Janus kinase,JAK)抑制剂,在甲氨蝶呤治疗无明确疗效的中、重度活动性风湿关节炎病例中表现出显著的疗效[1-2],口服吸收迅速,生物利用度高,具有良好的安全性和耐受性[3],患者用药依从性好[4]。由Pfizer Manufacturing Deutschland GmbH开发的枸橼酸托法替布片于2012年经美国食品药品管理局(FDA)批准上市,为全球首个治疗类风湿关节炎的新型口服靶向JAK抑制剂。2017年该药获准在中国上市,目前无国产枸橼酸托法替布片批准上市。文献报道枸橼酸托法替布检测方法有高效液相色谱(high performance liquid chromatogra-phy,HPLC)法、液相色谱-串联质谱(liquid chromato-graphy-tandem mass spectrometry,LC-MS/MS)法[5-6]。笔者在本研究采用HPLC-MS/MS法对枸橼酸托法替布在人血浆中浓度进行精确测定,考察空腹和餐后给药条件时枸橼酸托法替布的药动学行为,分析比较受试制剂和参比制剂的生物等效性及安全性[7-13],为该药的注册提供参考依据。
1 材料与方法
1.1药品 枸橼酸托法替布片受试制剂[(简称T),湖南九典制药股份有限公司提供,规格:5 mg,批号:X200702,含量99.7%];[枸橼酸托法替布片参比制剂[(简称R,商品名:Xeljanz®),由Pfizer Manufacturing Deutschland GmbH生产,规格:5 mg,批号:AP4444];托法替布柠檬酸盐对照品(批号:2604-021A2,含量:97.5%);托法替布-d3柠檬酸盐对照品(批号:1534-033A3,含量:96.1%),均由TLC公司提供。
1.2仪器与试剂 API 5500型三重四极杆液质联用仪(AB Sciex 公司),电喷雾电离源(AB Sciex 公司)、Analys数据处理系统(Version1.6.3),ExionLC AD液相色谱仪(AB Sciex 公司),XPR2/A型电子天平(瑞士梅特勒-托利多仪器公司,感量:0.1mg),0.1%甲酸溶液,乙腈。
1.3受试者选择 该试验通过长沙市第一医院伦理委员会的伦理审查,并获得批件,批件号:20201102CSSY00501,临床试验登记号:CTR20202253,临床试验备案号:202000567-01,受试者均签署知情同意书。
入选标准:年龄18~55周岁,体质量:男性≥50 kg,女性≥45 kg,身体质量指数(body mass index,BMI):18.6~26.4 kg·(m2)-1,试验前充分了解该试验,且自愿签署知情同意书,遵守方案规定完成试验。
排除标准:生命体征、心电图、胸部X线片及各项检查异常者,患有神经、心血管、内分泌、泌尿、免疫、消化、呼吸等系统疾病者,过敏体质者,嗜烟嗜酒者,筛选前14 d内服用任何药物者,筛选前30 d内服用任何影响药物代谢的药物者,近3个月内献血或参加过临床试验者,妊娠或哺乳期者,近半年内有生育计划者等[8-10]。
1.4治疗方法与血样采集 入组受试者均进行2周期试验,每周期随机交叉服用T或R 1片,洗脱期7 d。
每周期受试者于服药前1 d进行入住检查,医生筛查判断合格后入住病房,给药前禁食>10 h,试验当日早晨口服试验药物(T或R)5 mg后,立即饮用温水240 mL(餐后组给药前30 min进食高脂餐,须30 min内进食完毕)。药动学(PK)采血点为:服药前(服药前1 h内)和服药后5、15、30、45 min及1、1.25、1.5、1.75、2、2.5、3、3.5(仅餐后组)、4、4.5(仅餐后组)、5(仅餐后组)、6、8、10、12和24 h(餐后空腹分别21份和18份血样,每份静脉血约4 mL)。血样采集后60 min内开始离心,4 ℃,1 600×g离心10 min,离心后取上清液,并于1 h内置于超低温冰箱(-60 ℃以下)中保存。
1.5血浆测定方法
1.5.1色谱条件 色谱柱:Waters Xselectable HSS T3(2.1 mm×100 mm,3.5 μm),柱温为35 ℃,流动相A:0.1%甲酸溶液;流动相B:乙腈,梯度洗脱:0—0.70 min,10%B;0.70—1.30 min,10%B→30%B;1.30—1.31 min,30%B→95%B;1.31—3.40 min,95% B;3.40—3.50 min,10% B。进样量:20 μL,流速0.4~0.6 mL·min-1。
1.5.2质谱条件 采用电喷雾离子源(electric sparay ion source,ESI),多反应监测,监测离子对:m/z313.1→149.1(托法替布),m/z316.1→152.1(内标托法替布-d3),离子源喷雾电压5 500 V,离子源温度550 ℃。
1.5.3血浆样品处理 移取血浆样品50 μL,加入内标溶液20 μL后加入乙腈200 μL,封板,涡旋3 min,离心条件:4 ℃,2 490×g离心10 min,移取上清液100 μL,加入超纯水200 μL,涡旋混匀。
1.6方法学考察与评价
1.6.1专属性 将空白血浆、加入标准品的血浆样本和服药后血浆样本进行分析,托法替布及其内标的离子通道及保留时间窗中,待测物和内标的保留时间约为2.25 min,未发现任何内源性物质干扰,专属性良好,色谱图见图1。
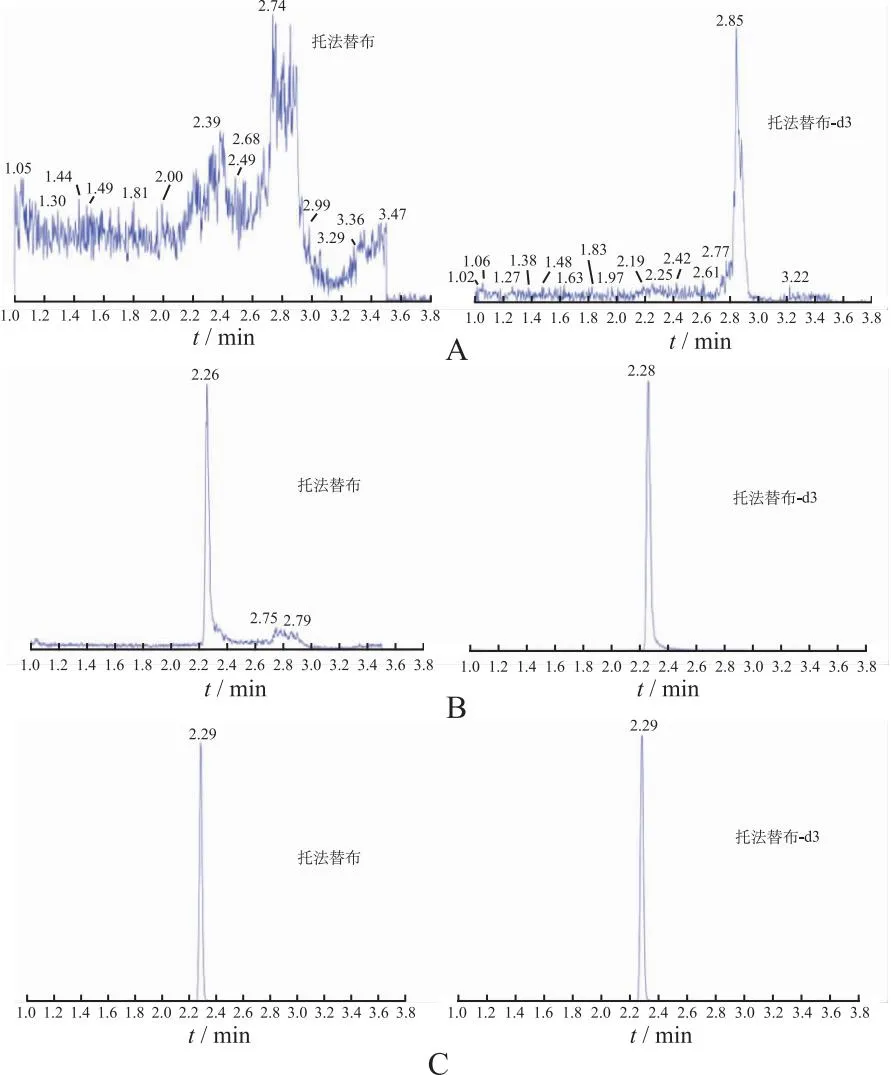
A:空白血浆;B:空白血浆+对照品;C:服药45 min后血浆。
1.6.2标准曲线与定量下限 分析标准曲线样本(托法替布浓度分别为0.5、1.0、5.0、10.0、25.0、50.0、80.0和100.0 ng·mL-1),以托法替布浓度为横坐标,以托法替布与内标峰面积比值为纵坐标,加权回归,权重因子1/x2,线性范围为0.5~100.0 ng·mL-1,标准曲线为Y=0.0451X+2.6×10-4(r2=0.999 6),定量下限为0.5 ng·mL-1。
1.6.3精密度与回收率 取托法替布浓度分别为0.5、1.5、15.0和75.0 ng·mL-1的质控样品,考察批内及批间精密度与准确度。各质控样品制备6份,分析批内的标准曲线,计算质控样品浓度,根据结果计算批内及批间精密度的RSD。配置托法替布浓度分别为1.5、15.0和75.0 ng·mL-1的质控浓度样本,各制备6份,连续测定3个批次,计算批内及批间精密度。比较3个浓度经提取与未经提取的待测物和内标的峰面积比值,计算回收率。结果见表1,结果显示批内批间精密度良好,满足生物样本检测要求。

表1 人血浆中托法替布的精密度和回收率
1.6.4基质效应 分别取不同批次6个空白血浆,预处理后分别加入与低、高浓度质控样本相当浓度的标准品和内标溶液进行分析。内标归一化基质因子均值分别为0.97和1.01,变异系数分别为2.6%和2.3%。
1.6.5稳定性实验 配制含托法替布的低、高2个浓度全血和血浆质控样本,各浓度平行制备6份,经预处理后进样分析,考察全血样本在冰浴,血浆样本在室温、-20 ℃和-70 ℃保存条件下及-70 ℃冻融循环的稳定性。结果表明托法替布全血样本冰浴放置2 h稳定,血浆样本室温放置22 h,-20 ℃放置4.5 d,-70 ℃放置65 d,-70 ℃冻融5次,均稳定,对照品储备液和工作液分别在室温放置17 h,-20 ℃放置55 d稳定,处理过的样品在自动进样器(2~8 ℃)下放置62 h再进样稳定。
1.7统计学方法 采用Phoenix WinNonlin 8.2版软件计算托法替布主要药动学参数(AUC、Cmax),并经对数转换后进行多因素方差分析,将tmax进行两配对样本的非参数Wilcoxon符号秩和检验法进行统计分析。
2 结果
2.1受试者入组及完成情况 空腹组入组36例,男28例,女8例,完成试验35例。年龄(24.81±5.75)岁,身高(167.00±7.41) cm,体质量(60.39±7.89) kg,BMI(21.62±2.04) kg·(m2)-1。餐后组入组36例,男24例、女12例,均完成试验。年龄(28.86±8.45)岁,身高(163.32±8.29) cm,体质量(58.28±7.96) kg,BMI(21.83±2.18) kg·(m2)-1。
2.2血药浓度-时间曲线 受试者单次服用枸橼酸托法替布片T与R后的平均血药浓度-时间曲线见图2,图3。结果显示两组血药浓度-时间曲线的变化趋势基本一致。
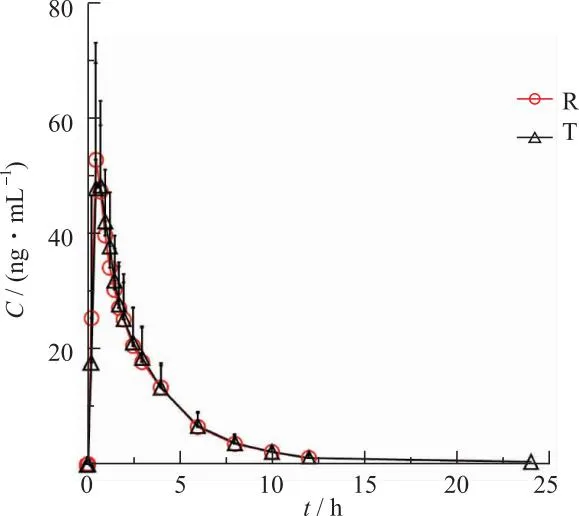
图2 空腹组枸橼酸托法替布片T与R平均血药浓度-时间曲线
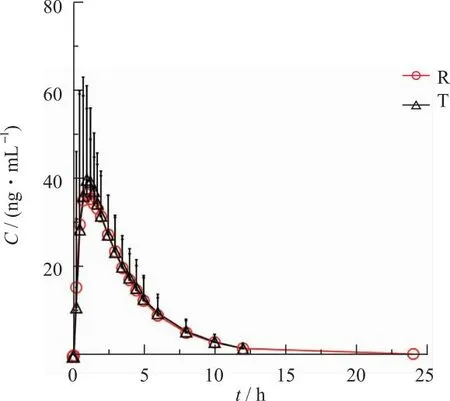
图3 餐后组枸橼酸托法替布片T与R平均血药浓度-时间曲线
2.3药动学参数 空腹和餐后分别有35例和36例受试者纳入PK浓度集、PK参数集和BE分析集。受试者单次服用T和R后,血浆中托法替布的tmax、Cmax、AUC0-t、AUC0-∞、t1/2见表2。

表2 空腹和餐后组服用枸橼酸托法替布片T和R后的主要药动学参数
2.4生物等效性评价 两制剂的Cmax、AUC0-t、AUC0-∞几何均值比及90%置信区间,空腹组为96.35%(90.11%~103.03%)、101.02%(98.76%~103.34%)、100.77%(98.53%~103.06%);餐后组为105.91%(95.20%~117.83%)、102.23%(99.67%~104.86%)、102.40%(99.81%~105.06%),均在80.00%~125.00%内,表明在空腹及餐后条件下两种枸橼酸托法替布片均具有生物等效性。
2.5安全性评价 空腹和餐后组各纳入安全数据集的36例受试者,空腹组9例(25.0%)发生15例次不良事件,表现为尿白细胞阳性5例次,尿潜血阳性、尿胆红素升高、血尿酸升高、直接胆红素升高各2例次,尿蛋白检出和血压升高各1例次,其中8例(22.2%)14例次不良事件,与说明书记载引起泌尿系统感染和肝酶升高的不良反应一致,判定为药物不良反应。餐后组10例受试者(27.8%)发生26例次不良事件,表现为尿白细胞阳性5例次,尿潜血阳性、尿红细胞阳性各4例次,尿胆红素升高、三酰甘油升高各2例次,血胆红素升高、腹泻、呕吐等各1例次,所有10例(27.8%)26例次不良事件,与说明书中引起泌尿系统感染、血脂升高和肝酶升高等不良反应一致,判定为药品不良反应。本研究不良事件及不良反应发生率均低于30%,且均为轻度,未发生非预期不良反应,表明2种制剂的耐受性和安全性良好[10]。
3 讨论
本研究参考《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》[14]《普通口服固体制剂参比制剂选择和确定指导原则》[15],以Pfizer Manufacturing Deutschland GmbH的枸橼酸托法替布片(Xeljanz®)作为参比制剂[16],考察湖南九典制药股份有限公司生产的枸橼酸托法替布片(规格:5 mg)在健康受试者中空腹及餐后条件下的药动学特征。
空腹和餐后组分别在服药后0.5和1 h内迅速达到血浆药物浓度峰值,表明食物会延缓药物的吸收速度,与其他文献报道均一致[7-11]。餐后组比空腹组AUC均增加约15%,但Cmax、t1/2无明显差异,与其他文献报道略有差异[7-11],考虑与受试制剂的处方工艺、临床前药学研究特性、受试者样本量、采血点设计、个体差异及高脂餐配方等有关,还有待进一步研究。空腹和餐后组Cmax、AUC0-t、AUC0-∞的个体内变异(CV)分别为16.66%和27.24%,5.60%和6.37%,5.55%和6.44%,均低于30%,不属于高变异类药物,餐后Cmax个体内变异(CV)为27.54%,低于文献报道的34.83%[10],考虑药物的BCS分类、高脂餐配方、受试者人口学特征差异等因素有关,故餐后是否属于高变异药物,还待更多研究确证。
本研究的受试制剂国产枸橼酸托法替布片已顺利通过国家药品监督管理局核查并获得药品批准证明文件,该药顺利上市后,意味着与原研药的质量和疗效一致的国产药,将有望以更经济实惠的价格,逐步替代昂贵的原研药,更好地满足临床用药急需,从而减轻患者的医疗费用负担,节约国家医疗成本,也有助于提升国内医药行业高发展质量。

