44例氯吡格雷相关性血小板减少症的文献病例分析*
江璐,许梦帆,夏凡,朱建国,谢诚
(1.苏州大学附属第一医院药学部,苏州 215000;2.河南省信阳市中心医院药学部,信阳 465299)
氯吡格雷通过选择性地抑制二磷酸腺苷(adenosine diphosphate,ADP)与血小板受体的结合及继发的ADP介导的糖蛋白GPⅡb/IⅡa复合物的活化而发挥抗血小板效应,临床上多用于动脉粥样硬化血栓形成的防治,尤其是急性冠脉综合征[1-2],而出血是其最主要和最常见的不良反应。早期的CAPRIE研究和最新的上市后报告显示其出血事件的总体发生率分别为9.3%[3]和12.7%[4]。然而,在临床使用过程中发现其除了能抑制血小板功能外还可引起血小板减少[5],进而增加患者出血的发生风险,甚至可继发罕见的血栓性血小板减少性紫癜(thrombotic thrombo-cytopenic purpura,TTP)[6]。基于此,笔者在本研究中系统检索和收集有关氯吡格雷引起血小板减少的病例报道并对其发生情况和特点进行分析,以期为临床安全用药提供参考。
1 资料与方法
1.1资料来源 以“clopidogrel” “thrombocytopenia” “thrombopenia” “thrombotic thrombocytopenic purpura”为检索词检索PubMed和Embase数据库,以“氯吡格雷” “血小板” “减少”为检索词检索中国知网、万方和维普期刊数据库。检索时限均从建库至2022年11月。
1.2文献纳入与排除标准
1.2.1纳入标准 ①氯吡格雷致血小板减少症的病例报道,包括个案或群案;②病例描述相对完整,至少包括患者的性别、年龄、血小板减少的实验室检查结果;③中文和英文文献。
1.2.2排除标准 重复、综述以及基础研究性文献。
1.3研究方法 详细阅读纳入的病例报道,提取作者姓名和发表年限,患者性别、年龄和原患疾病,氯吡格雷的用法用量及合并用药,血小板减少的实验室检查结果、并发症、临床处置和转归等信息,并利用Excel 2020进行统计分析。
2 结果
2.1文献筛选 检索后共获得文献2 509篇,通过去重、阅读题名、摘要和全文后最终筛选出文献43篇,其中中文17篇,英文26篇,文献筛选流程见图1。
图1 文献筛选流程图
2.2患者基本特征 共纳入患者44例,其中男30例(68.2%),女14例(31.8%),年龄37~88岁[7-8],平均(65.0±11.4)岁,≥ 60岁30例(68.2%),见表1。氯吡格雷的使用人群主要是冠心病患者,有35例(79.5%),其次是脑血管疾病和外周动脉疾病患者,分别为5例(11.4%)和4例(9.1%)。27例描述有并发症,居前3位的分别是高血压、糖尿病和血脂异常,各有18例(66.7%)、10例(37.0%)和6例(22.2%)。
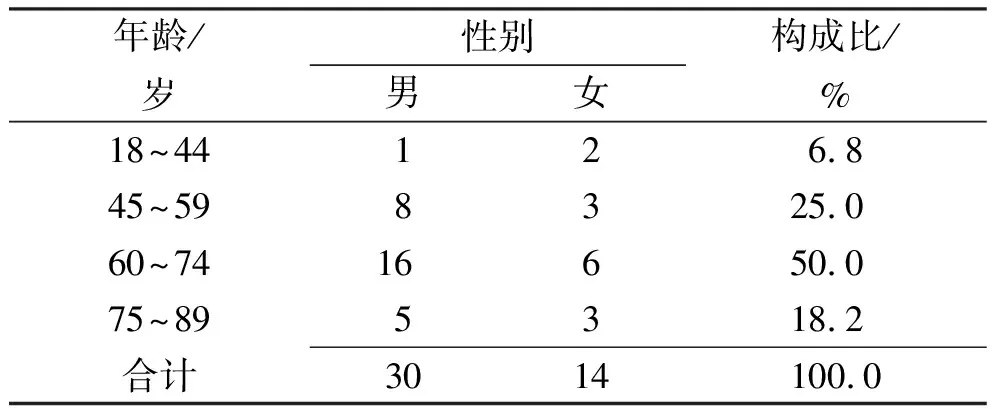
表1 患者的性别和年龄分布
2.3药物使用情况 34例描述氯吡格雷的用法用量,除1例[9]用法比较特殊外(根据P2Y12反应单位调整),其他均使用说明书或指南推荐的剂量,其中22例(64.7%)仅使用50~75 mg的维持剂量,11例(32.4%)还给予300~600 mg的负荷剂量。38例描述有合并用药,最多的1例达17种[10],平均(4.4±3.1)种,其中联合阿司匹林、肝素类药物和血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂(glycoprotein Ⅱb/Ⅲa receptor inhibitor,GPI)分别为31例(81.6%)、19例(50.0%)和9例(23.7%),其他药物还包括调脂、降压、降糖、利尿、护胃药等。
2.4血小板减少症的发生情况及并发症 42例描述首次出现血小板减少的时间,最短为用药后8 h[11],最长为用药后9个月[12],其中29例(69.0%)发生在用药后2周内,见表2。所有病例均描述了发生血小板减少症后其血小板计数的谷值,其中31例(70.5%)为重度血小板减少(<30×109·L-1),最低的1例降至0[13]。38例描述有并发症,其中24例(63.2%)表现为出血,主要包括皮肤出血16例(66.7%)和消化道出血7例(29.2%);有19例(50.0%)表现为TTP,主要包括微血管病性溶血性贫血18例(94.7%)、肾损害9例(47.4%)、神经精神异常7例(36.8%)和发热5例(26.3%)等。

表2 首次出现血小板减少的时间
2.5临床处置与转归 所有病例在评估可能为氯吡格雷相关性血小板减少症后均予以停药,其中35例描述了其他干预措施,主要包括予以糖皮质激素、输注血小板和(或)血浆及血浆置换,分别有22例(62.9%)、16例(45.7%)和16例(45.7%)。8例描述抗血小板治疗的替代方案,包括调整为替格瑞洛6例和西洛他唑及普拉格雷各1例。经上述处理后41例(93.2%)转归良好,血小板计数恢复正常用时最短为2 d[14],最长6个月[15],另有3例[6,13,16](6.8%)最终死亡。
3 讨论
早在2000年乌普萨兰监测中心数据库就发现氯吡格雷可引起血小板减少症等血液系统不良反应[17]。同期,氯吡格雷的一系列大型临床试验显示其致血小板减少症的发生率为0.26%~0.6%[3,18-19]。随后,国内外均有学者对氯吡格雷致血液系统不良反应的病例报道进行调研,但纳入的患者数均较少[20-22],且尚无专门针对其引起的血小板减少症进行文献病例分析。
《中国成人血小板减少症诊疗专家共识》指出,血小板生成减少、破坏或消耗过多以及分布异常是导致血小板减少的主要原因[23],但关于氯吡格雷引起血小板减少的机制尚不清楚。有学者认为目前已知的机制包括血栓性血小板减少和免疫相关性血小板减少[24],前者常表现为氯吡格雷诱导的TTP,因其血浆1型血小板结合蛋白基序的解聚蛋白样金属蛋白酶活性接近正常水平,故提示可能为非免疫介导的微血管内皮损伤所致[25],而后者可能是因氯吡格雷在体内与细胞表面的P2Y12分子结合成复合物从而刺激机体产生自身抗体[26]。
本文纳入的病例均为动脉粥样硬化性疾病患者,以老年、男性、合并高血压和(或)糖尿病居多,且多数患者联合使用了阿司匹林、肝素类和GPI等抗栓药物,而上述药物均有导致或增加血小板减少的风险[23]。有研究显示,高龄、血小板计数基础值低、肾功能肌酐值高、联合使用抗菌药物及替罗非班是急性冠脉综合征患者发生肝素诱导血小板减少症的独立危险因素[27]。另有Meta分析显示,老年、合并高血压、急诊行经皮冠状动脉介入治疗和肾小球滤过率降低是替罗非班致重度血小板减少或出血的独立危险因素[28]。然而,针对氯吡格雷引起血小板减少的易感因素分析笔者目前尚未见相关报道,故仍有待进一步研究。
药物介导的免疫相关性血小板减少症常伴有较高的出血风险,一般在药物暴露5~10 d后出现血小板减少,中位血小板计数常<20×109·L-1[29],而非免疫机制介导的药源性血小板减少症通常呈时间依赖性,在用药数周后逐渐出现[30]。本研究显示,氯吡格雷致血小板减少症的时间跨度较大,最短为用药后8 h,最长为9个月,但以2周内发生居多,多数患者表现为重度血小板减少,且伴有出血和TTP等并发症,考虑上述结果可能与氯吡格雷致血小板减少的两种作用机制均有关,提示临床在整个使用氯吡格雷期间均应注意监测血小板计数,尤其是用药初期,同时关注有无相关并发症,警惕肾损害和神经精神异常等非出血表现。
一旦发生血小板减少症且判断可能为氯吡格雷引起时尽早停用并采取对症支持治疗,而不同机制导致的血小板减少症其处理措施可能有所不同。有研究显示,对于免疫相关性血小板减少的患者使用免疫球蛋白(0.4~1 g·kg-1·d-1,2~5 d)和糖皮质激素(泼尼松1~4 mg·kg-1·d-1或等价,4~6周)治疗通常可以取得良好的效果[23,31],但如果是严重的血小板减少并出血,则往往需要更大剂量的免疫球蛋白(2 g·kg-1·d-1)[32];而对于血栓性血小板减少的患者则首选血浆置换[33],且血浆置换的时间越早越好(3 d内)[34],在此基础上可根据患者病情考虑联合血浆输注和药物治疗。此外,对于仍需要双联抗血小板治疗的患者而言可以选择非噻吩吡啶类的替格瑞洛或西洛他唑等抗血小板药物,但仍需警惕替代药物亦可能引起或加重血小板减少症[35-37]。本研究纳入的病例经上述处理后绝大多数转归良好,其中有1例因未及时诊断为TTP没有采取血浆置换最终死亡。
综上所述,氯吡格雷相关性血小板减少症以重度血小板减少居多,且常伴发出血或TTP,但整体预后良好。临床在使用该药过程中需密切监测患者的血小板计数,尤其是用药后的2周内,一旦发现异常应及时停药并予以对症处理。

