昆布多糖的复合酶法提取工艺优化及其对α-葡萄糖苷酶的抑制活性
张 涵,殷 澳,张会佳,侯相竹,高 阳, ,徐多多,
(1.长春中医药大学人参科学研究院,吉林长春 130117;2.长春中医药大学药学院,吉林长春 130117)
昆布是海带科植物海带或翅藻科植物昆布(鹅掌菜)的干燥叶状体,可化痰软坚散结,有利水消肿之效,同时兼具食用药用双重价值[1]。随着海洋生物资源的不断开发,昆布作为重要的海洋产物,其生物活性价值引起了国内外学者的关注[2],我国对昆布的研究主要集中在昆布多糖(Laminarin)、褐藻胶、粗提碘等方面[3]。昆布多糖是昆布最主要活性成分之一[4],由D-吡喃葡萄糖通过β-1,3 糖苷键连接而成,具有三螺旋结构。多糖的组成及结构对其药理活性具有一定影响[5-6],如昆布多糖可以加速胆固醇的代谢和转化,同时还可促进胰岛素的分泌,起到降血糖降血脂的作用[7-8];低分子量的岩藻聚糖硫酸酯片段抗凝血效果良好,且硫酸化程度越高抗凝血活性越高[9],抗血栓活性也越明显[10];除此之外昆布多糖还具有抗氧化[11]、抗肿瘤[12]、抗病毒[13]、抗细菌[14]等药理活性,满足人们对保健和医药的需求[15]。
多糖的提取方法包括热水浸提法[16]、酸提取法[17]、超声浸提法[18]和酶法提取[19]等,或组成联合提取方法,如超声辅助酶法[20]、微波辅助酶法[21]、微波辅助酸液[22]等,辅助联合法可在一定程度上弥补单一提取方法的不足,更大程度提高多糖得率。现有的提取方法会存在一些局限,传统水提操作繁琐且得率较低[23],酸提取和超声提取易破坏多糖的结构[24];相比之下,酶提法成本较低、效率更高,可充分保留多糖的生理活性[25]。一是因为酶可与底物特异性结合,减少溶出阻力[26]。二是酶解法可将多糖分解成分子量较小的片段,增加多糖溶出率[27]。单一酶解与复合酶提取效果差别较大[28],因复合酶间具有协同作用[29],若仅是探究复合酶添加量对得率的影响而忽略复合酶间的相互作用,多糖得率则会明显降低。若仅考虑复合酶比例而忽略酶活性等影响易造成多糖活性差、得率低的结果[30]。纤维素酶和果胶酶可降解植物细胞壁,木瓜蛋白酶可将细胞膜上的蛋白质酶解消化[31],利于多糖溶出。综上,本文先选择纤维素酶、果胶酶和木瓜蛋白酶组成复合酶,通过正交试验确定其最佳配比,再选用响应面法以酶解时间、温度、液料比、pH 为影响因素优化提取工艺,并探究昆布多糖对α-葡萄糖苷酶的抑制作用,为昆布多糖的综合开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
昆布药材 安徽毫药干草国药股份有限公司,批号:1 902013;纤维素酶(50 U/mg)、果胶酶(500 U/mg)、木瓜蛋白酶(800 U/mg)、α-葡萄糖苷酶(100 U/3.8 mg)、阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)
上海源叶生物科技有限公司;岩藻糖 Toronto Research Chemicals;半乳糖醛酸(25 g)FLUKA 公司;BCA 蛋白浓度测定试剂盒(500 次)上海碧云天生物技术有限公司;明胶(99%)、氯化钡(99%)、硫酸钾(AR,99%)上海麦克林生化科技股份有限公司;无水碳酸钠、氢氧化钠、盐酸、柠檬酸、溴化钾、磷酸二氢钾、磷酸氢二钠 成都市科隆化学品有限公司。
UV745N 型紫外分光光度计 上海佑科仪器仪表有限公司;M200pro 型酶标仪 热电科技仪器有限公司;BSA224S-CW 型电子天平 赛多利斯科学仪器有限公司;SHY-2A 型数显水浴恒温振荡器 常州普天仪器制造有限公司。
1.2 实验方法
1.2.1 复合酶提取昆布多糖工艺流程 参考王歆彤等[32]的方法并稍作修改,先将昆布干燥粉碎过40 目筛,取5 g 昆布粉末于锥形瓶中加入一定体积纯水,通过柠檬酸-磷酸氢二钠缓冲盐溶液调节pH,添加最佳配比的复合酶(纤维素酶、果胶酶、木瓜蛋白酶)于一定温度下通过摇床水浴酶解一定时间,沸水灭酶15 min,4000 r/min 离心10 min 后取上清定容,苯酚硫酸法测定并计算多糖得率。提取液浓缩至原体积的1/5,在提取液中加95%乙醇直至乙醇浓度达80%,3000 r/min 离心5 min 取沉淀,冻干后可得昆布多糖粉末。
1.2.2 复合酶添加量配比优化
1.2.2.1 单因素实验 各单因素实验固定条件均为:昆布粉末5 g、液料比40:1(mL/g)、pH6.0、50 ℃、酶解2.5 h,按照1.2.1 方法,分别考察纤维素酶(90、100、110、120、130 mg)、果胶酶(70、80、90、100、110 mg)、木瓜蛋白酶(45、50、55、60、65 mg)对昆布多糖得率的影响。
1.2.2.2 对比复合酶与单酶的提取效果 研究纤维素酶、果胶酶、木瓜蛋白酶三种单酶的最适添加量及复合酶(1.2.2.1 中三种酶上述最适添加量相加总和)对昆布多糖得率的影响。
1.2.2.3 正交试验设计 在单因素实验的基础上,以纤维素酶(A)、果胶酶(B)和木瓜蛋白酶(C)添加量为自变量,以昆布多糖得率为因变量,进行三因素三水平正交试验,确定复合酶最佳配比,试验设计见表1。

表1 复合酶添加量正交试验Table 1 Orthogonal test of complex enzyme dosage
1.2.3 复合酶提取昆布多糖工艺参数优化
1.2.3.1 单因素实验 各单因素实验固定条件均为:昆布粉末5 g、添加最佳配比复合酶、酶解时间2 h、pH6、液料比40:1 mL/g、温度50 ℃,分别考察酶解时间(0.5、1、1.5、2、2.5、3 h)、液料比(10:1、20:1、30:1、40:1、50:1、60:1 mL/g)、pH(4、4.5、5、5.5、6、6.5)和温度(30、40、50、60、70 ℃)的影响。
1.2.3.2 Box-Behnken 响应面优化试验设计 在单因素实验基础上,选择时间(A)、pH(B)、液料比(C)和温度(D)作为Box-Behnken 响应面的4 个影响因素,进行四因素三水平的响应面优化试验,建立自变量与昆布多糖得率(Y)之间的函数关系,响应面试验设计见表2。

表2 复合酶提取工艺响应面试验因素与水平Table 2 Test factors and levels of response surface of complex enzyme extraction technology
1.2.4 昆布多糖得率计算
1.2.4.1 标曲的制作 参考温思萌等[33]的方法并稍作修改,选择以岩藻糖为标准品,准确称取岩藻糖标准品10 mg 溶于100 mL 容量瓶中配成标准品溶液,分别吸取0.2、0.4、0.6、0.8、1.0 mL,加水补足至1.0 mL,先后加入5%苯酚溶液1.0 mL 和浓硫酸5.0 mL,于484 nm 处通过紫外分光光度计测定吸光度。以吸光度值为纵坐标,岩藻糖浓度为横坐标,得到岩藻糖标准回归曲线y=6.8626x+0.0019,R2=0.9999。
1.2.4.2 多糖的测定及得率计算 将提取液测定的吸光度值代入岩藻糖的标准曲线,得昆布多糖得率(Y)计算公式:
式中:C:待测样液中多糖的质量浓度(mg/mL);V:待测样液的体积(mL);F:待测样液的稀释倍数;M:昆布粉末的质量(g)。
1.2.5 传统水提法与优化后复合酶提法的比较
1.2.5.1 昆布多糖的制备 复合酶提法:取5 g 昆布粉末,按照1.2.3.2 项下优化后的复合酶提取最佳工艺酶提昆布多糖,沸水灭酶15 min,4000 r/min 离心10 min 取上清,定容至300 mL,按照1.2.4 项下方法测定昆布多糖得率,重复三次实验取平均值。
传统水提法:取5 g 昆布粉末,固定实验条件(温度、pH、液料比和时间)与复合酶法最佳提取工艺相同的条件水提昆布多糖,4000 r/min 离心10 min 取上清,定容至300 mL,按照1.2.4 项下方法测定昆布多糖得率,重复三次实验取平均值。
1.2.5.2 昆布多糖理化性质测定 采用苯酚-硫酸法以岩藻糖为标准品测定中性糖含量[34];采用间羟基联苯法以半乳糖醛酸为标准品测定酸性糖含量[35];通过BCA 法以牛血清白蛋白为标准品测定蛋白质含量[36];采用明胶-氯化钡法以恒重硫酸钾为标准品测定岩藻糖硫酸酯含量[37]。
1.2.6 抑制α-葡萄糖苷酶活性实验 参考张艳秋等[38]方法并稍作修改。采用PBS 缓冲液(pH6.8)配制系列浓度的昆布多糖和阿卡波糖溶液(均为1~5 mg/mL)。各取40 μL 样液至96 孔板中,加入0.04 U/mL 的α-葡萄糖苷酶溶液40 μL 后于37 ℃孵育5 min,加入0.5 mmol/L 的PNPG 溶 液20 μL 后 于37 ℃孵 育30 min;加入0.1 mol/L 的碳酸钠溶液100 μL 终止反应。以40 μL PBS 缓冲液代替α-葡萄糖苷酶溶液重复上述实验作为背景对照组,以40 μL PBS 缓冲液为空白对照组。在405 nm 处测定各孔的光密度值(OD),重复三次取平均值,计算抑制率。
1.3 数据处理
选择IBM SPSS Statistics 25 和Design-Expert 13 软件进行统计分析,采用Origin 2021 绘图,通过GrapHPad prism 9 计算IC50值。
2 结果与分析
2.1 复合酶添加量配比优化
2.1.1 单因素实验结果 纤维素酶和果胶酶可消化植物细胞壁使其水解成葡萄糖,且不会影响细胞内部的纤维素骨架,充分保留多糖的结构和活性,木瓜蛋白酶可溶解糖蛋白中的蛋白质[39],故复合酶种类选择以上三种。各酶添加量对昆布多糖得率的影响见图1。三种单酶的多糖得率在所测浓度范围内都呈现先上升后下降的趋势,因为增加酶的添加量可使酶解反应更加完全,酶解出的多糖含量更多;继续增加酶的浓度,多余的酶会与底物竞争,导致一定量的酶会被消耗[40],多糖的得率下降。破坏昆布细胞壁是增加多糖溶出率的关键,因此纤维素酶和果胶酶提取的多糖得率略高,且效果差距较大。通过单因素实验结果确定各单酶最佳添加量:纤维素酶110 mg、果胶酶90 mg、木瓜蛋白酶55 mg。
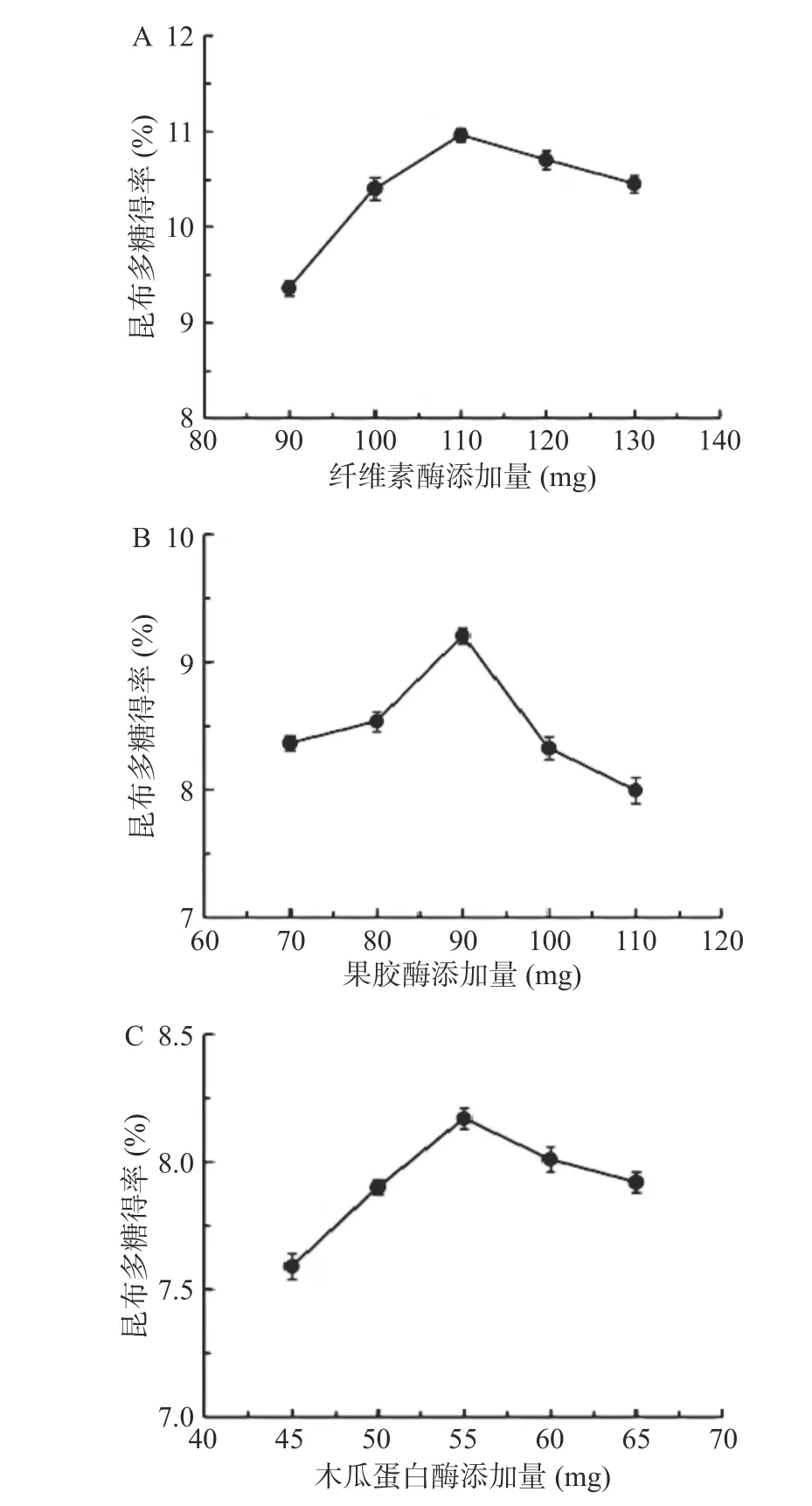
图1 三种单酶添加量对昆布多糖得率的影响Fig.1 Effect of three single enzyme supplemental levels on the yield of laminarin
2.1.2 复合酶与三种单酶提取的多糖得率 三种单酶与复合酶提取昆布多糖得率的对比如图2 所示,复合酶提取的昆布多糖得率都显著高于三种单酶(P<0.05),分别比纤维素酶、果胶酶、木瓜蛋白酶高出4.55%、6.46%、7.34%。故选择复合酶提取昆布多糖。

图2 三种单酶与复合酶提取昆布多糖的得率对比Fig.2 Yield of laminarin by three single enzymes and compound enzymes
2.1.3 复合酶添加量比例优化正交试验结果 正交试验周期短、次数少,因子选择区间固定在试验结果波动范围内,可以迅速找到各水平最佳组合,结果直观。正交试验结果见表3,方差分析结果见表4,由表4 可知,正交试验的P值<0.01,说明复合酶配比对多糖得率的影响极显著,且三种单酶产生的影响也均为极显著(P<0.01)。通过表3 的R 值得出果胶酶的影响效果最强,其次为木瓜蛋白酶,纤维素酶的影响效果最弱;根据k 值分析出最佳复合酶配比为A1B2C2,即复合酶最佳比例为纤维素酶100 mg、果胶酶90 mg、木瓜蛋白酶55 mg,下述的响应面优化探究最佳工艺时复合酶添加量即为最佳配比。
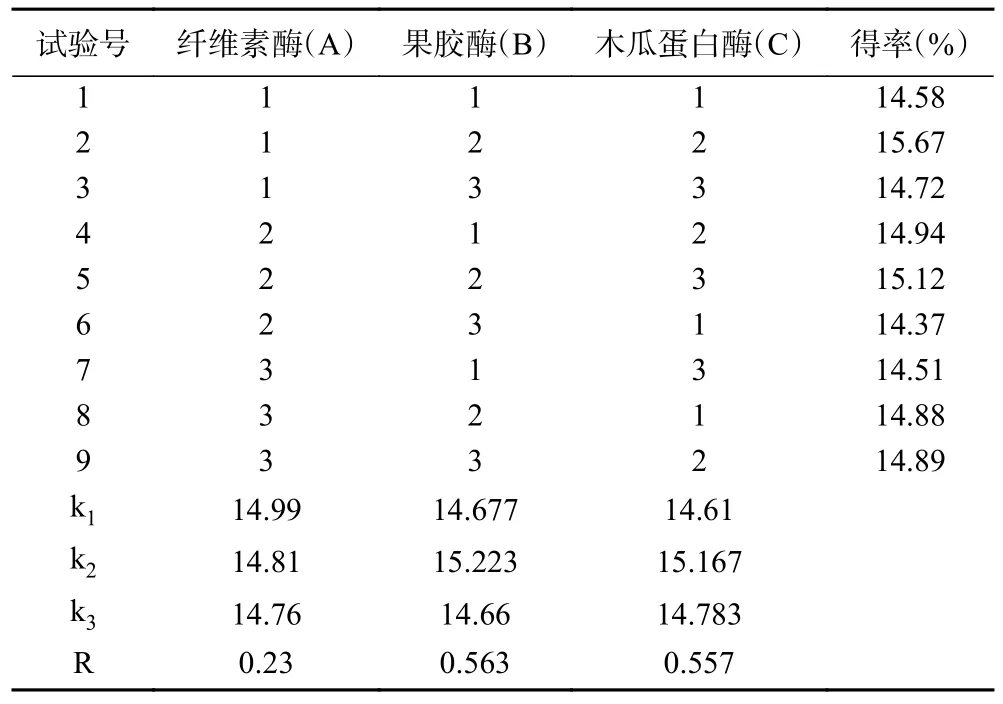
表3 正交试验设计与结果Table 3 Orthogonal experiment design and results

表4 正交试验的方差分析Table 4 Variance analysis of orthogonal experiments
2.2 复合酶法提取工艺优化
2.2.1 单因素实验结果 时间、液料比、pH 及温度对昆布多糖得率的影响见图3,除液料比外其余三个影响因素的昆布多糖得率在测定范围内均呈现先升后降趋势,液料比对昆布多糖得率的影响是在测定范围内先上升后保持稳定。如图3a 所示,昆布多糖得率在1.5 h 处达到最大值,继续增加酶解时间,多糖得率开始下降,因为酶解时间过长会破坏部分多糖的结构[41];多糖得率在10:1 到60:1 mL/g 范围内随液料比增加而先增加后保持不变(图3b),溶液体积增加,溶剂的扩散速率加快,多糖溶出量增加[42];溶液体积过多时细胞全部涨破,多糖溶出率不会再发生变化[43]。昆布多糖的得率在pH6、温度50 ℃时达到峰值(图3c 和图3d)。pH 和温度都是影响酶活性的关键因素,酶解反应不完全将导致多糖的得率变低,复合酶在弱酸性条件下有较好的酶解效果,三种酶各自有最适温度和pH,温度和pH 超过酶的活性范围则酶解反应不完全,将导致多糖的得率变低[44]。图3可得各影响因素的单因素选择结果:时间1.5 h、液料比50:1 mL/g、pH6、温度50 ℃。
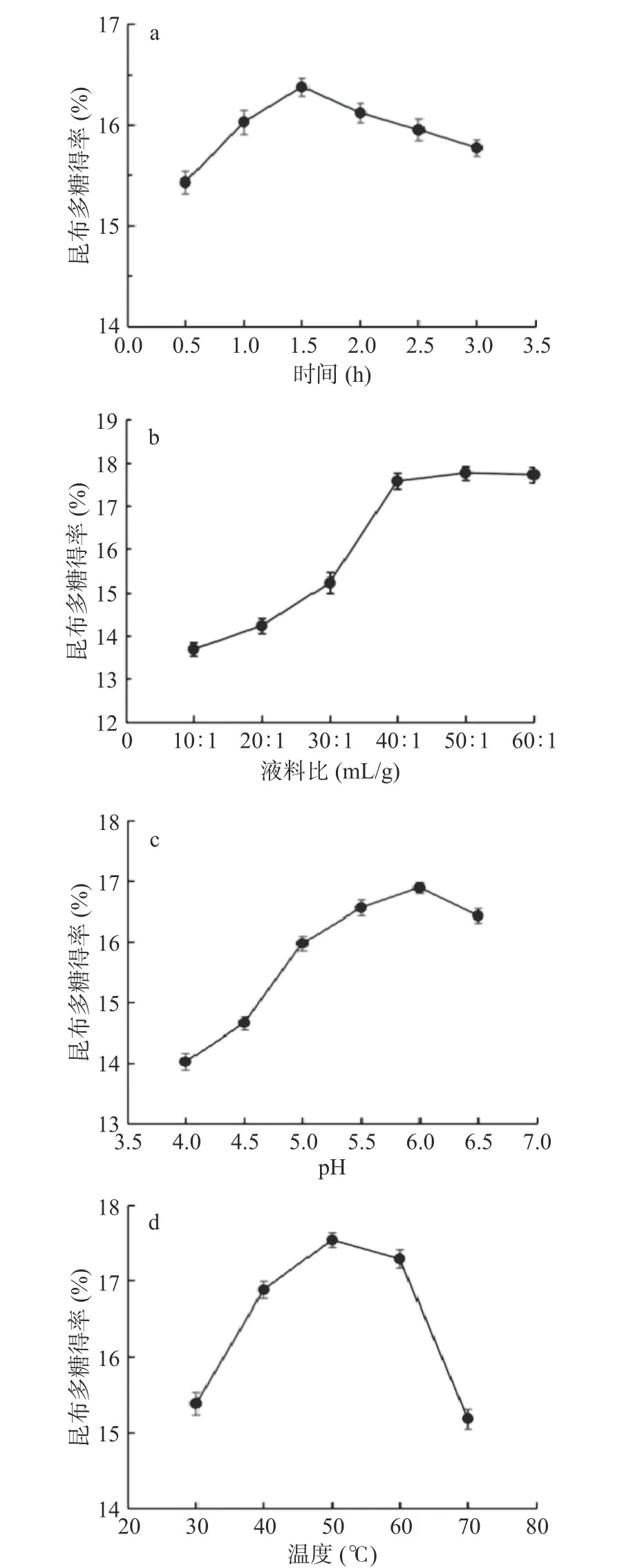
图3 四个考察因素对提取昆布多糖得率的影响Fig.3 Influence of four factors on the yield of laminarin
2.2.2 复合酶提取多糖工艺响应面优化结果 相较于正交试验的最优结果只能是某种组合,且在初步筛选时难以确定变化规律,而响应面试验灵活准确,可分步进行,若设定的目标或水平偏差较大可及时进行调整,得到的模型结果也可预测目标的变化及规律。响应面优化结果见表5,采用Design-Expert 8.0.6 软件进行二元多次回归拟合,得到回归方程:Y=18.00+0.1383A+0.1183B+0.2550C-0.1567D+0.3000 AB+0.1625AC-0.1275AD+0.0700BC+0.0100BD+0.0525CD-0.2706A2-0.5631B2-0.2306C2-1.24D2。

表5 响应面试验设计及结果Table 5 Response surface test design and results
回归模型方差及结果见表6,回归模型的P值<0.0001,该模型极显著;回归方程失拟项的P值>0.05,不显著,该模型可信度高;调整决定系数R2Adj为0.9776,即昆布多糖得率的变化规律有97.76%的概率可由该模型解释;变动系数CV=5.95%,模型与实际实验拟合性较好,该模型可用于预测昆布多糖提取工艺优化的试验。通过分差分析表可知,各因素对多糖得率的影响大小为:C>D>A>B;各因素两两间的相互作用AB、AC、AD 对多糖得率具有显著影响(P<0.05);各单因素以及单因素的平方对多糖得率的影响都具有极显著作用(P<0.01)。

表6 回归模型方差及结果Table 6 Variance and results of regression model
各因素对响应值的影响结果见图4,根据图4a可知时间较pH 等高线更呈椭圆形,时间对多糖得率的影响比较强烈,二者交互作用显著;由图4b 分析得出液料比较时间的等高线各曲线之间较密集,液料比对多糖得率的影响较明显;由图4c 观察出温度与时间的响应曲面坡度较陡峭,温度对多糖得率的影响较大;因此液料比对昆布多糖得率的影响最显著,其次分别是温度、时间、pH。由图可以得出,两因素间交互作用的影响从大到小排列:AB>AC>AD>BC>CD>BD,与方差分析结果一致。

图4 响应面等高线图与三维图Fig.4 The contour map and 3D map of response surface
2.2.3 工艺验证 根据方程得到复合酶提的优化工艺为酶解时间1.8 h、pH6.1、液料比59:1 mL/g、酶解温度49.4 ℃,预测多糖得率为18.183%。通过三次重复实验测定实际的昆布多糖得率为18.19%±1.04%,实测值与预测值接近,即响应面优化复合酶提取昆布多糖的工艺切实可靠。
2.3 复合酶法与传统水提昆布多糖的比较
5 g 昆布粉末通过复合酶提取得到冻干的多糖粉末1.4 g,提取的昆布多糖中的中性糖、酸性糖、硫酸根、蛋白质含量分别为52.72%、11.76%、19.49%、2.66%,多糖平均得率18.19%±1.04%。传统水提多糖得率5.28%±0.34%,复合酶法是其3.44 倍,魏碧娜[45]通过传统水提法得到的海带多糖得率2.5%,程仕伟等[46]采用水提法提取的海带多糖得率4.99%,高洁[47]归纳比较七种不同提取方法对海带多糖得率的影响,结果发现复合酶法提取的多糖得率是水提法的2.36 倍。水提的昆布多糖中的中性糖、酸性糖、硫酸根、蛋白质的含量分别为13.93%、1.82%、17.71%、5.03%,以活性成分含量为指标,传统水提法除蛋白质含量外均低于复合酶法提取的昆布多糖,即选择提取效果更好的复合酶法。
2.4 昆布多糖抑制α-葡萄糖苷酶活性结果
α-葡萄糖苷酶抑制剂是治疗糖尿病的常用药物,现有的降糖药售价高、不耐受,找到有效药物抑制剂则是重中之重[48],研究发现食用藻类对α-葡萄糖苷酶具有抑制作用[49]。昆布多糖抑制α-葡萄糖苷酶活性的实验结果见图5,昆布多糖在1~5 mg/mL 范围内对α-葡萄糖苷酶的抑制率随着浓度的增大而增大,最大抑制率为79.04%±3.17%。昆布多糖的IC50值为1.443 mg/mL,小于阿卡波糖的IC50值1.851 mg/mL。昆布多糖对α-葡萄糖苷酶具有抑制作用。

图5 昆布多糖抑制α-葡萄糖苷酶活性实验结果Fig.5 Experimental results of inhibiting α-glucosidase activity of laminarin
3 结论
本实验通过先正交试验再响应面优化得到了复合酶法提取昆布多糖的最佳工艺参数:取5 g 昆布粉末加入295 mL 纯水,通过缓冲液将pH 调至6.1,加入100 mg 纤维素酶、90 mg 果胶酶和55 mg 木瓜蛋白酶,摇床水浴加热至49.4 ℃酶解1.8 h,在此优化工艺下验证实验的多糖得率为18.19%±1.04%,与预测值18.183%接近,是传统水提多糖得率的3.44倍,测定的糖含量、硫酸酯基等活性物质也明显高于传统水提。复合酶法多糖得率高,效率快,可提取出低分子量的多糖增加药理活性。昆布多糖对α-葡萄糖苷酶具有明显抑制作用,在5 mg/mL 达到最大抑制率为79.04%±3.17%,因此具有潜在降糖功效,为昆布在食品和医药领域应用提供了参考。

