玉米麸皮阿拉伯木聚糖复合纳米载体负载香草醛及其抑菌性能研究
安 迪,蔡 翔,吕雯欣,陆雅琦,李 丹,马福敏
(长春大学农产品加工省高校重点实验室,吉林长春 130022)
香草醛,又名4-羟基-3-甲氧基苯甲醛,是一种天然有机化合物,具有多种生物活性,如抗氧化性、抗菌性、抗病毒性和抗炎性等,作为食品香精、保鲜剂、抗氧化剂等广泛应用于食品领域[1-2]。香草醛的分子结构中的酚羟基和醛基可与细菌相互作用,抑制细菌的生长,对食品腐败菌革兰氏阴性菌和革兰氏阳性菌均有活性,因此可作为一种食品防腐剂应用于食品加工与保藏[3]。然而,香草醛的稳定性和水溶性较差,使得香草醛的生物活性不能得到充分发挥,这极大地影响了香草醛的应用范围[4]。
纳米递送体系是采用纳米级载体包裹待递送的物质,以提高包裹活性物质的功能特性的混合体系。该体系具有控制释放速度、减少食品中营养成分损耗的缓释性优点,从而起到增强传递效率的作用。多糖或蛋白质常用来作为纳米载体,但单一多糖或蛋白质纳米载体的稳定性及生物相容性较低[5]。阿拉伯木聚糖(Arabinoxylan,AX)存在于多种粮食作物的种皮中,亲水性强,黏度大,且具有抗氧化和抗炎等多种生物活性,是蛋白质和多肽等生物活性物质理想的载体[6-7]。玉米醇溶蛋白(Zein)存在于玉米胚乳细胞,疏水性强,并具有良好的生物相容性[8-10],但因其水溶性差,且在高离子强度、高温等极端条件下易变性,限制了其应用范围[11-12]。AX 可与Zein 之间通过静电、疏水与氢键作用形成的复合物,增强纳米载体的稳定性。Dalmolin 等[4]通过将香草醛负载于聚乳酸纳米粒子中,提高了香草醛的稳定性。Li 等[5]将香草醛与壳聚糖交联制备可以递送药物的纳米体系,研究发现,此种纳米粒子可以精准递送和释放药物,且未来可作为抗癌药物载体使用。因此,负载香草醛的纳米载体具有广泛的应用前景。
本研究将纯化后的玉米麸皮AX 组分(F80-1、F80-2、F90-1 及F90-2)与Zein 复合,制备负载香草醛的纳米载体,研究其作为香草醛的运载体时的包埋效果及其对食品中常见的致病菌-单增李斯特菌和大肠杆菌的抑菌效果,为负载香草醛的复合纳米载体的稳定性和抗菌性提供理论依据。
1 材料与方法
1.1 材料与仪器
玉米麸皮粗多糖(20%~32%)实验室自制;玉米醇溶蛋白 国药集团化学试剂有限公司;香草醛麦克林公司;单糖标准品(木糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖、鼠李糖、阿洛糖,均为色谱纯)
德国Dr.Ehrenstorfer 公司;胰酪大豆胨液体培养基(Tryptic Soy Broth,TSB)、胰酪大豆胨琼脂培养基(Tryptic Soy Agar,TSA)青岛科技工业园海博生物技术有限公司;单增李斯特菌(BIO-52964)智立中特(武汉)生物科技有限公司;大肠杆菌O157:H7(CICC21530)吉林农业大学食品科学与工程学院赠与。
GC-14C 气相色谱仪 日本岛津公司;Spectra-Max M3 多功能酶标仪 美国Molecular Devices 公司;FDU-2100 冷冻干燥仪 日本日立公司;DSC Q2000 差示扫描量热仪 美国TA 公司;HiTrap capto(5 mL×3)离子交换柱 美国GE 公司;AKTA Purifier 型蛋白质纯化仪 美国GE 公司。
1.2 实验方法
1.2.1 AX 的分离纯化 将80%和90%醇沉后干燥的玉米麸皮粗多糖配成0.1 g/mL 的溶液,经阴离子交换柱HiTrap capto 分离纯化,用20 mmol/L 的Tris-HCl 缓冲液和含有0.5 mmol/L NaCl 的20 mmol/L Tris-HCl 缓冲液梯度洗脱,分别各得到两个组分多糖[11]。将不同组分的多糖分别收集,浓缩后冷冻干燥,得到四个组分,分别为F80-1、F80-2、F90-1 和F90-2。
1.2.2 单糖组成测定 参考闫光玲等[13]的方法,F80-1、F80-2、F90-1 及F90-2 组分的AX 水溶液(浓度为8 mg/mL),分别用4 mol/L 三氟乙酸(体积比1:1)在110 ℃下水解60 min,水解后样品中加入50%,w/v 的阿洛糖内标,经NaBH4还原(浓度为200 mg/mL)、乙酸酐酯化后,采用气相色谱法测定单糖组成。
进样条件:色谱柱:30 m SupelcoSP-2380 柱(内径0.25 mm,膜厚度0.2 µm);载气:氮气(N2);进样量:4.0 µL;进样温度:280 ℃;检测温度:280 ℃;程序升温:初始温度100 ℃,2 min;10 ℃/min 升至280 ℃,维持10 min;20 ℃/min 降至100 ℃,维持2 min。以阿洛糖为内标,采用内标法结合峰面积归一化法,采用N2000 色谱工作站对各单糖含量进行定量。
1.2.3 无菌纳米载体的制备 根据Yuan 等[14]的方法,采用反溶剂沉淀法制备纳米载体。称取Zein 和香草醛(质量比为10:1)溶于乙醇溶液(80%,V/V)中,以500 r/min 的速度搅拌8 h,得到橙黄色澄清溶液,于4 ℃条件下保存备用。
称取F80-1、F80-2、F90-1 及F90-2 溶于无菌水(浓度为5 mg/mL),500 r/min 常温下搅拌过夜,在无菌环境下用注射器将制备好的Zein 复合香草醛溶液以4:3(m/V)、1:3(V/V)的比例缓慢滴入pH4.0 的多糖溶液中,得到负载香草醛的Zein-AX 分散液。在40 ℃,-1 MPa 条件下,蒸发掉乙醇,2800 r/min 离心10 min,去除未包封的香草醛。
1.2.4 纳米载体包封率的测定 将新制备的纳米复合载体2800 r/min 下离心10 min,以除去未包封的香草醛沉淀。将收集到的香草醛沉淀溶于2 mL无水乙醇中,经0.22 µm 有机膜过滤后,用酶标仪在320 nm 处测量吸光度。
参照相同条件下制备的香草醛标准曲线方程为y=0.0146x-0.0089(R2=0.9955),代入方程可得到香草醛浓度。包封率计算公式如下:
1.2.5 荧光光谱法测定分子间作用 参照Li 等[15]的方法,并进行适当改进。F80-1、F80-2、F90-1 和F90-2 与Zein 制备的复合纳米载体经适当稀释后,荧光光谱激发波长设置为280 nm,狭缝宽度为5 nm,扫描波长范围为300~370 nm,以水为空白,Zein 包埋香草醛制成的纳米载体作为对照,用去离子水将测量的样品稀释到适当的浓度,每个样品重复测定三次,绘制荧光光谱图。
对于SCV温度串级控制系统,根据前述分析,其数学模型可以近似地以一阶惯性环节来逼近,考虑SCV水浴系统的过程特性[10-11],通过测量系统的阶跃响应曲线,利用切线法,求得主控对象NG出口温度和副控对象SCV水浴温度的数学模型分别为:
1.2.6 差示扫描量热法(DSC)测定 参照Hosseini等[16]的方法,并进行改进。准确称取样品4.0 mg,并将其放入密封的固体坩埚中,以空铝盘作为对照,使用DSC Q2000 差示扫描量热仪对F80-1、F80-2、F90-1 和F90-2 与Zein 制备的纳米载体进行扫描,扫描温度为20~120 ℃,扫描速度为10 ℃/min,氮气流速20 mL/min,每个样品重复扫描三次。
1.2.7 单增李斯特菌和大肠杆菌菌株的培养 单增李斯特菌于胰酪大豆胨液体培养基(Tryptic Soy Broth,TSB)中进行活化,传代三次以获得稳定菌落数,稀释一定倍数使菌落数在(1~2.5)×105CFU/mL,涂布在胰酪大豆胨琼脂培养基(Tryptic Soy Agar,TSA)平板上计数,将稀释后的单增李斯特菌在37 ℃、150 r/min 的条件下培养18 h。大肠杆菌的培养方法同单增李斯特菌培养方法。
1.2.8 复合纳米载体抑菌性能的测定
1.2.8.1 复合纳米载体对单增李斯特菌的抑制作用
依据Cava-roda 等[17]的方法,并进行改进。香草醛对照组取150 μL TSB 培养基、100 μL 香草醛贮备溶液(2800 mg/L,pH6)和50 μL 单增李斯特菌于已灭菌的96 孔板中混匀,37 ℃、595 nm 下测定24 h的OD 值,每小时读数一次。无菌对照组取150 μL培养基,阳性对照组取150 μL 培养基和50 μL 单增李斯特菌混匀;实验组分别取150 μL 培养基、100 μL复合纳米载体和50 μL 单增李斯特菌加入已灭菌的96 孔板中混匀,37 ℃、595 nm 下测定24 h 的OD值,每小时读数一次,每个样品重复测定三次,绘制生长曲线。
1.2.8.2 复合纳米载体对大肠杆菌的抑制作用 方法同1.2.8.1。
1.3 数据处理
采用SPSS 23.0 和Origin 2021 软件进行数据分析及绘图,数据结果以平均值±标准差表示,统计差异通过单因素方差分析(ANOVA)确定,P<0.05 表示差异显著,具有统计学意义,样品重复测定三次。
2 结果与分析
2.1 单糖组成分析
通过气相色谱法测定经上述阴离子交换色谱纯化后的四个组分的单糖组成,结果如图1 和表1 所示。

图1 不同组分AX 气相色谱图Fig.1 Gas chromatogram of different components AX
AX 中主要为阿拉伯糖和木糖,由图1 及表1 可知,四个组分中阿拉伯糖和木糖含量较高,两种单糖组成之和分别为67.41%、76.12%、77.16%和84.89%,F90 的阿拉伯糖和木糖总含量显著高于F80(P<0.05)。Li 等[18]的试验表明AX 在乙醇中具有良好的溶解性,并且阿拉伯糖与木糖含量与乙醇浓度呈正相关。当使用90%乙醇进行沉淀时,AX 能够沉淀出较高含量的阿拉伯糖和木糖。相比之下,使用80%乙醇进行沉淀时,乙醇浓度相对较低,导致沉淀出的阿拉伯糖和木糖也相对较少。
阿拉伯糖与木糖的含量比(A/X)可近似代表阿拉伯木聚糖的分支度,各组分的A/X 分别为0.69、0.65、0.75 和0.95,F90 组分的分支度显著高于F80组分(P<0.05),且F90-2 最高。AX 的分支度指的是分子中侧链的数量和结构,分支度高意味着分子中有更多的侧链,这些侧链可以增加分子的分支结构,增加空间位阻,孔隙结构增多,包裹性增强[19]。
2.2 包封率分析
玉米麸皮AX 复合纳米载体对香草醛的包封率如图2 所示。
由图2 可知F80-1、F80-2、F90-1、F90-2 组分制备的复合纳米载体包封率分别为81.18%、69.36%、86.80%和88.48%。Kwon 等[20]采用大豆蛋白分离物和麦芽糊精包裹香草醛制作的复合纳米载体包封率为58.6%,由此可以看出采用玉米麸皮多糖和玉米醇溶蛋白复合后作为壁材包裹性更好,包封率更高。有研究表明,多糖的高分支度和鼠李糖含量,使其具有较高的乳化性能[21-23]。结合表1,F90-1 和F90-2 中的鼠李糖含量高,F90-1、F90-2 组分制备的复合纳米载体的包封率高;F80-1 中的鼠李糖含量虽然低于F80-2,但其分支度较F80-2 高,因此F80-1 组分制备的复合纳米载体包封率高于F80-2 复合纳米载体。
2.3 荧光光谱分析
荧光光谱可以用来检测多糖与蛋白结合的荧光强度变化,上述复合纳米体系在300~370 nm 下的发射光谱如图3 所示。由图3 可知,AX 的加入,导致荧光光谱最大吸收峰明显降低,F90-1、F80-1 和F80-2 与Zein 装载香草醛制备的纳米载体的最大吸收峰从330 nm 移至320 nm,表明AX 与Zein 和香草醛之间存在相互作用,香草醛的芳香环与AX 和Zein 结合,复合纳米载体的疏水性降低,致使发生荧光猝灭现象[24-25]。此外,相比于对照组,F90-2 与Zein 装载香草醛制备的纳米载体荧光强度最低,其次为F90-1、F80-1 和F80-2 与Zein 装载香草醛制备的纳米载体,结合单糖组成分析,推测是由于F90-2组分阿拉伯糖和木糖总含量较高,分支度也相对较大,因此可能导致和Zein 的疏水相互作用增强,所以荧光强度显著下降。

图3 不同组分复合纳米载体的荧光光谱图Fig.3 Fluorescence spectra of composite nanocarriers with different components
2.4 DSC 分析
采用DSC 对F80-1、F80-2、F90-1 及F90-2 与Zein制成的复合纳米载体包埋香草醛所得纳米体系进行热力学分析,结果如图4 所示。由图4A 可知,香草醛放热效应的最大温度点在83 ℃,与Hasanvand等[25]的研究相同,证明了香草醛在81~83 ℃会出现结晶现象。图4C~F 可以看出,香草醛的特征峰消失,表明香草醛被包裹在纳米载体中,并以无定形的形式存在[26]。这一观点在Dalmolin 等[4]的研究中也得到了验证,香草醛在81.64 ℃出现吸热峰,包封后此吸热峰消失,说明香草醛被封装在纳米载体中。图4B 可以看出,Zein 的吸热峰在104 ℃,说明蛋白质在此温度下发生变性,在图4C~F 中均未发现此峰值,这可能是因为AX 存在大量的亲水基团,与Zein复合后降低了其疏水性,使其不易在高温下变性,提高了其热稳定性[27]。

图4 不同组分复合纳米载体DSC 扫描图Fig.4 DSC scanning diagram of composite nanocarriers with different components
2.5 各组分复合纳米载体抑菌性能分析
图5 可以看出,F80-2 组分与Zein 装载香草醛制备的复合纳米载体抑制单增李斯特菌效果最好,其次为F90-1、F90-2、F80-1 与Zein 装载香草醛制备的复合纳米载体和游离的香草醛,复合纳米载体的抑菌活性高于香草醛的抑菌活性,可能是因为复合纳米载体提高了香草醛的稳定性。
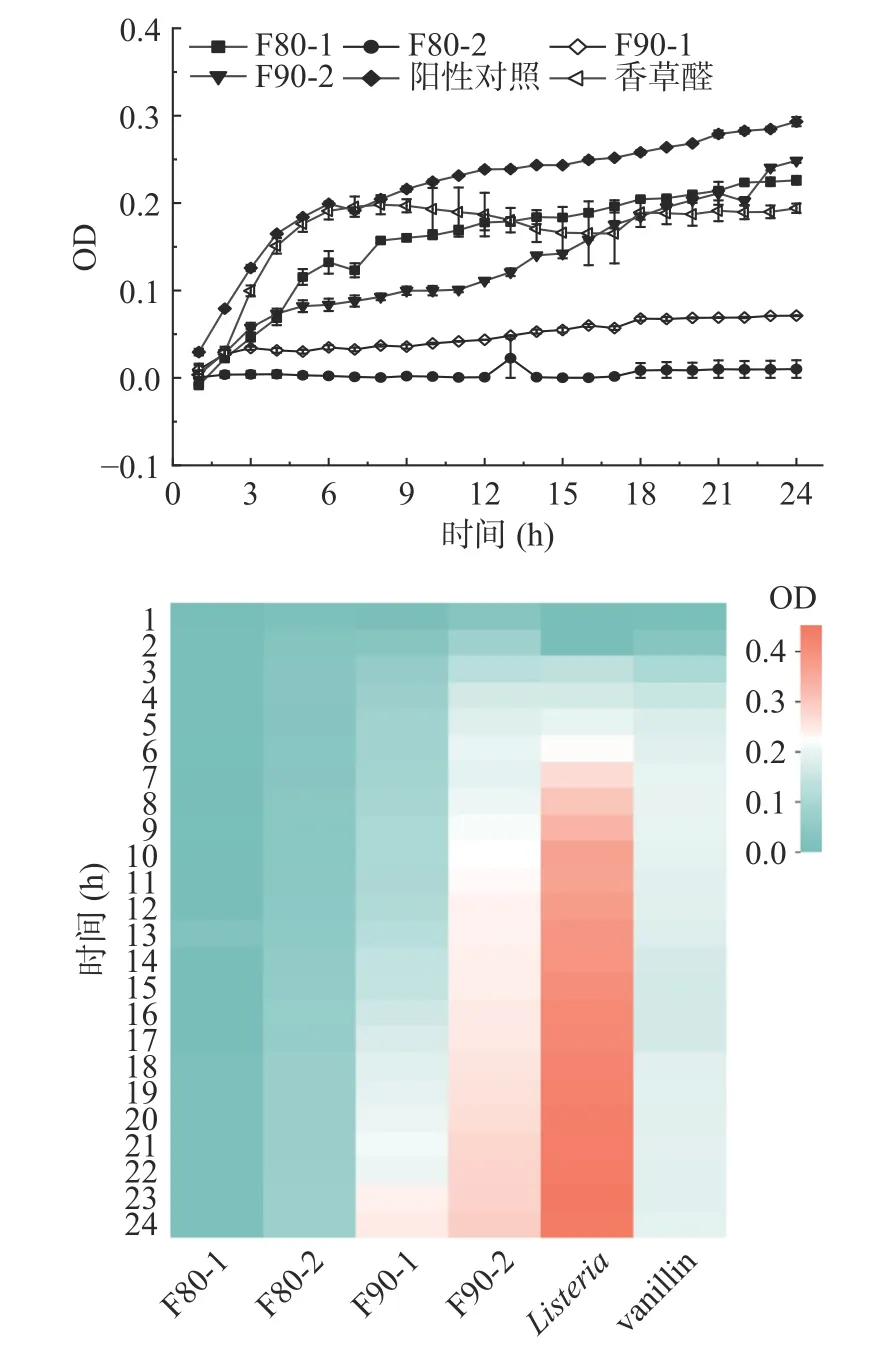
图5 不同组分复合纳米载体抑制单增李斯特菌效果图Fig.5 Effect diagram of composite nanocarriers with different components for inhibit Listeria
由图6 可以看出,F90-2 组分与Zein 装载香草醛复合纳米载体对大肠杆菌的抑制作用最好,其次为游离香草醛、F80-2、F90-1 和F80-1 组分与Zein 装载香草醛复合纳米载体,这可能是由于复合纳米载体可能在进入大肠杆菌细胞时面临渗透性和内部释放等问题,与游离的香草醛相比,复合纳米载体可能在穿过细菌细胞膜或进入细胞质时遇到障碍,从而降低其抑制效果[17,28]。

图6 不同组分复合纳米载体抑制大肠杆菌效果图Fig.6 Effect diagram of composite nanocarriers with different components for inhibit E.coli
复合纳米载体对单增李斯特菌抑制效果更好的原因可能是由于单增李斯特菌属于革兰氏阳性菌,其结构与革兰氏阴性菌的大肠杆菌不同,因此复合纳米载体抑菌效果不同。Jay 等[29]研究表明,香草醛对革兰氏阳性菌的抑菌效果比革兰氏阴性菌更有效。Fitzgerald 等[30]的研究证实单增李斯特菌对香草醛的敏感性高于大肠杆菌,且验证了香草醛的抗菌作用。可能是这些因素共同作用,使负载香草醛的复合纳米载体对单增李斯特菌的抑制效果优于大肠杆菌。
3 结论
本研究采用纯化后的玉米麸皮阿拉伯木聚糖(F80-1、F80-2、F90-1、F90-2)和Zein 复合制备负载香草醛的纳米载体,通过气相色谱法分析出不同组分AX 的单糖组成,其中阿拉伯糖和木糖总含量最高,通过测定包封率得出四个组分复合纳米载体的包封率分别为81.18%、69.36%、86.80%和88.48%,荧光光谱法证明Zein 与AX 发生相互作用,差示扫描量热法证明香草醛包封在复合纳米载体中,提高了香草醛的热稳定性。抑菌试验可以证明,F80-2 组分复合纳米载体抑制单增李斯特菌效果最好,F90-2 复合纳米载体抑制大肠杆菌效果优于游离香草醛,因此AX 复合纳米载体在抑制单增李斯特菌和大肠杆菌方面具有实用价值,扩大了食品工业中的应用范围。

