基于右旋糖酐酶制备小麦多孔淀粉及其特性
王博岩,李 强,吴一卓,章均哲,吴旭东,张 磊,吕明生,王淑军,
(1.江苏省海洋生物资源与环境重点实验室 江苏海洋大学,江苏连云港 222005;2.江苏省海洋生物技术重点实验室 江苏海洋大学,江苏连云港 222005;3.海阳市市场监督管理局,山东烟台 265100)
淀粉是自然界第二大碳水化合物,也是我国重要的食品和加工原料。通过物理、化学和酶法可制备功能淀粉,如:抗性淀粉、多孔淀粉、缓慢消化淀粉、淀粉基吸水剂、淀粉基表面活性剂、淀粉基絮凝剂等。功能淀粉主要应用于食品加工、食品包装材料、药物缓释等领域,提高了淀粉的应用价值[1-2]。其中多孔淀粉主要通过物理、化学和生物酶法等方法制备[3-4]。
生物酶法制备多孔淀粉工艺简单,绿色环保。葡萄糖淀粉酶、α-淀粉酶、β-淀粉酶等单酶或多酶复合常用于制备多孔淀粉[5]。张倩倩等[6]对大米淀粉湿热处理后,选用α-淀粉酶来制备大米多孔淀粉。宋志伟等[7]使用α-淀粉酶水解玉米淀粉,显著提高了淀粉颗粒的比表面积。Das 等[8]用β-淀粉酶制备马铃薯和玉米多孔淀粉。Majzoobi 等[9]用α-淀粉酶来制备小麦多孔淀粉,吸水吸油率为27.87%和13.5%,甲基紫负载率为39.23%。然而,在小麦、红薯、玉米等淀粉中含有的α-1,6 糖苷键,其对淀粉酶的水解有一定的阻碍作用[10]。右旋糖酐酶(Dextranase)能够特异性水解α-1,6 糖苷键[11]。目前尚未见其用于制备多孔淀粉的报道。酶法制备的多孔淀粉广泛应用于环境、医药和食品等领域,用于香料、抗氧化剂的载体,负载植物精油、功能性药物和益生菌等活性物质[12-15]。功能性药物多具有敏感性高、水溶性低和稳定性差的特点[16-17]。通过多孔淀粉负载后,可以显著提高功能性药物的活性[18]。
本研究选用小麦淀粉和右旋糖酐酶制备多孔淀粉。测定了小麦多孔淀粉的比容积、溶解率、膨胀率以及吸水吸油率。选取两种广泛添加于功能性食品的药物(姜黄素和甲磺酸达比加群酯)和两种抗生素(制霉菌素和氧氟沙星),研究了小麦多孔淀粉的负载率,测定了负载姜黄素的多孔淀粉在模拟胃肠道的释放效果。研究结果以期为小麦多孔淀粉的加工提供实验依据。
1 材料与方法
1.1 材料与仪器
食品级小麦淀粉 上海宝鼎酿造有限公司;右旋糖酐酶制备于糖单胞菌K1(发酵纯化制备,活性≥0.5 U/mL)、姜黄素、制霉菌素、氧氟沙星、甲磺酸达比加群酯 阿拉丁股份有限公司;DNS 显色剂(3,5-二硝基水杨酸)、氢氧化钠、磷酸二氢钾和甲醇 分析纯,国药集团;花生油 益海嘉里股份有限公司;胃蛋白酶(1:30000)都莱生物生物技术有限公司;胰蛋白酶(1:250)鼎国昌盛生物技术有限公司。
FreeZone 冻干机 LABCONCO 股份有限公司;Scientific Multiskan Sky 全波长酶标仪、is5 傅里叶红变换红外光谱仪 Thermo 股份有限公司;X’PERT POWDER XRD 射线衍射 PANalytical 股份有限公司;JSM-6390LA 扫描电镜 日本电子;SZ-100 粒度分析仪 HORIBA 股份有限公司。
1.2 实验方法
1.2.1 右旋糖酐酶制备小麦多孔淀粉 根据报道,物理处理有助于提高淀粉的酶解效率,本实验选用了湿热处理以提高多孔淀粉的制备效率[3]。
淀粉对酶敏感性的测定:称取3 g 烘干至恒重的小麦淀粉,加入5%~35%超纯水充分搅拌,密封后置于25 ℃水浴锅中平衡20 h 后,在110 ℃下恒温干燥箱中处理2 h,冷冻干燥后碾磨过200 目筛。称取0.4 g湿热处理小麦淀粉,加入1.6 mL(pH8.5,50 mmol/L)Tris-HCl 缓冲液,50 ℃水浴平衡10 min,加入1 mL酶液,50 ℃恒温振荡1 h,立即加入4% NaOH 2.5 mL溶液终止反应,用DNS 法测量释放的葡萄糖的量。根据公式(1)计算淀粉对酶的敏感性。
式中:c 为DNS 比色法测得的葡萄糖质量浓度,mg/mL;v 为反应体系中液相体积,mL;0.9 为从葡萄糖到淀粉的转化系数;m 为反应前淀粉质量,mg。
分别称取3 g 酶敏感性最佳的湿热处理淀粉与小麦淀粉,加入15 mL(pH8.5,50 mmol/L)Tris-HCl缓冲液,于烧杯中混合均匀,50 ℃恒温摇床中预热15 min,加入10 mL 酶液摇匀,在50 ℃下分别恒温振荡反应(2~16 h),在反应2、4、8、16 h 后加入4%NaOH 3 mL 溶液终止反应,12000 r/min 离心2 min,将淀粉冷冻干燥,研磨后过200 目备用。
1.2.2 小麦多孔淀粉的表面结构和粒径分析 将小麦淀粉、湿热小麦淀粉、酶解小麦淀粉、湿热并酶解不同时间的小麦淀粉均匀加在导电胶上,喷金后用扫描电子显微镜(Scanning electron microscopy,SEM)在6000 倍下观测。多孔淀粉的粒径分布用粒度分析仪测定,将小麦淀粉与小麦多孔淀粉(湿热处理并酶解16 h 的小麦淀粉)加入去离子水,12 W 超声20 s使淀粉颗粒均匀分散后检测。
1.2.3 淀粉比容积、溶解率和膨胀率测定 采用张倩倩等[6]的方法确定多孔淀粉的比容积、溶解率和膨胀率。分别称取2 g 湿热并酶处理不同时间的小麦淀粉和天然小麦淀粉放入10 mL 量筒中。晃动量筒保持淀粉面水平,让淀粉自由落下,求每克淀粉所占的体积,则为淀粉比容积。分别称取0.3 g 湿热并酶处理不同时间的小麦淀粉和天然小麦淀粉,加入15 mL 蒸馏水于烧杯中混合均匀,在60 ℃下搅拌30 min,5000 r/min 离心10 min,将上清液置于水浴锅中沸水蒸干,然后于105 ℃恒温干燥箱中烘干至恒重。根据公式计算溶解率(S)和膨胀率(B):
式中:A 为上清液烘干后质量,g;W 为淀粉样品干质量,g;P 为离心后沉淀质量,g。
1.2.4 多孔淀粉吸水和吸油率的测定 采用Liu等[19]的方法测定多孔淀粉的吸水和吸油率。分别称取200 mg 湿热并酶处理不同时间的小麦淀粉和天然小麦淀粉置于小烧杯中,加入2 mL 的花生油/水混合并搅拌30 min,倒入已知质量的离心管中,以4000 r/min 离心10 min,倒出离心后的上层液,倒置至油水不再渗出,根据公式(4)计算吸油/水率。
式中:W0为离心管的质量,g;W1为多孔淀粉干质量,g;W2为离心后离心管吸水(油)后的淀粉质量,g。
1.2.5 多孔淀粉药品负载率的测定 采用Trindade等[20]的方法,测定姜黄素、甲磺酸达比加群酯、氧氟沙星和制霉菌素的负载率。即准确称量多孔淀粉(湿热并酶解16 h 的小麦淀粉),加入5 mL 去离子水制备均匀的乳液,加入1 mL 药品溶液(2 mg/mL),使多孔淀粉与药物的比例分别为10:1、20:1、40:1、80:1和160:1(w/w),超声搅拌30 min。5000 r/min 离心10 min,将上清液去除,沉淀冷冻干燥。将干燥的样品研磨后装入棕色玻璃瓶,-20 ℃储存。精确称量100 mg 固定化后的多孔淀粉,与1 mL 二甲基亚砜分析纯混合。使用涡旋振荡仪混匀振荡10 min 并在900 W 下超声处理10 min,用0.45 μm 滤膜过滤,重复两次。检测吸溶液的吸光度值(药品的吸收峰分别为姜黄素OD420nm,氧氟沙星OD324nm,甲磺酸达比加群酯OD340nm,制霉菌素OD310nm),依据标准曲线计算药品的负载量。根据公式(5)计算负载率。
标准曲线:将2 mg/mL 的药品用二甲基亚砜进行梯度稀释,以二甲基亚砜为空白,测定不同稀释液的吸光度值,绘制标准曲线。
1.2.6 X 射线衍射测定 将干燥多孔淀粉、负载药品的多孔淀粉(160:1)和四种药品在CuKα(λ=0.15406 nm)、功率为1600 W(40 kV×40 mA)、扫描范围为5°~30°(2θ)、扫描速度5°/min、步长0.02 的条件下检测。
1.2.7 傅里叶红外光谱测定(FTIR)将干燥多孔淀粉、负载药品的多孔淀粉(160:1)和四种药品以1:200 比例与溴化钾的混合研磨呈粉状,在10 Pa 下压片成型,波数范围为4000~400 cm-1,分辨率为1 cm-1。
1.2.8 模拟多孔淀粉的胃肠道的溶出 姜黄素对光、热、pH 具有高度的敏感性[21],选取负载姜黄素的多孔淀粉进行体外模拟释放试验。采用Marefati等[22]的方法制备模拟的胃液和肠液。首先加入2 g NaCl,7 mL 1 mol/L 的HCl 和0.26 g 胃蛋白酶,接着用1 mol/L HCl 调节至pH2 并用超纯水稀释至1 L 制备模拟胃液。500 mL 超纯水中加入6.8 g KH2PO4制备模拟肠液,然后加入胰酶(10 g/L),用0.1 mol/L NaOH 将pH 调节至6.5 并稀释至1 L。按照1.2.5 的方法,将100 mg 不同比例负载的药品加入1 mL 模拟胃液(pH=2.0),检测药品在模拟胃液中的释放。将负载药品的多孔淀粉装入透析袋(截留分子量3 kDa),放入含有胃液的EP 管中。在37 ℃放置0 至2.5 h,每30 min 取样检测。随即再将相同的透析袋置于1 mL 模拟肠液(pH6.5)中,在37 ℃放置0~5 h,每1 h 取样检测,根据公式(6)计算姜黄素的释放率。
1.3 数据处理
本研究试验均设置3 组平行,采用SPSS 24.0软件进行Tukey’s 检验且,P<0.05 为统计学上显著。采用Origin pro 9.1 软件绘制图表。
2 结果与分析
2.1 淀粉含水量对酶敏感性的影响
湿热处理淀粉的含水量对右旋糖酐酶敏感性有显著影响。随着含水量的增加,淀粉对酶的敏感性也随之增加(图1)。当淀粉含水量为30%时,淀粉对酶敏感性最高,酶敏感性达到8.5%,显著高于含水量为25%和35%的7%和7.2%。增加含水量可使淀粉颗粒体积逐渐膨胀,支链淀粉附近的α-1,6 糖苷键发生断裂的可能性增加,影响淀粉的结构,淀粉的无定形区对酶的可及性会增加[23]。然而,淀粉含水量过高时,湿热处理使糊化程度加重,反而影响淀粉对酶的敏感性。因此,选择含水量为30%的淀粉进行湿热处理。

图1 小麦淀粉含水量对酶敏感性的影响Fig.1 Effect of wheat starch moisture content on enzyme sensitivity
2.2 小麦多孔淀粉的表面结构与粒径
如图2 所示,原淀粉表面光滑,经酶处理后,淀粉颗粒表面出现凹坑,这与已报道的文献相似[20],随着酶解时间延长,淀粉表面出现的凹坑逐渐增多,淀粉颗粒也逐渐变小,湿热处理+酶解16 h 后,淀粉颗粒表面出现了明显的孔洞,表明右旋糖酐酶可以制备小麦多孔淀粉。而使用酶处理的原淀粉在16 h 仅有较少的凹坑,结果表明湿热处理有助于酶解制备多孔淀粉。经检测,小麦淀粉和小麦多孔淀粉的平均粒径分别为15.13±1.17、5.21±0.93 μm(图3)。结果表明,右旋糖酐酶对小麦淀粉表面侵蚀使得淀粉粒直径减小[24]。这与扫描电镜显示的结果一致。

图2 不同处理方式的小麦淀粉的扫描电镜图Fig.2 SEM of wheat starch treated in different ways
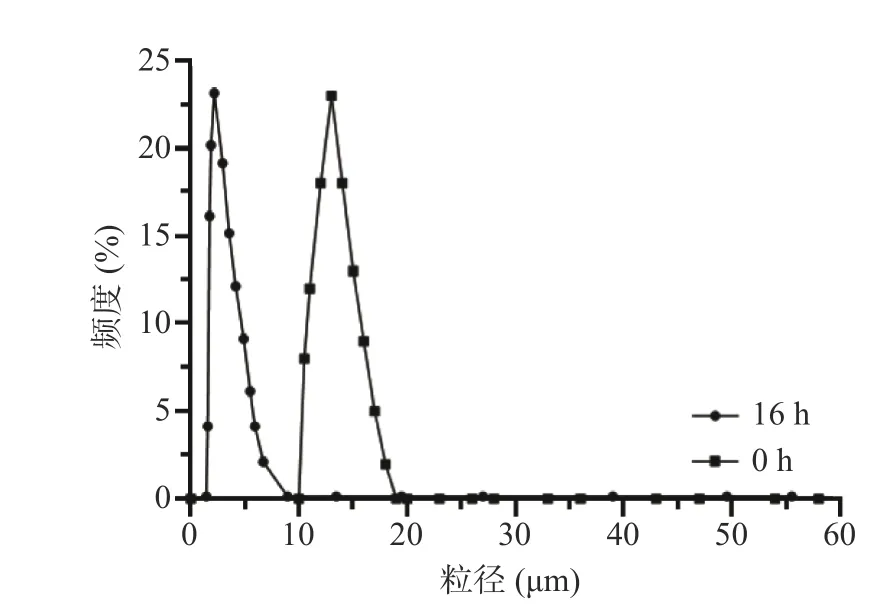
图3 酶解对小麦多孔淀粉粒径的影响Fig.3 Effect of enzymatic digestion on particle size of wheat porous starch
2.3 小麦多孔淀粉的比容积、溶解率和膨胀率
由表1 可知,随着酶解时间的延长多孔淀粉的比容积、溶解率和膨胀率均显著增加(P<0.05),酶解16 h 的小麦多孔淀粉比容积从1.21±0.01 提高到2.11±0.02 cm3/g。多孔淀粉的溶解率与膨胀率也分别达到了9.02%±0.21%与9.91%±0.22%。酶水解后,在非结晶区的直链淀粉会散出,从而提高了淀粉的溶解率[25]。在淀粉颗粒中形成的孔洞降低了其结构强度,水分子进入淀粉孔洞中,提高了淀粉的膨胀率。

表1 小麦多孔淀粉比容积、溶解率和膨胀率Table 1 Wheat porous starch specific volume,solubility and expansion ratio
2.4 小麦多孔淀粉的吸水和吸油率
表2 显示,随着酶解的时间的延长,小麦多孔淀粉的吸水和吸油能力显著提高(P<0.05)。酶解16 h的淀粉的吸水率和吸油率分别达到了80.12%±2.30%和78.23%±3.00%。淀粉颗粒的孔洞数量的增多,使水和油的分子更容易进入淀粉的内部,提高了淀粉的吸水率和吸油率[26]。

表2 小麦多孔淀粉吸水吸油率Table 2 Water and oil absorption rate of wheat porous starch
2.5 小麦多孔淀粉的负载率
表3 显示药物的负载率。随着多孔淀粉与药物比例的增加,多孔淀粉负载药物的量也随着增加。四种药品的平均负载率从14.30%±2.13%增加至75.07%±1.23%。多孔淀粉对不同药物的负载率没有显著性差异(P>0.05)。多孔淀粉增加了表面积,使药物负载于多孔淀粉中[27]。
2.6 小麦多孔淀粉负载药物的XRD 检测
对小麦淀粉、酶解小麦淀粉和负载药物的多孔淀粉的检测结果见图4。酶解后的小麦淀粉在15°、17°、18°、23.5°主峰略有下降,与Song 等[28]报道的α-淀粉酶水解使蜡质玉米淀粉和普通玉米淀粉的主峰略有下降相似。表明右旋糖酐酶制备小麦多孔淀粉没有破坏淀粉的晶体结构。文献报道多孔淀粉是典型A 型晶型,在2θ为15°、17°、18°、23.5°处形成特征峰[29]。通过对比淀粉、多孔淀粉、姜黄素、甲磺酸达比加群酯、制霉菌素、氧氟沙星的XRD 光谱图,负载了四种药物的小麦多孔淀粉未显示出其药物原有的特征峰。与报道的酪蛋白负载姜黄素的结果相似,即XRD 图谱中观察不到姜黄素的特征峰[28]。因此,小麦多孔淀粉负载四种药物后,四种药物的特征峰消失,表明四种药物已被成功地包埋在多孔淀粉中了[30]。

图4 小麦淀粉和酶解淀粉(A)、药品(B)和多孔淀粉包封药品(C)的XRDFig.4 XRD of wheat starch and enzymatic hydrolysis of starch(A),drugs (B) and porous starch encapsulated with drugs (C)
2.7 小麦多孔淀粉负载药物的FTIR 检测
图5A 显示,经酶处理后,小麦多孔淀粉特征吸收峰与小麦淀粉相比没有明显变化,多孔淀粉在2927、1646、1241、1367 cm-1处的特征峰分别为-CH2、C-C、C-O 和C-O-O 这与文献[31]报道的一致。表明酶处理后,多孔淀粉保留了基本成分。

图5 小麦淀粉和酶解淀粉(A)、多孔淀粉负载制霉菌素和氧氟沙星(B)和多孔淀粉负载姜黄素和甲磺酸达比加群酯(C)的红外图谱Fig.5 Infrared spectra of wheat starch and enzymatic hydrolysis of starch (A),porous starch encapsulated with mycophenolate and ofloxacin (B) and porous starch encapsulated with curcumin and dabigatranate mesylate (C)
FT-IR 光谱检测结果表明,小麦多孔淀粉均有效地负载了药物。多孔淀粉在1646 cm-1处有特征峰,负载制霉菌素后,该峰红移到1630 cm-1,负载氧氟沙星后,该峰红移到1622 cm-1,负载姜黄素后,该峰红移到1628 cm-1,负载甲磺酸达比加群酯后,该峰红移到1610 cm-1。此外,由图5B 和5C 可见,负载药物多孔淀粉均保留了药物和多孔淀粉的特征峰。如:姜黄素在1602 cm-1处可以观察到的特征峰,同时,在多孔淀粉负载的姜黄素中也可观察到1602 cm-1处的峰。表明小麦多孔淀粉可以负载疏水性的药物。
2.8 小麦多孔淀粉负载药物的体外释放
在模拟胃消化液中,负载姜黄素多孔淀粉的释放率见图6(A)。药品的释放率受多孔淀粉的载药量影响较大。多孔淀粉与姜黄素的比例为10:1、20:1、40:1、80:1、160:1 时,2.5 h 的释放率分别为25.25%、28.15%、29.1%、30%、33.8%。

图6 小麦多孔淀粉负载姜黄素在胃液(A)和肠液(B)中的释放Fig.6 Release of wheat porous starch-fixed curcumin by gastric(A) and intestinal (B) fluids
经过胃模拟释放后,负载姜黄素的多孔淀粉再次在模拟肠液中释放,结果见图6(B)。多孔淀粉与姜黄素的比例为10:1、20:1、40:1、80:1、160:1时,姜黄素5 h 的释放率分别为35.58%、37.52%、37.96%、38.21%和42.43%。数据表明,姜黄素在肠道中的释放率增加。胃和肠道的pH 的变化大,从pH2 升到pH6.5,影响了肠道中酶的活性,且在肠道中释放时间为5 h,从而影响了多孔淀粉中药物的释放[28]。
根据文献报道,多孔淀粉可以减缓负载药品的释放[18]。多孔淀粉通常在小肠环境中难以消化,可以成功地将负载的药物输送到结肠中,并被微生物群分解为碳水化合物,最终使负载的药物全部释放[32-33]。
3 结论
本研究用右旋糖酐酶制备小麦多孔淀粉。结果表明,湿热处理可促进右旋糖酐酶制备多孔淀粉,淀粉含水量为30%时,淀粉对酶的敏感性最高。在酶处理16 h 后,多孔淀粉的比容积为2.11±0.021 cm3/g,吸水率和吸油率分别提高到80.12%和78.23%;多孔淀粉对四种不同药物均表现出较好的负载能力。当多孔淀粉与药物的比例为160:1 时,药物负载率均超过了70%。XRD 结果表明,原淀粉和多孔淀粉的结晶型为A 型,酶处理没有改变小麦淀粉的结晶构型;FTIR 图谱显示,原淀粉和多孔淀粉的特征吸收峰没有明显变化,吸附了药物的多孔淀粉显示出药物的特征峰。在胃液中模拟药物释放,2.5 h 的释放率约为30%。在肠液中模拟药物释放,5 h 的释放率约为40%。小麦多孔淀粉负载姜黄素可以显著降低药物的释放。研究结果为制备小麦多孔淀粉提供了实验依据。

