不同生长阶段马口鱼肠道菌群差异性研究
崔雁娜郝贵杰丁兰郑梦兰王雨辰涂金玉孙家栋林锋
(1.农业农村部淡水渔业健康养殖重点实验室/ 浙江省鱼类健康与营养重点实验室/湖州市水产品品质提升与加工技术重点实验室/浙江省淡水水产研究所,浙江 湖州 313001;2.安吉县农业农村局,浙江 湖州313300;3.安吉县梅溪镇农业农村办公室,浙江 湖州 313306;4.安吉梅溪草滩家庭农场,浙江 湖州 313306;5.安吉梅溪孙傅家庭农场,浙江 湖州 313306)
前言
马口鱼(Opsariichthys bidens)俗名花杈鱼、桃花鱼、山鳡等,杂食偏肉食性淡水鱼类,溪流中多见,肉质鲜美,营养及经济价值高,投苗养殖当年即可上市[1]。2017年浙江省淡水水产研究所突破了马口鱼种苗规模化繁育关键技术,实现催产率86.87%、受精率82.73%、出苗率80.58%,获仔鱼20万尾,育成平均规格4.4cm的夏花鱼种12.9万尾[2]。马口鱼人工规模化繁育也在不断实现突破[3]:人工繁育试验,进行人工催产,人工授精,亲鱼优选,亲鱼强化培育等方面都取得了飞速发展。很多学者对不同的水体马口鱼养殖模式也进行了研究,包括池塘、砖砌水泥池、塑料膜铺底土池、一般土池、稻田轮养、河水土池、废弃鰻池、平原河流水、室内工厂化、跑道养殖等[4],各种不同水体养殖的马口鱼所耗费的成本及获得的收益有很大差别,但是相比其他鱼类,经济效益依然非常客观。然而,关于马口鱼体内肠道菌群的研究还比较少见。鱼类的肠道菌群在鱼类生长过程中的营养供应、代谢稳态和免疫防疫中都会起到重要的作用[5]。鱼类的微生物群可以是多样的,包括原生动物、真菌、酵母、病毒以及细菌和古菌[6]。虽然原生动物、真菌、酵母、病毒以及细菌和古菌在鱼类生长中都有不同程度的贡献,但细菌是鱼类肠道的主要微生物群[7]。因此,本课题组基于16SrRNA检测对2月龄、5月龄、9月龄的马口鱼体内肠道菌群进行了研究,以期对马口鱼保健及用药提供参考。
1 材料和方法
1.1 试验材料
2022年4月底在浙江湖州某家庭农场放水花苗,放养密度7万尾·667m-2。放苗之前池塘已经清塘、晒干、消毒。分别在2022年6月底、9月底和2023年1月底进行采样检测,样品分别对应2月龄、5月龄、9月龄的马口鱼。
选取活力好、无外伤,平行样品大小相近的2月龄、5月龄、9月龄的马口鱼各25尾,对取样工具消毒后,分别取样并测体重、体长、肠重、肝重,并将马口鱼肠道放置于-80℃保存待测肠道微生物。
1.2 仪器设备
PCR仪,ABI GeneAmp®9700型(美国ABI公司);QuantiFluorTM-ST蓝色荧光定量系统(Promega公司);分析天平(SECURA125-1CN/SQP),德国Sartorius科学仪器有限公司;多功能水质测定仪HQ40d(美国哈希)。
1.3 试验方法
1.3.1 水质常规指标检测
对2月龄、5月龄、9月龄马口鱼养殖水质的pH、水温、溶解氧进行了检测。
1.3.2 生长性能测定
取2月龄、5月龄、9月龄马口鱼样品各25尾,测量其体重、体长,解剖后取内脏和肝脏,称重,计算各组特定生长率(specific growth rate,SGR)、肥满度(condition factor,CF)、肝体指数(hepatopancreas somatic indices,HSI)、脏体指数(Visceral SensitivityIndex,VSI)。各指标计算公式:
SGR(%·d-1)=100×[(lnW2-lnW1)/(t2-t1)]
(1)
CF(%)=100×W/L3
(2)
HSI(%)=100×W肝脏/W
(3)
VSI(%)=100×W内脏/W
(4)
式中,W1和W2分别为t1和t2时的体重,g;W肝脏表示肝脏重,g;W内脏表示内脏重,g;W表示对应的体重,g;L表示体长,cm。
1.3.3 肠道微生物的检测
采用以2月龄、5月龄、9月龄马口鱼的肠道微生物DNA为模板,通过聚合酶链式反应(PCR),采用515F-907R引物对16S rRNA基因进行扩增,并用Illumina Hiseq 2500测序平台测序获得原始数据。
1.4 数据分析
需要根据barcode得到所有样品的有效序列;根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2;用Usearch软件和gold数据库,采用denovo和reference结合的方式去除嵌合体。使用软件:Trimmomatic、FLASH、Usearch、qiime、perl程序。
2 结果与分析
2.1 马口鱼养殖水质检测
对2月龄、5月龄、9月龄马口鱼养殖水质的pH、水温、溶解氧进行了检测,检测结果见表1。3组样品pH值、养殖水温均有显著性差异;2月龄、5月龄马口鱼的溶解氧无显著性差异,5月龄、9月龄马口鱼溶解氧存在显著性差异;2月龄、9月龄马口鱼的溶解氧存在显著性差异。

表1 3组马口鱼养殖水质情况
2.2 马口鱼生长性能测定
2月龄、5月龄、9月龄马口鱼的生长性能检测结果见表2。从体重来看,2月龄、5月龄、9月龄马口鱼呈递增关系,但2月龄、5月龄存在显著性差异,5月龄、9月龄无显著性差异;从体长来看,2月龄、5月龄、9月龄马口鱼也呈递增关系,2月龄、5月龄、9月龄马口鱼之间均存在显著性差异;从肥满度来看,5月龄与2月龄和9月龄均存在显著性差异,2月龄和9月龄无显著性差异,2月龄、5月龄、9月龄呈先增长后下降关系。
2.3 样品肠道微生物测序质量分析
对2月龄、5月龄、9月龄马口鱼的肠道微生物16S rRNA 基因测序数据进行双端拼接、质控以及嵌合体过滤后,共获得有效序列1837607条。序列长度范围为1~400bp,其中99.5%集中在361~380bp。3组样品的覆盖度均达到了0.999以上,表明检测的样本量具有代表性。从图1也可以得出同样的结论。物种累积曲线是用于描述随着样本量的加大物种增加的状况,是调查样本的物种组成和预测样本中物种丰度的有效工具,在生物多样性和群落调查中,被广泛用于样本量是否充分的判断以及物种丰富度的估计。

表2 马口鱼不同生长阶段生长性能
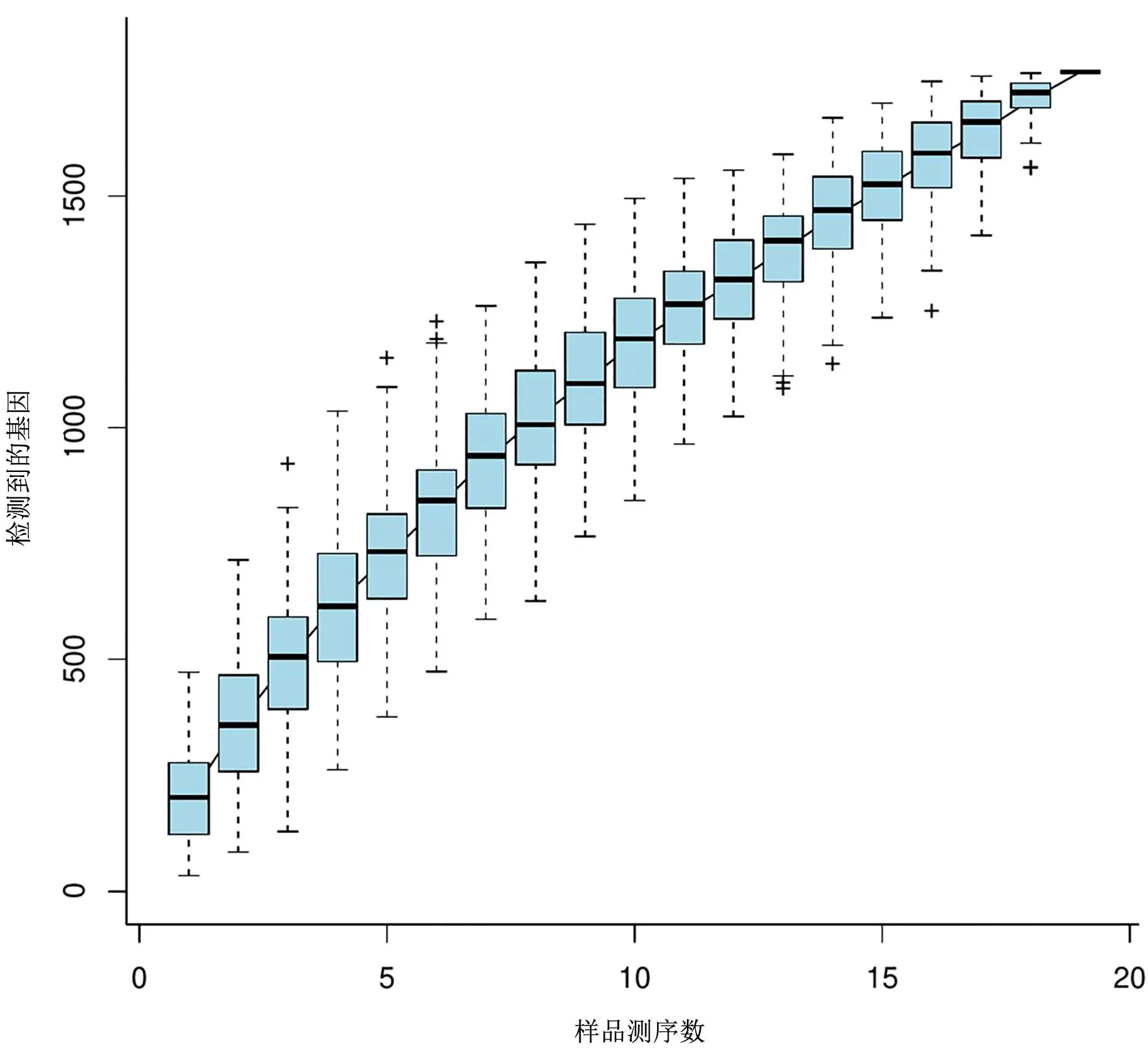
图1 2月龄、5月龄、9月龄马口鱼肠道菌群的物种累计曲线
2.4 样品肠道微生物多样性分析
2月龄、5月龄、9月龄马口鱼OTU特征序列韦恩图见图2。共有OTU 43个,占总数的2.46%;2月龄、5月龄、9月龄马口鱼独有OTU分别为886个、18个、552个。2月龄、5月龄共有OTU 56个,占两者总数的4.56%,占各自总数的4.66%、68.3%;2月龄、9月龄共有OTU 302个,占两者总数的17.4%,占各自总数的25.1%、36.3%;5月龄、9月龄共有OTU 51个,占两者总数的5.91%,占各自总数的62.2%、6.13%。可见,2月龄、9月龄马口鱼的肠道菌群相似度更高。

图2 马口鱼不同生长阶段特征序列韦恩图
2月龄、5月龄、9月龄马口鱼的肠道菌群多样性情况见表3。从表3可以看出,描述物种丰富度的指标中,从Ace来看,2月龄、5月龄存在显著性差异,而9月龄和2月龄、5月龄均无显著性差异;从Chaol指数来看,2月龄、5月龄存在显著性差异,2月龄、9月龄无显著性差异,5月龄、9月龄存在显著性差异。因算法不同,样品之间的显著性差异有细微差别。但2月龄、5月龄存在显著性差异,2月龄、9月龄无显著性差异是可以确定的。
Simpson指数值越大,说明群落多样性越低。Shannon指数值越大,说明群落多样性越高。从表3可以看出,无论根据Simpson指数值还是Shannon指数值,群落多样性最高的样品是2月龄,其次是9月龄,最低的是5月龄。2月龄与5月龄存在显著性差异,5月龄与9月龄存在显著性差异,2月龄与9月龄无显著性差异。

表3 马口鱼不同生长阶段肠道菌群多样性统计
2.5 样品肠道菌群组成分析
对3组样品进行群落结构分析后,总共发现26个属,见图3。2月龄马口鱼肠道菌群丰度较高(≥1%)的为产碱杆菌属(Alcaligenaceae)20.7%、气单胞菌属(Aeromonas)29.5%、鲸蜡杆菌属(Cetobacterium)7.67%,醋酸杆菌属(Cetobacterium)7.47%、足杆菌属(Pedobacter)4.61%、假单胞菌属(Pseudomonas)2.36%、未分类的杆菌属(Bacilli_unclassified)3.50%、罗斯氏菌属(Romboutsia)6.71%、Chloroplast4.85%、未分类的细菌属(Bacteria_unclassified)2.76%、副梭菌属(Paraclostridium)1.89%、毛螺菌属(Lachnospiraceae)1.19%、Candidatus1.17%、其他(Others)13.1%。
5月龄马口鱼肠道菌群丰度较高(≥1%)的为气单胞菌属(Aeromonas)41.6%、支原体属(Mycoplasmataceae)32.9%、鲸蜡杆菌属(Cetobacterium)24.5%。
9月龄马口鱼肠道菌群丰度较高(≥1%)的为产碱杆菌属(Alcaligenaceae)46.2%、足杆菌属(Pedobacter)10.8%、假单胞菌属(Pseudomonas)6.95%、未分类杆菌属(Bacilli_unclassified)3.81%、Chloroplast1.62%、不动杆菌属(Acinetobacter)4.35%、丙酸杆菌属(Propionibacteriaceae)3.55%、未分类的细菌属(Bacteria_unclassified)1.33%、明串珠菌属(Trichococcus)3.24%、鞘氨醇单胞菌属(Sphingomonas)1.01%、其他(Others)16.3%。

图3 2月龄、5月龄、9月龄属水平下细菌相对丰度
从2月龄、5月龄、9月龄马口鱼的肠道菌群数据来看,马口鱼在2~5个月生长过程中,以气单胞菌属(Aeromonas)、鲸蜡杆菌属(Cetobacterium)为主导菌属,9个月时这2种菌属几乎消失,出现了更多种类的其他菌属。通过PERMANOVA分析,发现有显著性差异的菌属有产碱杆菌属(Alcaligenaceae)P<0.01,Enterobacterales_unclassified P<0.05,MesotogaP<0.01,Methyloparacoccus P<0.05,足杆菌属(Pedobacter)P<0.01,PropioniciclavaP<0.01,假单胞菌属(Pseudomonas)P<0.01,罗斯氏菌属(Romboutsia)P<0.05,Spirochaetaceae_uncultured P<0.05.对3组样品进行群落结构分析后,总共发现7个门。见图4。

图4 2月龄、5月龄、9月龄门水平下细菌相对丰度
2月龄马口鱼肠道菌群丰度较高(≥1%)的为变形菌门(Proteobacteria)55.6%、厚壁菌门(Firmicutes)17.6%、梭杆菌门(Fusobacteriota)7.78%、拟杆菌门(Bacteroidota)6.36%、放线菌门(Actinobacteriota)1.89%、蓝菌门(Cyanobacteria)4.89%、未分类的细菌(Bacteria_unclassified)2.76%、Synergistota1.18%、其他(Others)2.02%。
5月龄马口鱼肠道菌群丰度较高(≥1%)的为变形菌门(Proteobacteria)41.9%、厚壁菌门(Firmicutes)33.2%、梭杆菌门(Fusobacteriota)24.5%。
9月龄马口鱼肠道菌群丰度较高(≥1%)的为变形菌门(Proteobacteria)63.1%、厚壁菌门(Firmicutes)10.1%、拟杆菌门(Bacteroidota)13.4%、放线菌门(Actinobacteriota)8.11%、蓝菌门(Cyanobacteria)1.66%、未分类的细菌(Bacteria_unclassified)1.33%、其他(Others)2.15%。
从2月龄、5月龄、9月龄马口鱼的肠道菌群数据来看,马口鱼在2~5个月的生长过程中,以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteriota)为主,占比达到81.0%~99.6%。9个月的马口鱼梭杆菌门(Fusobacteriota)消失。2月龄的马口鱼与成鱼马口鱼菌门的群落结构呈现高度相似性。通过PERMANOVA分析,发现有显著性差异的菌门有放线菌门(Actinobacteriota)P<0.05,拟杆菌门(Bacteroidota)P<0.01,PlanctomycetotaP<0.05,ThermotogotaP<0.01。
3 讨论
3.1 马口鱼生长性能
本研究发现,2月龄、5月龄、9月龄的马口鱼体重在马口鱼水花下塘后2~5个月期间迅速增长,5~9个月期间生长速度减缓,表现为体重2~5个月有显著差异,5~9个月无显著性差异;2月龄、5月龄、9月龄的马口鱼之间体长均存在显著性差异。肥满度在2~5月龄期间上升,5~9月龄期间下降。这与塔里木裂腹鱼的生长规律相同。原因是小个体的鱼正处于生长阶段,摄入能量主要供给身体的生长发育,肥满度增加较快,随着鱼的生长,较大个体的鱼摄入的能量除了供应身体生长发育外,还需要储存足够的能量进行繁殖活动,导致肥满度下降[8]。
3.2 样品肠道微生物多样性
无论是OTU韦恩图还是ACE、Chaol指数、Shannon指数、Simpson指数,都说明2月龄、9月龄马口鱼样品的肠道菌群相似度更高。本试验2月龄、5月龄、9月龄的马口鱼饲料成分都一样,所以不同月龄马口鱼的肠道菌群的差异性可排除饲料的影响因素。2月龄、9月龄马口鱼样品的肥满度也无显著性差异,与肠道菌群的变化规律相同。养殖水质也是需要考虑的因素。2月龄养殖水温最高,从4个指数来看,2月龄肠道菌群菌种丰富度和多样性也是最高的,这和Macmillan、Al-Harbi等的研究结论相同[9,10]。
3.3 样品肠道菌群组成
无论是从属还是门水平来看,都是2月龄、9月龄马口鱼样品的肠道菌群相似度更高,5月龄马口鱼样品肠道菌群物种丰富度都明显低于2月龄、9月龄马口鱼样品。这和样品肠道微生物多样性的规律相同。具体来看,2月龄和5月龄相同的菌属是气单胞菌属(Aeromonas)和鲸蜡杆菌属(Cetobacterium),占比分别是37.2%、66.1%。气单胞菌属(Aeromonas)被鉴定为可能有助于消化的鱼肠道微生物群[11]。2月龄、9月龄相同的菌属是产碱杆菌属(Alcaligenaceae)、足杆菌属(Pedobacter)、假单胞菌属(Pseudomonas)、Chloroplast,占比分别是32.5%、65.6%。5月龄、9月龄没有相同的菌属。Neuman C等对鲑鱼的研究发现了季节性水温变化与肠道微生物组成变化之间的关系。这项研究表明,温度升高(高达21℃)与乳酸菌(LAB)和不动杆菌属(acinetoobactspp)的消失有关[12]。2月龄和5月龄马口鱼样品养殖水温均超过21℃,未发现乳酸菌(LAB)和不动杆菌属(acinetoobactspp),9月龄马口鱼养殖水温降到10℃以下时,出现了不动杆菌属(acinetoobactspp),这与Neuman C等的研究结论相同。
2月龄和5月龄相同的门是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteriota),分别占比81.1%、99.6%;2月龄和9月龄相同的门是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、蓝菌门(Cyanobacteria),分别占比86.3%、96.4%;5月龄和9月龄相同的门是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes),分别占比75.1%、73.2%。研究发现,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)是鱼类肠道菌群中最常见的菌门[13]。
4 结论
鱼类的肠道微生物群负责关键的生理功能,有助于消化,能够影响鱼类的营养、生长、繁殖、总体种群动态以及宿主对疾病的抵抗力[14]。也有文献证明,在水生动物中,肠道微生物负责消化藻细胞,产生氨基酸和分泌抑制性化合物,以防止细菌病原体对肠道的定殖[15]。以上这些功能都有助于维持宿主的健康。鉴于鱼类所面临的环境变化,尤其是鉴于水产养殖业的增长和气候变化导致的养殖水温度上升,了解其组成及其在健康和疾病方面的确切功能作用至关重要。
当喂养饲料不发生变化时,养殖水温是影响马口鱼菌属的关键因素之一。当水温由29.0℃降到24.5℃时,存在共同的菌属气单胞菌属(Aeromonas)和鲸蜡杆菌属(Cetobacterium);当水温由24.5℃降到6.61℃时,共同的菌属消失,但是菌属种类增加。虽然水温由24.5℃降到6.61℃时溶解氧也发生了显著性差异,但还未查到相关文献表明,溶解氧的变化是导致菌属变化的原因。
马口鱼肠道菌群丰富度和多样性和马口鱼的肥满度变化规律相同。2月龄和9月龄的马口鱼肠道菌群丰富度和多样性都无显著性差异。但2月龄和9月龄的马口鱼肠道菌群丰富度和多样性与5个月龄的马口鱼均存在显著性差异。2月龄的马口鱼和9月龄的马口鱼肥满度无显著性差异,2月龄和9月龄的马口鱼肥满度与5月龄的马口鱼均存在显著性差异。
不同生长阶段马口鱼肠道菌群与养殖水温、溶解氧、肥满度的关系可为养殖过程进行养殖环境调控提供科学依据。但关于溶解氧、肥满度与马口鱼生长过程中菌群变化的机理还不够明确,还需进行深入研究。
——马口窑文献与当代陶艺创作研究展

