重庆某污水处理厂出水发黄原因及应对措施研究
诸力维,王同奎**,王 宇,周 洋,邹 蓉,张楷彬,刘 晓,田 爽,李晓林
(1.重庆市三峡鱼复排水有限责任公司,重庆 401133;2.西南大学 化学化工学院,重庆 400715)
重庆市城区某污水处理厂一期设计处理规模为3万m3/d,该厂设计时定位为城镇生活污水处理厂,设计工业废水占比46%,主要工艺为A2/O+滤布滤池工艺,出水水质执行《城镇污水处理厂污染物排放标准》(GB18918-2002)一级A标,尾水排入长江。目前实际收集处理污水约2.8万m3/d。由于园区入驻企业数量多、规模大,而入住人口较少,目前该厂进水中实际工业废水占比达74%,而大比例的工业废水极易造成出水水质冲击问题[1]。
目前,该污水处理厂二沉池和滤布滤池出水清澈,而接触消毒池出水会偶尔出现偏黄现象。尤其是二氧化氯(ClO2)或者次氯酸钠(NaClO)用量较大时,出水发黄严重(图1),从而易导致出水色度超标;而降低消毒剂的用量会导致出水大肠杆菌偏高,甚至超标。基于此,本研究工作针对出水发黄现象及应对措施展开了调查研究和分析。

图1 接触消毒池出水发黄情况
1 水质色度异常分析
1.1 出水发黄原因分析
通过调研发现,出水水质发黄有可能由以下几个方面的原因造成[2]:①当污水系统受到负荷冲击时,污泥部分解体,出水中带着游离的污泥会造成水质偏黄[3]。但在出水发黄时,出水的COD一直保持在10~20 mg/L 范围内。此外,二沉池水质清澈透明,故排除污泥解体造成的。另一方面,系统长期低负荷运行会导致丝状菌膨胀,也会造成出水偏黄,但其COD值并不高,且二沉池的水比较清澈,故丝状菌膨胀导致水质偏黄的可能性也被排除。②当氨氮浓度高时,出水在剧烈的撞击下水花也会起泡和泛黄[4],然而出水发黄时检测的氨氮浓度一般都低于 0.05 mg/L,因此该可能性也排除在外。③另一种可能的原因是金属离子氧化沉淀后显色,尤其是Mn2+和Fe3+。二沉池出水经过NaClO氧化后会产生颜色更深的铁盐和二氧化锰沉淀,浓度较大时会造成水质泛黄[5]。基于此,本研究开展了源头水和二沉池出水以及消毒后出水的水质分析调查。通过配制不同浓度的亚铁和二价锰溶液,经过NaClO氧化后观察气色度和抽滤后滤纸的显色情况,分析是否是Mn2+和Fe3+浓度过高引起的,并通过实验选择合适的混凝剂进行沉淀处理。
1.2 水质分析
通过源头水排查,Fe3+和Mn2+主要来自于下游企业源头水。为了开展实验探究,摸清具体水质情况,通过对源头水进口(A1)、二沉池出水口(WS1)和出水(WS2)进行了铁和锰元素浓度的检测,如表1所示。通过对A1、WS1和WS2三个位置水质取样检测发现,进水铁元素的质量浓度在 0.14 mg/L 左右,二沉池和出水口铁元素基本上消失。对于锰元素,源头水进口Mn2+的平均质量浓度为 0.59 mg/L,二沉池出水出口Mn2+的平均质量浓度为 0.48 mg/L,出水口Mn2+的平均质量浓度为 0.45 mg/L。由此得出,相比于A1处,WS1和WS2处的Fe3+基本上消失;而WS1和WS2处的的Mn2+浓度比A1处的Mn2+浓度只是略微下降,说明现有工艺无法实现对Mn2+的有效去除。基于此,可以初步判断引起出水水质发黄的原因是Mn2+浓度较高造成的。
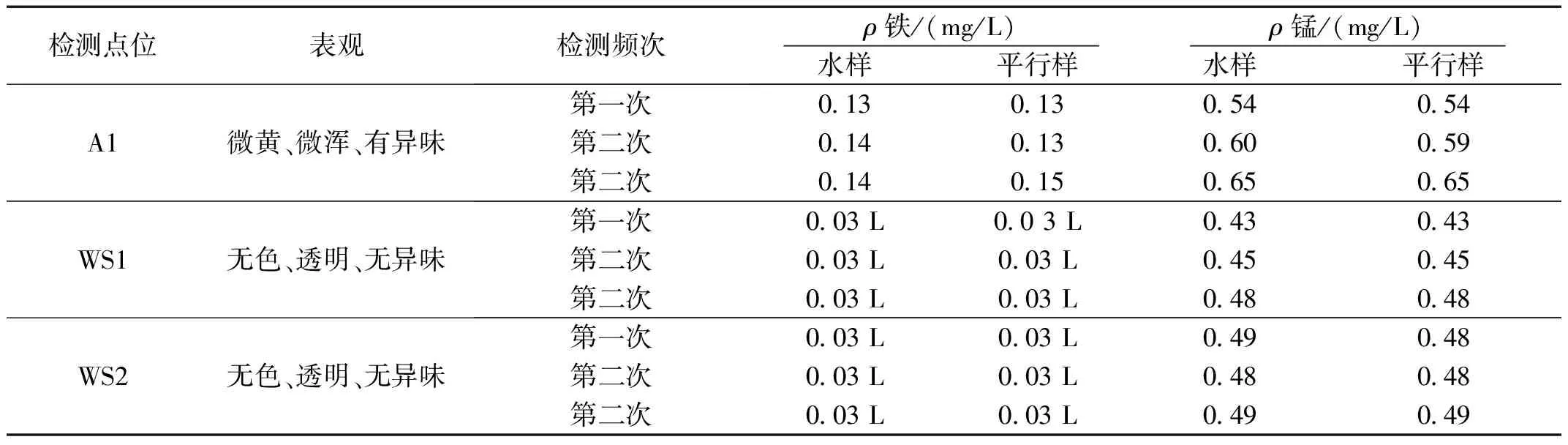
表1 源头水进、出口、二沉池出口检测铁和锰元素检测结果
2 处理方案
2.1 验证方案
通过对水质的分析初步得出结论:引起出水水质发黄的主要原因是Mn2+浓度较高。为了验证该结论,开展了不同浓度的锰和铁元素的溶液经过NaClO氧化处理的实验,然后测其色度。
水质发黄检测方案:分别配制不同质量浓度(0.2、0.5、0.8、1.0、2.0、5.0 mg/L)。配制原则:将所有锰、铁离子的浓度包含在该浓度区间内)的Fe3+(FeCl3·4H2O)和Mn2+[Mn(CH3COO)2]溶液;分别取铁、锰溶液和二沉池出水水样各 25 mL,添加 3.0 mL 质量分子数为7.5%NaClO之后对溶液的色度进行分析;并记录抽滤后滤纸颜色变化。
色度的测量方法:采用稀释倍数法(HJ1182—2021)将被检测的水样用光学纯水稀释至用目视比较与光学纯水相比刚好看不见颜色为止,此时稀释的倍数即为该水样的色度。同时目视观察水样,用文字描述颜色性质:颜色的深浅、透明度。采用稀释倍数值和文字描述相结合的方法来表示色度。
对于质量浓度为0.02、0.2、0.5、1.0、2.0、5.0 mg/L 的Fe3+溶液,通过加入NaClO后的溶液和抽滤后的滤纸颜色变化可以发现Fe3+的存在对色度的影响不大(见图2),根据稀释倍数法得到的相应色度依次为0、0、6、10、10、20(见表2)。通过水质监测数据可知,二沉池出水所含的Fe3+基本消失(见表1),因此,基本可以排除出水发黄是由于Fe3+导致。
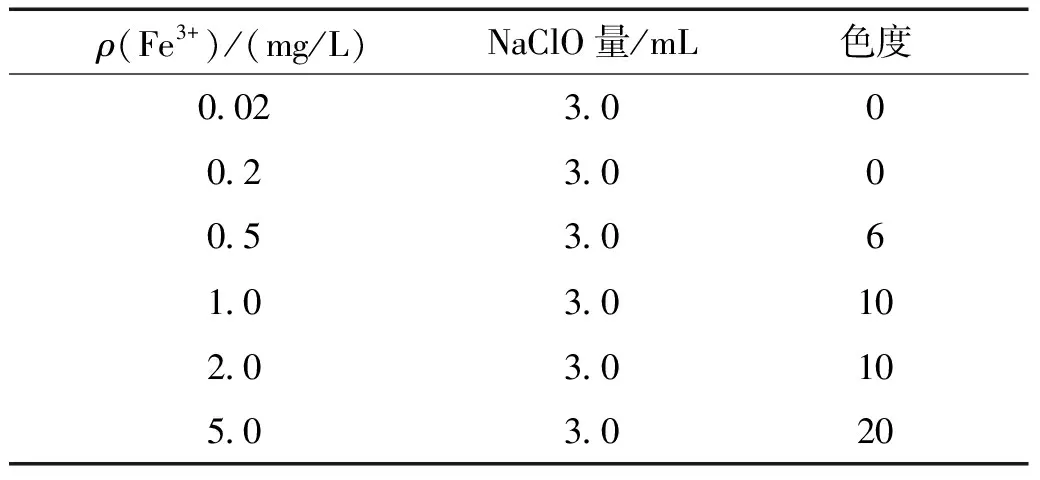
表2 不同质量浓度的含Fe3+溶液添加NaClO后的色度数值


图2 不同浓度的Fe3+溶液添加NaClO后的溶液和抽滤后滤纸颜色
通过对不同质量浓度的Mn2+溶液加入NaClO后发现,随着Mn2+浓度的增加,溶液的色度逐渐加深 (见图3),如表3所示。Mn2+的质量浓度为 0.2 mg/L 时,加入NaClO后的色度为20,抽滤后的滤纸可以看到淡黄色,主要原因是加入NaClO后,Mn2+被氧化为Mn4+,碱性环境中变为MnO2。随着Mn2+浓度继续增加,色度也随之增加,当Mn2+的质量浓度达到 5 mg/L 时,溶液变为较深的黄色,色度达到40,抽滤后的滤纸可以看到深褐色。
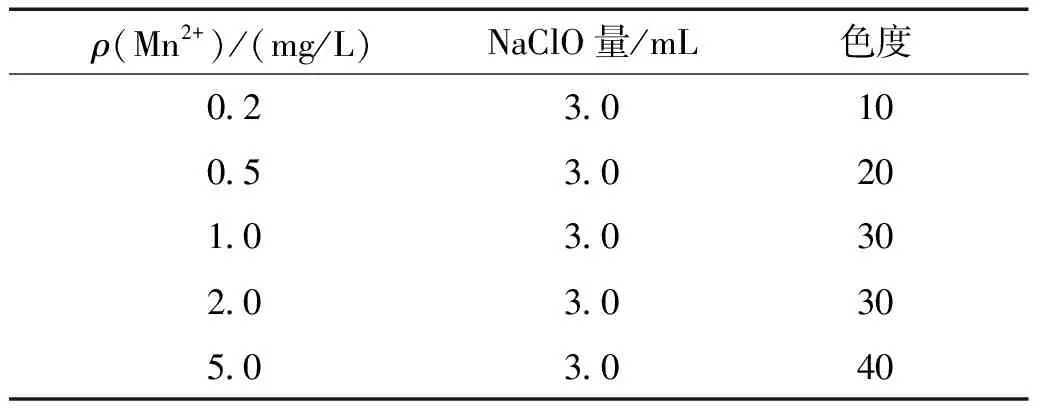
表3 向不同浓度Mn2+溶液添加NaClO后的色度


图3 不同浓度Mn2+溶液添加NaClO后的溶液和抽滤后滤纸颜色
随后,以二沉池出水为样品,对样品经过NaClO处理后色度进行了观察。图4为三份二沉池出水样品添加NaClO后的溶液和抽滤后滤纸颜色。可以发现,溶液和抽滤后的滤纸呈现淡黄色。样品中的Mn2+质量浓度在 0.48 mg/L,经过NaClO处理后色度为20(见表4)。因此,可以通过实验确定出水水质发黄的是由于Mn2+浓度较高引起的。
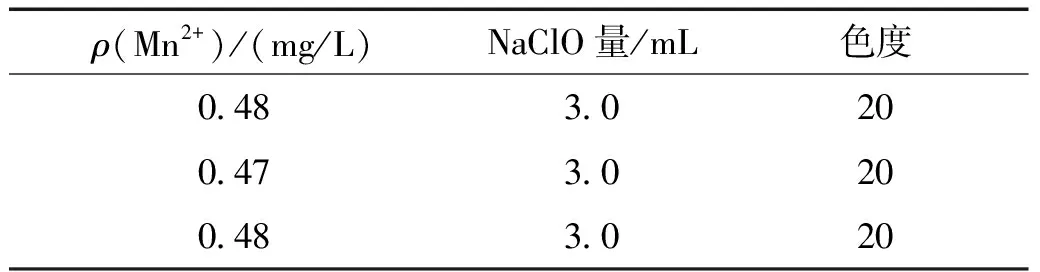
表4 二沉池出水样品添加NaClO后的色度数值
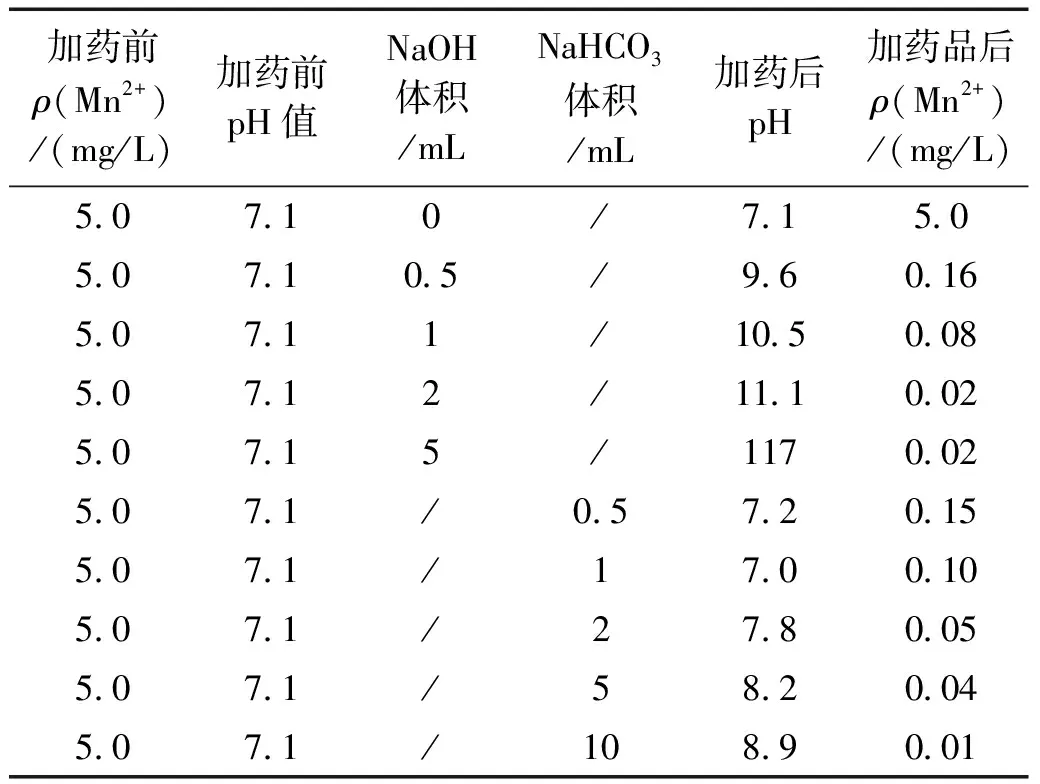
表5 以NaOH和NaHCO3作为混凝剂后Mn2+的去除和前后pH值的变化
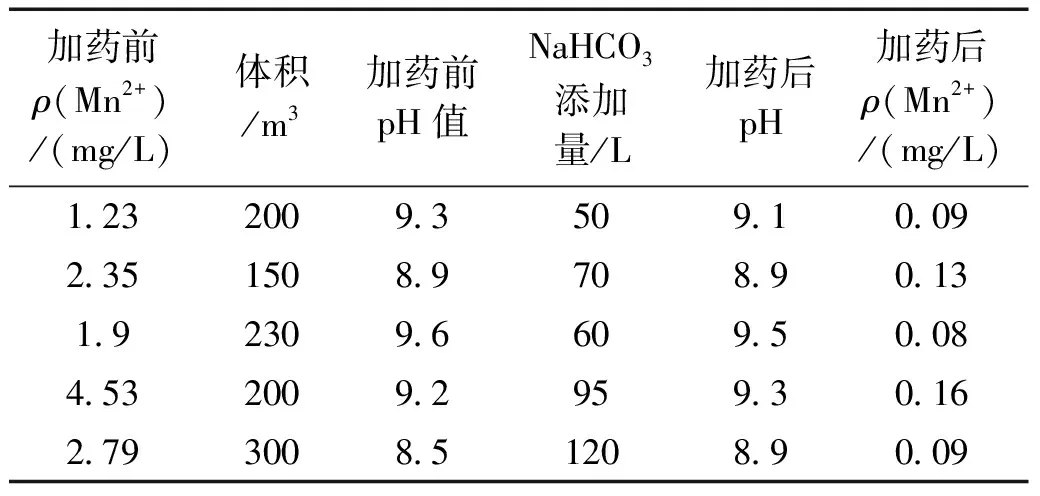
表6 在初沉池添加NaHCO3作为混凝剂后Mn2+的去除和前后pH值的变化

图4 二沉池出水样品添加NaClO后的溶液和抽滤后滤纸颜色
2.2 去除方案
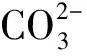
通过每天对源头水管网检测得到的各个月最高的Mn2+质量浓度(见图5)可知,6月份的Mn2+质量浓度最高 5.47 mg/L。基于此,为了探索合适的混凝剂,实验配制了质量浓度为 5.0 mg/L 的Mn2+溶液 1 L,然后分别添加质量浓度为 40 g/L (1.0 mol/L)的NaOH和质量浓度为 84 g/L(1.0 mol/L)的NaHCO3溶液,添加完毕后检测溶液体系的pH值和剩余Mn2+浓度。
由表5可知,加入NaOH和NaHCO3都可以有效地去除液相中的Mn2+;随着加入药品体积的增加,Mn2+的去除量增加。当以NaOH为混凝剂时,溶液的pH值较大,会严重影响生化池的生物活性;反之,NaHCO3投加后的去除效率低于NaOH,但是产生的碳酸酸性较弱,加入后系统的pH值影响较小,从而不会影响生化池。因此,可选用NaHCO3溶液作为Mn2+去除的混凝剂。通过实验可知,当Mn2+质量浓度为 5.0 mg/L 时,添加 0.5 mL 质量浓度为 84 g/L 的NaHCO3可将Mn2+质量浓度降为 0.15 mg/L。由表2可知,当Mn2+质量浓度低于 0.2 mg/L 时,不会造成色度冲击。
在确定NaHCO3溶液作为Mn2+去除的混凝剂和最佳配比后,在水质受到冲击时在初沉池展开了中试实验。在源头水检测到Mn2+浓度较高时,将浓度较高的源头水引入备用初沉池后添加NaHCO3溶液。表6为在2023年1月份期间Mn2+浓度受到冲击(Mn2+高于0.5 mg/L)时,向初沉池加入质量浓度为84 g/L的NaHCO3后检测Mn2+的去除和pH值变化情况。由表6可知,2023年一月份共出现5次冲击,在加入不同体积后的pH值基本上没发生变化,而Mn2+的浓度降至较低水平,不会再造成色度冲击。
3 结论
某污水处理厂现有工艺无法实现对锰离子的有效去除;浓度较高的锰离子在经过NaClO氧化处理后会被氧化为有颜色的二氧化锰,从而造成出水水质发黄,极易导致水质色度超标。通过在初沉池添加适当的碳酸氢钠作为混凝剂,可以有效降低污水中锰离子的浓度,有效降低了出水的色度。

