人干扰素α2b注射液雾化吸入过程中的药雾粒度分布及沉降量的评价
盛海,卢晨,冯霞,王兵
作者单位:1安徽安科生物工程(集团)股份有限公司,安徽 合肥 230088;2德国新帕泰克有限公司苏州代表处,江苏 苏州 215000;3安徽省生物研究所,安徽 合肥 230032
干扰素α是一类具有广谱抗病毒活性的细胞因子,在感染细胞中可发挥抑制病毒复制的作用,也可在未感染细胞中发挥防御的作用[1]。近年来,多种共识或指南[2-4]推荐雾化吸入人干扰素α2b(human interferon α2b,IFNα2b)治疗各种小儿呼吸道感染性疾病以及新冠病毒肺炎[5]。雾化吸入时,IFNα 2b 以药雾颗粒的形式吸入和沉降到呼吸道表面。一般认为,直径大于10 μm 的药雾颗粒易沉淀在鼻咽部,5~10 μm 的药雾颗粒更多沉积在口咽和气管支气管位置,0.5~5 μm 的药雾颗粒能广泛沉积在肺部[6]。由此可见,药雾粒度分布是评价IFNα2b 雾化吸入质量的重要参数,但是目前少见有关于IFNα2b雾化粒度分布方面的研究。本研究2022 年3—7 月采用了激光衍射法测定了雾化吸入IFNα2b 注射液的粒度分布,并探讨不同配制方法下药雾粒度分布的情况,现将结果汇报如下。
1 材料仪器
主要研究药物为人干扰素α2b注射液[安达芬,安徽安科生物工程(集团)股份有限公司,批号S20000013],用于测定不同雾化溶剂和不同稀释比例对雾化颗粒粒径大小分布的影响,并比较了3 家企业人干扰素α2b 注射液的雾化粒度分布情况,其他两种研究药物分别为IFNα2b注射液(北京凯因生物技术有限公司,批号S20030032)和IFNα2b 注射液(天津未名生物医药有限公司,批号S20000019)。IFNα2b 注射液的稀释液为0.9%氯化钠注射液(安徽双鹤药业,批号H34023608,批次21120304B)和灭菌注射用水(河南遂城药业,批号H4102420,批次32201162)。药雾粒度分布测定采用德国新帕泰克有限公司(Sympatec)的激光粒度分析仪(型号HELOS -Hi224),人口腔药物吸入的模拟装置采用Sympatec公司和荷兰格罗宁根大学合作开发的专用分散系统(型号INHALER2000),雾化采用德国百瑞Inhaler PRO压缩雾化器(型号BRM-075Ⅱ)。
2 研究方法
2.1 药物雾化方法采用临床上常用的两种雾化稀释液,生理盐水和注射用水,分别按照1∶1、1∶1.5、1∶2、1∶2.5 和1∶3 比例稀释IFNα2b 注射液,然后测定不同稀释液、不同稀释比例的药雾粒度分布情况,每个稀释比例均重复实验3 次。具体操作方法为:用注射器把1 mL 的300 万IU 的IFNα2b 注射液全部抽出,放入到雾化杯内,再分别抽取适当体积的生理盐水或注射用水放入雾化杯内,采用空气压缩喷射雾化器雾化。3 种不同企业生产的IFNα2b注射液的雾化粒径分布研究,均统一按照1 mL药液加入1.5 mL 生理盐水稀释后进行雾化,然后检测药雾粒度的分布情况。
2.2 粒度测量方法IFNα2b 药雾粒径的分布采用激光粒度法测量,实验操作由德国新帕泰克有限公司苏州分公司完成。为了模拟人雾化吸入药物的真实情况,先将雾化壶的“口含管”插入到人口腔专用模拟分散系统,然后再检测分散系统内的药雾粒度分布。雾化的总时间控制在10 min 左右,每份样品均选择雾化过程的12个不同时间点进行检测,在雾化后30 s 检测第一次,以后每间隔50 s 检测1 次,观察药雾粒度含量的动态变化规律。
比较两种不同稀释液、不同稀释比例的药雾颗粒体积平均直径(volume-weighted mean diameter,VMD),0~10 μm 药雾颗粒的体积累积分布(volumecumulative distribution,Q3)和10 μm药雾颗粒的体积余量分布(R3)。体积累积分布Q3(x)表示小于某一粒径大小的药雾颗粒体积的百分含量,dQ3(x1,x2)表示粒径≥x1且<x2药雾颗粒体积的百分含量,本次研究主要比较药雾颗粒的体积累积分布参数包括Q3(0.5 μm)、dQ3(0.5 μm,5 μm)和dQ3(5 μm,10 μm)。体积余量分布R3(x)为累积分布的相反分布,表示大于某一粒径大小的颗粒体积百分含量,本次研究的体积余量分布参数为R3(10 μm),即粒径≥10 μm药雾颗粒的体积百分含量。
2.3 人呼吸系统不同部位药物沉降量的估算依据该研究测定的人干扰素α2b注射液雾化颗粒的体积累积分布数据和不同直径球形颗粒在肺部沉淀的分布系数[7],估算一次性雾化吸入300 万IU 的IFNα2b 注射液后,呼吸道不同部位的药物剂量分布,包括鼻咽部、气管支气管部位和肺部。不同部位沉淀量估算,采用了1.0 mL药液∶1.5 mL生理盐水的体积累积分布数据的平均值,分布系数采用的是口呼吸方式的数据,因为本研究的粒径分布数据是模拟“口含管”的给药方式测定的。
2.4 统计学方法采用R 语言(Windows 版本4.2.1)统计学软件对所获取的数据进行统计分析处理,计量资料以±s表示,多组计量资料间比较采用单因素方差分析并进一步采用Tukey 法进行组间两两比较,两组间比较采用独立样本t检验,以P<0.05表示差异有统计学意义。
3 结果
3.1 人干扰素α2b 注射液雾化粒度分布动态变化激光衍射法测定IFNα2b 注射液(1 mL 药液∶1 mL 生理盐水)的雾化粒径分布结果(图1A)表明,12 次测定的平均特征粒径X90,3为(7.88±0.09)μm,X50,3为(2.80±0.05)μm,X10,3为(0.82±0.01)μm。特征粒径表示特定范围下颗粒粒径的大小,比如X50,3=2.80 μm 表示有50%体积的颗粒小于2.88 μm。峰宽(SPAN)为(2.52±0.02)μm,频度分布峰在2~4 μm 之间,提示2~4 μm体积平均直径的药雾颗粒出现的概率较高。此外,随着雾化时间的延长,药雾颗粒VMD 逐渐变大;雾化即将结束时,药雾颗粒的VMD值逐渐变小(见图1B,C)。
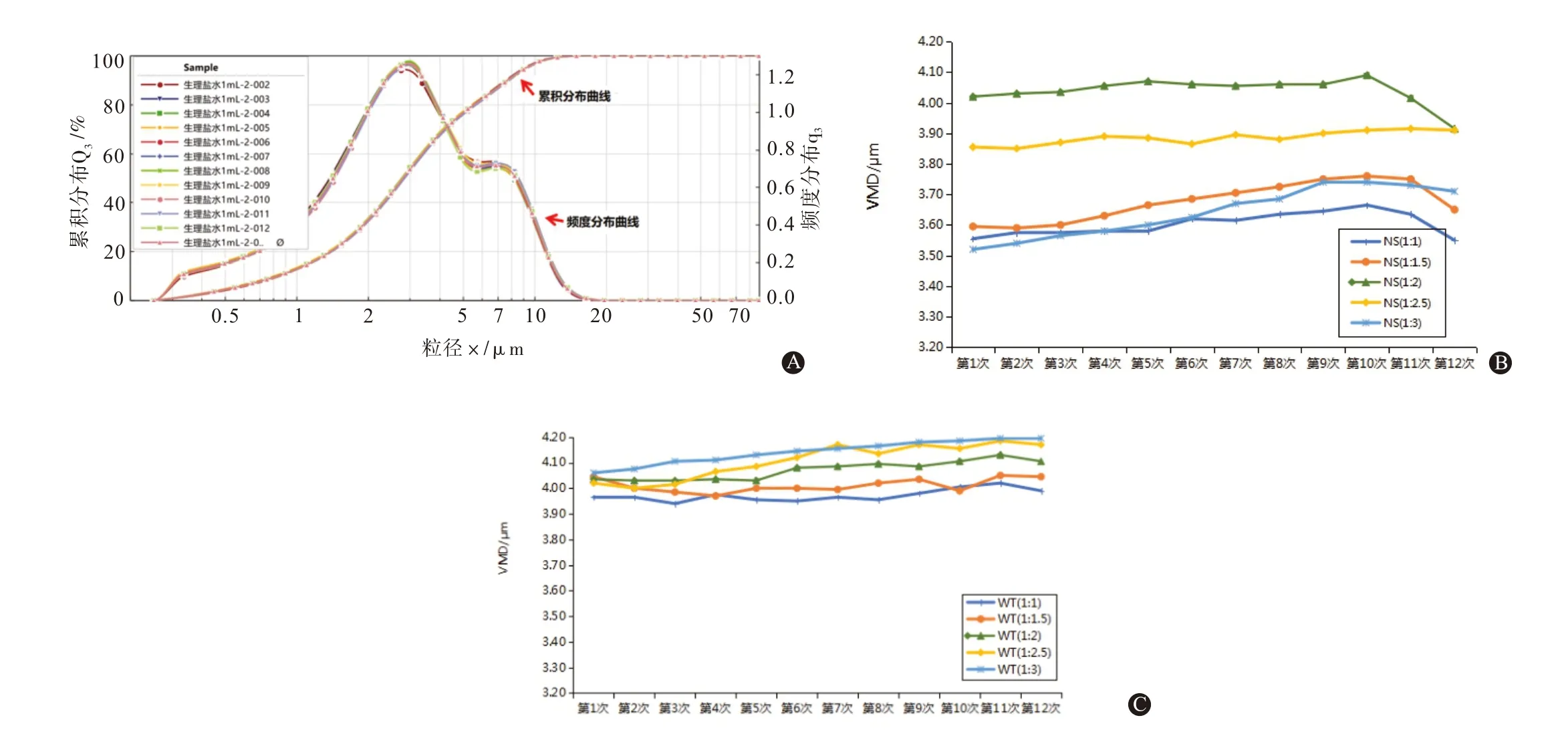
图1 IFNα2b注射液雾化颗粒体积平均直径分布的动态变化情况:A为Sympatec激光粒度分析仪测定的IFNα2b注射液药雾颗粒的体积累积分布和数量频度分布;B为用生理盐水稀释的IFNα2b注射液的药雾颗粒VMD与时间关系的折线图(NS表示生理盐水);C为用注射用水稀释的IFNα2b注射液药雾颗粒VMD与时间关系的折线图(WT表示注射用水);D为细胞凋亡(流式细胞术)
3.2 不同稀释液、稀释比例的IFNα2b 雾粒分布情况用生理盐水稀释IFNα2b注射液进行雾化,药雾颗粒的VMD平均值为(3.78±0.20)μm显著小于用注射用水稀释的药物颗粒的VMD 平均值(4.69±0.43)μm(t=-26.02,P<0.01)。在生理盐水组,NS(1∶2)稀释比例的药雾颗粒的VMD 值最大,NS(1∶1)、NS(1∶1.5)和NS(1∶3)稀释比例的药物颗粒VMD平均值相对较小,分别为(3.61±0.05)μm、(3.67±0.07)μm 和(3.59±0.08)μm,与其他组比较差异有统计学意义(P<0.05),见图2。
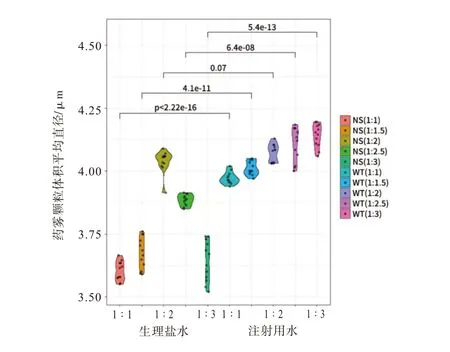
图2 不同稀释液和稀释比例的IFNα2b注射液药雾颗粒VMD值分布小提琴图
同样,用生理盐水稀释IFNα2b 注射液进行雾化,0.5~5 μm 药雾颗粒的体积累积百分含量[dQ3(0.5 μm,5 μm)]也显著高于注射用水稀释的药液,NS(1∶1)、NS(1∶1.5)和NS(1∶3)稀释比例的药物颗粒dQ3(0.5 μm,5 μm)值较大,分别为(73.82±0.77)%、(72.72±0.80)%和(71.77±1.41)%,相较于其他稀释比例的dQ3(0.5 μm,5 μm)数值显著提高,差异有统计学意义(P<0.05),见图3。以上结果提示,人干扰素α2b 注射液应用1.0~1.5 mL 生理盐水稀释,采用空气压缩雾化的药雾颗粒VMD 较小,0.5~5.0 μm 药雾颗粒的体积累积百分含量较高,药物利用度高。

图3 不同稀释液和稀释比例的IFNα2b雾粒粒径分布横向堆栈条形图
3.3 不同企业IFNα2b 雾化粒度分布情况按照1.0 mL的IFNα2b注射液加1.5 mL生理盐水稀释,测定了我国3 家企业生产的IFNα2b 注射液的雾化粒径分布情况。药雾颗粒dQ3(0.5 μm,5 μm)数值分别为(75.66±0.23)% 、(70.02±0.34)% 和(61.04±0.33)%,数据显示不同企业的雾化粒径分布存在明显差异(见图4)。药雾颗粒VMD 值分别(3.59±0.02)μm、(3.92±0.03)μm 和(4.57±0.02)μm,组间两两比较均差异有统计学意义(均P<0.05),见图5,结果提示,不同企业生产的IFNα2b注射液最佳雾化配置方法存在差异。
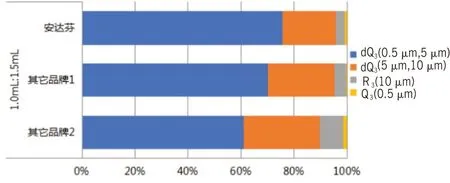
图4 不同品牌IFNα2b注射液经1∶1.5比例生理盐水稀释后雾化粒径分布横向堆栈条形图
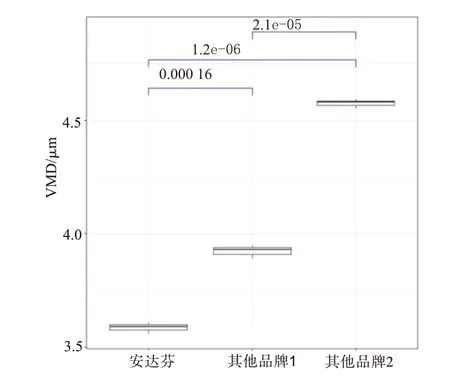
图5 不同品牌IFNα2b注射液经1∶1.5比例生理盐水稀释后雾化颗粒VMD比较的平行箱线图
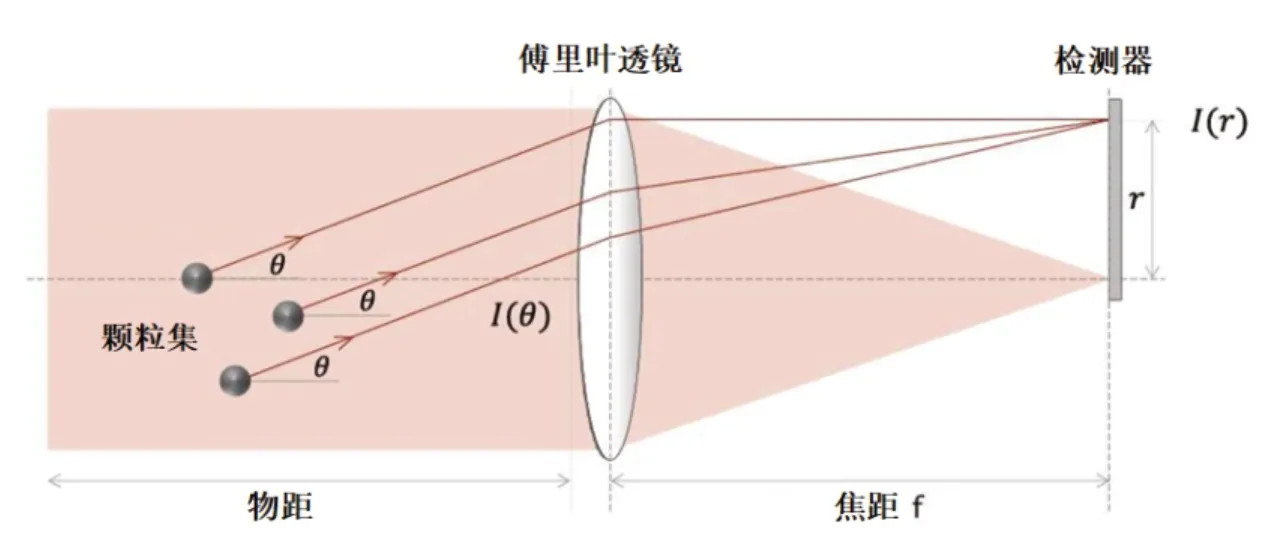
图6 激光衍射法测量测定药物粒径分布的基本原理图
3.4 估算IFNα2b药雾颗粒在呼吸系统不同部位的沉降量从估算结果来看,300万IU 的IFNα2b注射液经“口含管”雾化吸入后,约有159.09 万IU 的IFNα2b沉降分布于鼻咽部,约占雾化药物总剂量的53.0%;13.35 万IU 的IFNα2b 沉降分布于气管支气管区域,约占雾化药物总剂量的4.5%;37.49万IU的IFNα2b沉降分布于肺内部,约占雾化药物总剂量的12.5%。呼吸道各部位和肺部的药物分布具体数据见表1。

表1 300万IU的IFNα2b在呼吸道各部位的分布量的估算/万IU
4 讨论
新冠肺炎疫情让IFNα雾化吸入疗法广为人知,这得益于我国《新型冠状肺炎诊疗方案》试行第1~8版均将雾化吸入IFNα 作为抗新冠病毒的联合治疗首选方案,当然多篇研究性文献[8-11]也表明雾化吸入IFNα2b 治疗新型冠状病毒肺炎具有良好的临床疗效。雾化疗法由于会增加环境的气溶胶浓度在新冠疫情期间颇受争议[12],因为环境气溶胶会增加医疗工作者感染新冠的风险[13],但也有人认为新冠病毒感染者产生的生物气溶胶是SARS-CoV-2 的主要传播源,而治疗性气溶胶不会增加疾病传播的风险[14]。为了减少雾化吸入疗法产生的气溶胶增加感染风险,一般要求操作的医疗工作者加强防护[12-13]或增加病毒过滤器[15]。无论是增加IFNα2b雾化吸入的临床疗效,还是预防病原体传播的风险,测定IFNα2b 注射液药雾粒度分布都是有益的,这有利于临床上雾化吸入IFNα2b的实际操作。
IFNα2b 注射液雾化粒径分布测定的基本原理是依据激光衍射原理,假定药物雾粒为球形或近似球形。由于入射光照射至药物颗粒后会发生衍射效应,衍射光信号经傅里叶透镜汇聚后照射在探测器上。通常粒径小的颗粒衍射角度(θ)大,粒径大的颗粒衍射角度(θ)小,相同大小的许多颗粒,由于其衍射角是一样的,那么衍射后光强最强部分在探测器上位置也是一样的,探测器上得到的光斑是颗粒群中每一个直径相同球形颗粒衍射光强信号的叠加,如果颗粒多(Vi)则相应光斑光强度[I(r)]就高。实际测量的药雾样品是由很多不同大小颗粒的集合体组成的,根据在多元探测器上收集得到的光强分布,计算机推演得出颗粒的粒度大小和分布(PSD)[16-17]。
本研究结果表明,随着雾化时间的推移,药雾的VMD有稍许增大趋势,但总体变化幅度不大。生理盐水稀释比注射用水稀释的IFNα2b 注射液药雾颗粒VMD 更小,0.5~5.0 μm 的药雾颗粒体积累积百分含量也更高些。关于生理盐水的稀释比例,本研究结果表明,1 mL 药液用1~1.5 mL 生理盐水稀释,药雾粒径更小,0.5~5.0 μm 的药雾颗粒的体积累积百分含量更高。其结果提示雾化吸入IFNα2b 应用生理盐水稀释,稀释比例为1 mL 药液加入1.0~1.5 mL 生理盐水,这样的操作方法可让药物利用度更高。由于不同企业生产的IFNα2b 注射液辅料差异较大,其最佳雾化液配置方法可能是不同的,而本研究推荐的最佳雾化液配置方法仅适用于安徽安科生物生产的IFNα2b 注射液。因为采用1 mL 药液加入1.5 mL 生理盐水稀释时,不同企业的药雾颗粒平均直径和粒径分布的差异有统计学意义(P<0.05),安科生物IFNα2b 注射液的雾化颗粒体积平均直径为(3.59±0.02)μm,显著小于其他两个企业生产的IFNα2b 注射液。临床上需要注意不同企业生产的IFNα2b 注射液因辅料不同而导致的药物利用率和可能的疗效差异。
IFNα2b药雾颗粒在呼吸道中被载气输送,它们主要通过惯性撞击、布朗运动扩散和重力沉降偏离流线[18],从而沉降并分布在整个呼吸道和肺部。在这三种机制中,<1 μm 细微颗粒沉积由布朗运动主导,1~8 μm 较大颗粒沉积由重力沉降主导,而>5 μm 药雾颗粒受到惯性撞击更易沉降分布于口咽部和大气管中[19]。Hofemeier 等[20]研究了0.005~5.0 μm粒径范围内颗粒物在肺部的沉积呈U形曲线,即随着颗粒物粒径增加,沉积率先减小后增加,而在1 μm 左右的颗粒受布朗运动和重力影响均较弱,从而沉积率最低。我们利用了YEH 和SCHUM 提供的不同直径大小颗粒经口呼吸后在肺部沉降分布的系数,结合测定的IFNα2b注射液雾化粒径分布的数据,推算出雾化吸入干扰素α2b在肺部的分布情况,其结果显示,53.0%的IFNα2b 药雾颗粒沉降分布于鼻咽部,12.5%的IFNα2b 沉降分布于肺部,4.5%的药量沉降分布于各级气管支气管,余下的药雾飘入空气中。估算的数值是以药液完全气雾化和活性完全保留为前提的,临床实践中没有气雾化的残留药液约为12%,IFNα2b 活性也会丢失约4%[21],真实的药物递送数值可能为估算数值的84.5%左右,这些数据对临床治疗可能具有一定的参考意义。

