富血小板血浆调控SOX9对缓解SD大鼠膝骨关节炎的影响
梁朝鑫,周安远,吕沛,王哲纬,杨斯淇,赵政伟,杨渊,6
作者单位:1广西中医药大学,广西壮族自治区 南宁 530200;2广西医科大学再生医学研究中心,广西壮族自治区 南宁 530021;3广西医科大学,广西壮族自治区 南宁 530021;4广西医科大学附属肿瘤医院检验科,广西壮族自治区 南宁 530021;5广西壮族自治区总工会南宁职工康复医院康复科,广西壮族自治区 南宁 530000;6广西医科大学开元埌东医院骨科,广西壮族自治区 南宁 530028
膝骨关节炎(knee osteoarthritis,KOA)是一种常见慢性的骨关节疾病,由于慢性关节软骨组织变性损伤或功能遭受过度破坏,关节边缘骨赘组织形成,导致局部疼痛剧烈,从而可能影响其行走、上下楼梯活动等一系列日常功能活动,且其久治也难愈,若没有及时有效地采用药物治疗,将使KOA 的病情进一步发展,导致永久性关节功能畸形、残疾等严重后果,影响病人正常的生活质量[1-2]。KOA 综合征常发生于一些老年病人,病情严重者甚至可突然出现肢体行动迟缓及下肢运动功能障,给许多家庭乃至对整个社会经济都给带来的了巨大的经济负担,所以采取有效的治疗尤为重要[3-5]。在骨科,治疗膝骨性关节炎的最常用非手术方法有在关节腔中注射透明质酸钠、口服多种非甾体抗炎药以及采用局部理疗手法和全身药疗等,这些方法虽然能缓解部分疼痛,但并不能起到抗炎和减轻软骨退化的作用。富血小板血浆(platelet-rich plasma,PRP)是一种通过快速离心抽取全血标本而采集得到的富含高浓度血小板血浆,PRP 样本中含有的游离血小板浓度至少是正常健康人全血样品中含血小板浓度的近3~5 倍[6]。PRP 含有多种不同的生长因子,可促进关节软骨的修复,有可能成为治疗KOA的有效方法[7]。研究[8]发现,Y 染色体上的性别决定基因区域(SOX9)具有能够直接影响基因在软骨细胞增生及骨骼组织中的再分化或成熟表达的决定性作用。且SOX9 基因能成为结合软骨细胞肥大的重要标志物X型染色体胶原(ColX)基因表达的关键启动子,同时可以激活影响其成熟表达基因[9]。随着治疗技术日趋成熟,近年来对PRP 及其应用机制在临床治疗和KOA 上的实验研究工作越来越多,然而,PRP 在治疗KOA 病程发展中的药物作用机制相关的基础研究则报道甚少。因此,本研究2021 年4月至2022 年3 月从体外通过采用脂多糖(LPS)抑制剂诱导大鼠软骨细胞的损伤,体内通过体外离断损伤大鼠膝前交叉韧带建立了KOA 动物模型,研究PRP 通过体外调控因子SOX9 的表达及对大鼠体外的抗炎机制和大鼠体内的对KOA 病情的缓解及其作用机制,为临床对于KOA 的诊断和治疗提供一条新思路。
1 材料与方法
1.1 材料SPF级SD大鼠(2~5日龄)6只,8周龄雄性SD 大鼠30 只,由广西医科大学动物实验中心提供( 伦理编号202105004)。 SOX9 激动剂(M09282290)购于广西卓一科技有限公司;DMEM培养基(SH30022.01B)购自美国Hyclone 公司;胎牛血清(21030704)购于浙江天杭生物科技股份有限公司;Ⅱ型胶原酶(C8150)购于北京索莱宝科技有限公司;0.25%胰蛋白酶购于北京索莱宝科技有限公司(20210717);LPS(L2630)购于美国Sigma 公司;PBS(SV30087.02)购于美国Hyclone 公司;DEPC 处理水(C3088)购于德国RUIBIO 公司;氯仿(H44020154)购于中国上海国药;异丙醇(80109218)购于中国上海沪试公司;无水乙醇(CNNO.32061)购于中国常热市鸿盛精细化工有限公司;SYBRGreen PCR 试剂盒(Thermo F-415XL)购于美国赛默飞;逆转录试剂盒(Thermo K1622)购于美国赛默飞。
1.2 方法
1.2.1SD 大鼠软骨细胞提取和培养 2~5 日龄SD大鼠均在全身麻醉下处死,经严格的无菌条件下取出膝关节软骨,剔除肌肉、韧带等软组织,从膝关节韧带下方剪取膝关节软骨,并将全部软骨剪为约1 mm3的碎块。使用0.25%胰蛋白酶-EDTA 抑制剂在37 ℃培养基中消化30 min,随后使用2 gLⅡ型胰胶原酶抑制剂消化4 h,1 000 r/min 离心收集底层软骨细胞,加入10%活胎牛血清蛋白液和1%青链霉素混合液后制成的DMEM 培养基内进行培养,观察软骨细胞的分布,隔天更换培养基,待软骨细胞增殖到90%以上时,按1∶3 比例进行细胞传代,第3 代软骨细胞还可用于作后续培养实验。
1.2.2实验分组与药物干预 实验分为正常组、模型组(10 mg/LLPS)、低、中、高浓度PRP 实验组(10mg/L LPS+5%PRP、10 mg/L LPS+10%PRP 和10 mg/L LPS+20%PRP)和SOX9 实验组(10 mg/L LPS+SOX9 激动剂)。将第3 代软骨细胞分别接种到6 个孔板内及放有爬片板的第24孔板孔中,待软骨细胞表面完全贴壁以后,模型组和实验组先以10 mg/L LPS 处理1 h 后分别加入5%PRP、10%PRP、20%PRP及含少量SOX9 激动剂的DMEM 培养基中,每组接种3个复孔,药物处理后24 h后收样。
1.2.3酶联免疫吸附测定(ELISA)检测相关炎症因子的水平 各组细胞培养24 h 后,通过离心取上清液进行ELISA 检测。按检测试剂盒说明书,检测各组细胞的白细胞介素(IL)-1β、IL-6、肿瘤坏死因子α(TNF-α)、诱导型一氧化氮合酶(iNOS)等炎症因子水平。
1.2.4实时荧光定量聚合酶链式反应(qPCR)分析软骨蛋白相关基因的表达水平 采用qPCR 分析软骨蛋白聚糖抗体(ACAN)、Ⅱ型多肽胶原酶(COL2A1)、基质金属蛋白酶(MMP)-3、MMP-13、低聚蛋白多糖酶(ADAMTS)-4、ADAMTS-5、IL-1β、IL-6、环氧化酶-2抑制剂(COX-2)等的表达水平。采用各组总的RNA 作为样品装入提取试剂盒,提取纯化出上述各组样品中总的RNA,然后分别使用逆转录试剂盒将这些RNA 样品全部经过逆转录处理保存记录为cDNA。qPCR 反应主要过程为95 ℃变性加热10 s,60 ℃变性加热退火60 s,共分作40个反应循环。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参。按照2-ΔΔCt方法计算各个目的基因相对表达量。重复3次。
1.2.5动物试验和病理切片染色 成年的健康大鼠按随机数字表法分为实验组、对照组、假手术组,每组各10只,实验组和对照组通过离断膝关节前交叉韧带来建立大鼠急性骨关节炎动物模型,假手术组动物通过切开大鼠关节腔后直接缝合建立。造模1 个月后,实验组隔日予膝关节关节腔内注射PRP 溶液(PRP∶氯化钙=1∶9)0.5 mL,对照组和假手术组隔日分别关节腔内注射等量0.9%氯化钠溶液,连续1 个月,各组将大鼠关节软骨组织脱蜡酶激活后分别用常规石蜡包埋切片,苏木精-伊红(HE)染色、番红固绿染色和甲苯胺蓝染色后用光学显微镜下连续拍照取图。
1.3 统计学方法采用SPSS 24.0 统计分析软件对数据进行统计分析。计量资料采用±s表示,多组计量资料比较采用单因素方差分析,组间的两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组炎症因子水平比较采用ELISA 法定量检测各组大鼠血清IL-1β、TNF-α、IL-6及iNOS水平。与正常组比较,模型组软骨细胞在经过LPS 处理以后,IL-1β、TNF-α、IL-6 和iNOS 水平明显增高,而分别予以不同药物浓度的PRP 处理和SOX9 处理以后,其血清炎症因子水平则不同程度降低(P<0.05或P<0.01),且SOX9 实验组降低效果最为显著(均P<0.01)。见表1。
表1 各组大鼠血清IL-1β、TNF-α、IL-6和iNOS的水平比较/± s
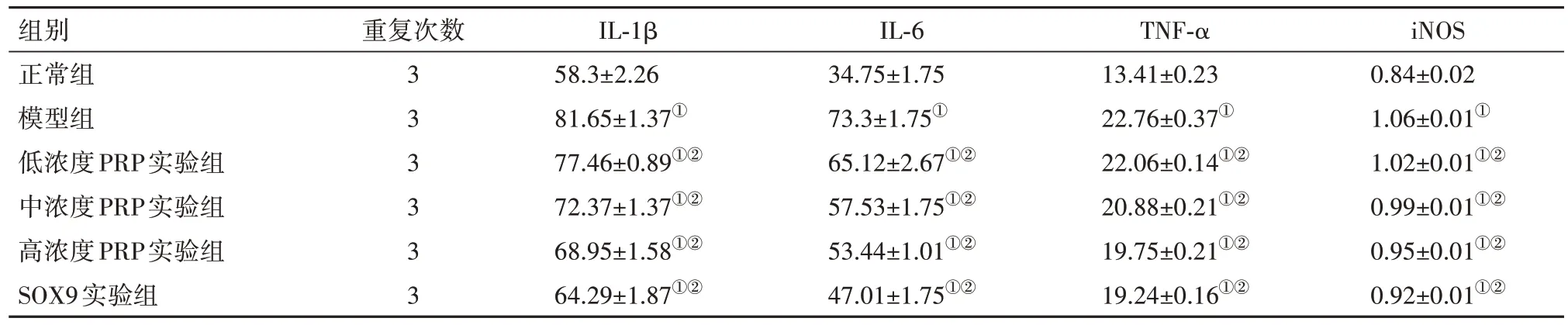
表1 各组大鼠血清IL-1β、TNF-α、IL-6和iNOS的水平比较/± s
注:IL为白细胞介素,TNF-α为肿瘤坏死因子α,iNOS为诱导型一氧化氮合酶。①与正常组比较,P<0.05;②与模型组比较,P<0.05。
组别正常组模型组低浓度PRP实验组中浓度PRP实验组高浓度PRP实验组SOX9实验组iNOS 0.84±0.02 1.06±0.01①1.02±0.01①②0.99±0.01①②0.95±0.01①②0.92±0.01①②重复次数3 3 3 3 3 3 IL-1β 58.3±2.26 81.65±1.37①77.46±0.89①②72.37±1.37①②68.95±1.58①②64.29±1.87①②IL-6 34.75±1.75 73.3±1.75①65.12±2.67①②57.53±1.75①②53.44±1.01①②47.01±1.75①②TNF-α 13.41±0.23 22.76±0.37①22.06±0.14①②20.88±0.21①②19.75±0.21①②19.24±0.16①②
2.2 各组软骨蛋白相关基因的表达水平比较采用RT-PCR 分析ACAN、COL2A1 等软骨特异性基因表达和MMP-3、MMP-13、ADAMTS-4、ADAMTS-5、IL-1β、IL-6、COX-2 等软骨炎症相关的蛋白基因表达水平。与正常组比较,模型组使用LPS 后软骨细胞软骨特异性基因的表达水平被明显下调,软骨炎症相关基因的表达水平被明显上调,三种不同浓度PRP 和SOX9 激动剂处理后,明显逆转了软骨特异性基因表达水平的下调和软骨炎症相关基因表达的上调,其中以SOX9实验组的作用最为显著(均P<0.01)。见表2。
表2 各组大鼠软骨特异性基因及软骨炎症相关基因的表达水平比较/± s

表2 各组大鼠软骨特异性基因及软骨炎症相关基因的表达水平比较/± s
注:ACAN 为软骨蛋白聚糖抗体,COL2A1 为Ⅱ型多肽胶原酶,MMP 为基质金属蛋白酶,ADAMTS 为低聚蛋白多糖酶,IL 为白细胞介素,COX-2为环氧化酶-2抑制剂。①与正常组比较,P<0.05。②与模型组比较,P<0.05。
MMP-13 1.00±0.01 1.47±0.01①1.43±0.01①②1.40±0.01①②1.33±0.01①②1.19±0.02①②ADAMTS-4 1.00±0.03 1.58±0.01①1.50±0.01①②1.45±0.02①②1.41±0.01①②1.31±0.01①②组别正常组模型组低浓度PRP实验组中浓度PRP实验组高浓度PRP实验组SOX9实验组组别正常组模型组低浓度PRP实验组中浓度PRP实验组高浓度PRP实验组SOX9实验组重复次数3 3 3 3 3 3 ADAMTS-5 1.00±0.03 1.24±0.01①1.22±0.01①1.17±0.01①②1.15±0.01①②1.08±0.01①②ACAN 1.00±0.07 0.64±0.01①0.74±0.02①②0.79±0.01①②0.81±0.01①②0.90±0.02①②IL-6 1.00±0.06 1.41±0.01①1.39±0.01①②1.36±0.01①②1.32±0.01①②1.20±0.01①②COL2A1 1.00±0.01 0.64±0.01①0.65±0.01①②0.69±0.01①②0.70±0.01①②0.84±0.02①②COX-2 1.00±0.03 1.49±0.01①1.45±0.01①1.27±0.01①1.22±0.01②1.15±0.017②MMP-3 1.00±0.01 1.39±0.01①1.33±0.01①②1.32±0.01①②1.29±0.01①②1.16±0.02①②IL-1β 1.00±0.01 1.44±0.01①1.33±0.01①②1.28±0.01①②1.25±0.01①②1.15±0.02①②
2.3 各组大鼠膝关节大体观通过对比实验组、对照组和假手术组的膝关节大体观发现,实验组与假手术组膝关节表面光滑,差异并不明显,对照组膝关节大体观肿胀且表面粗糙。见图1。
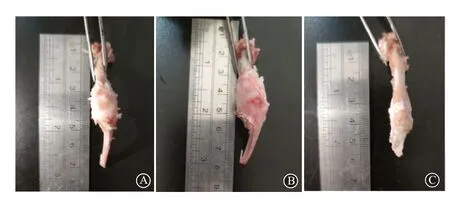
图1 各组大鼠膝关节大体观:A为实验组;B为对照组;C为假手术组
2.4 各组大鼠膝关节软骨组织HE、番红O 及甲苯胺蓝染色假手术组大鼠膝关节的软骨表层保持光滑与完整,软骨细胞结构未遭受损伤破坏,细胞结构排列整齐,细胞内外两层基质均完整存在;对照组大鼠膝关节的软骨层较为粗糙,细胞结构遭受严重破坏,细胞结构排列出现紊乱、散落及不整齐,部分细胞的基质也发生变性降解,并见局部有明显炎症细胞浸润和组织坏死变性;实验组大鼠膝关节的膝关节软骨层均较正常连续而完整且光滑,软骨细胞数量比较多且细胞排列相对较规范整齐,细胞外基质亦较对照组连续和完整,仅有较少量软骨炎症细胞浸润。见图2。
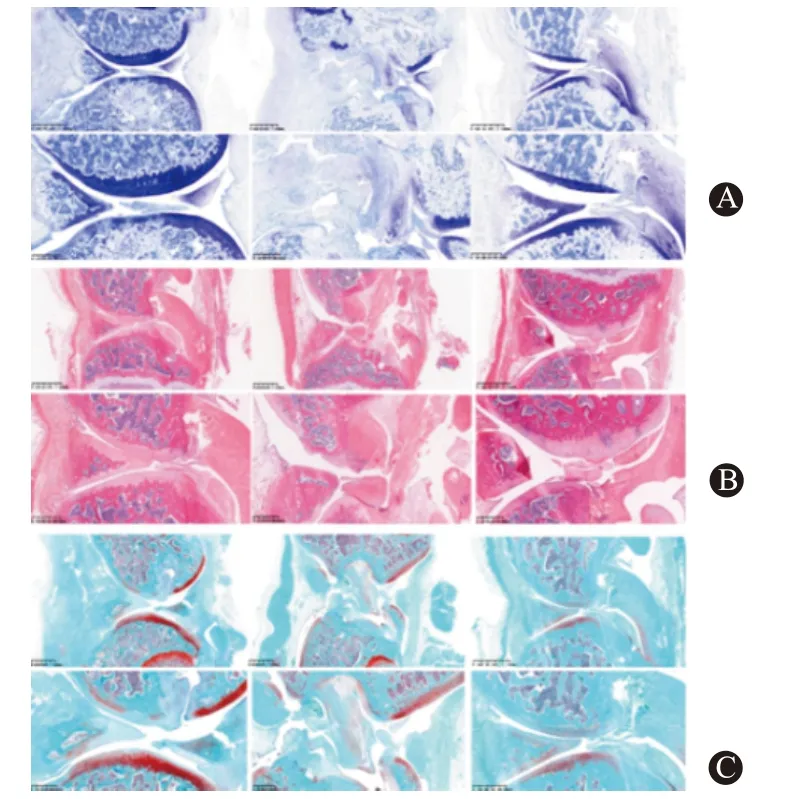
图2 各组大鼠膝关节软骨组织细胞图(×400):A为HE染色;B为番红O染色;C为甲苯胺蓝染色
2.5 各组大鼠膝关节软骨组织免疫组化染色结果本研究中,MMP-13 和ADAMTS-4 两种抗体均在免疫组化染色中有阳性表现。
3 讨论
KOA 是骨科目前较常见到的一种膝关节退化性骨骼肌肉疾病,影响整个关节表面的骨关节所有重要组织,包括膝关节软骨、骨、韧带肌腱和肌肉等,KOA 导致的主要临床病理组织改变有关节软骨细胞的增生变性、损坏及骨质增生形成和骨周围皮肤软组织损伤的继发性炎症刺激反应等。目前KOA 的治疗方法都有其局限性,近年来随着PRP 的不断深入研究与应用,采用在膝关节腔内注射PRP治疗KOA 取得了进一步的发展。PRP 作为含有多种生长因子的血小板浓缩物,可有效促进膝关节软骨细胞的再生[10]。其中,在关节腔内注射PRP 治疗KOA,可使免疫促炎因子IL-1β 和TNF-α 均降低,进而改善了KOA的症状[11-12]。本研究探讨了PRP能通过选择性调控SOX9 受体的表达及其对LPS 诱导下的大鼠关节软骨损伤后的功能保护效果及PRP 产生了对大鼠骨关节功能的潜在保护修复作用,结果表明PRP 可通过选择性调控SOX9 基因的表达来有效缓解并阻断了小鼠KOA病情的进展。
KOA 病程中,在膝关节的退行性改变和生物力学失衡的影响下,刺激了软骨细胞产生炎症反应,并通过巨噬细胞对关节退变、损伤等病理环境下发生反应,产生了大量的炎症因子[13-14]。有研究[15]发现,软骨调控相关基因表达异常可能与退行性改变相关。由于PRP 中含有着较高水平的血小板浓度,同时活化血小板还可直接激活其他多种血小板生长因子,为KOA 病变组织的修复创造了更有利的环境[16-17]。同时,研究[18]发现PRP 可减少软骨中MMP-13阳性细胞的表达,通过抑制MMP-13的表达从而进一步发挥了对软骨的保护作用。并且ADAMTS-4也是关节退行性构改变发生的一种重要生物学标志蛋白之一,其本身作为对关节软骨外膜基质蛋白的水解酶,关节软骨蛋白质的诱导降解酶有其重要独特的作用[19],并在关节炎中聚蛋白多糖降解具有巨大效力[20]。相关研究[21]结果显示,通过抑制ADAMTS-4的和调节ADAMTS-5的结合水平可同时有效的降低对聚蛋白多糖的降解,从而明显减少低聚蛋白多糖的丢失率和软骨细胞破坏。SOX9蛋白属于SOX 蛋白家族,对软骨细胞表型调控及软骨稳态细胞的有效诱导保护功能具有特殊重要生理作用,在诱导软骨细胞的分化增殖与分化凋亡中均有很重要独特的重要作用,是将合成的软骨细胞生长刺激因子诱导成为软骨组织分化生长过程调控中关键的重要因素[22]。有研究[23]发现,SOX9 可调节软骨外基质的表达。Zhang 等[24]研究发现,SOX9 还可抑制ADAMTS-4、ADAMTS-5、ADAMTS-7、ADA 及MTS-12 个基因表达的mRNA 蛋白生成,进而有效影响了聚蛋白多半糖酶基因表达的逆转录,证实出了SOX9 确实是一种聚蛋白多糖酶表达的特异性抑制活性物,从而可能对关节软骨和细胞外基质产生的有效保护。SOX9 可以直接通过抑制软骨细胞中的软骨肥大酶和促进部分未被分化过的软骨细胞进行细胞再生分化过程[25-26],且间接参与促进了对软骨细胞中的COL2A1软骨细胞特异性酶激活诱导作用,控制促进了COL2A1 在软骨细胞分子中的特异性表达[27]。而MMP-13 则可致使COL2A1降解[28]。由此推断SOX9 可能通过抑制ADAMTS-4和MMP-13 基因的表达,从而达到减少聚蛋白多糖丢失和抑制软骨细胞肥大及COL2A1 降解,进而可有效缓解KOA病程的发展。
本研究中的体外实验部分在中体外使用了LPS(10 mg/L)对软骨细胞产生出了关节炎症的诱导病理反应,建立出了由软骨细胞的炎症模型,体内部分研究通过离断SD 大鼠膝关节前交叉韧带而建立出的膝骨关节炎模型。体外试验研究数据中,不同的血清浓度水平上的PRP 和SOX9 激动剂联合作用位点均可同时通过两种作用机制分别增强了胶原软骨特异性基因ACAN 和对COL2A1 mRNA 水平的高选择性诱导表达,且在SOX9 激动剂的作用下表达最明显,同时它们亦可分别通过降低对MMP-3、MMP-13 和对ADAMTS-4、ADAMTS-5 基因的mRNA表达的水平,从而缓解Ⅱ型胶原的降解和阻止了聚蛋白多糖的丢失,这二者似乎都可能更大程度有利于软骨细胞的外基质结构的重新形成。在软骨炎症因子方面,各浓度下的PRP 表达和在SOX9 激动剂作用下均不同程度降低了在LPS诱导条件下的软骨组织损伤模型细胞表面中的包括IL-1β、IL-6、TNF-α、COX-2 等在内的高特异性mRNA 水平的表达,同时在软骨细胞表面上的包括IL-1β、IL-6、TNF-α、iNOS 等其他抗炎症因子水平含量也明显降低,并且在SOX9 激动剂作用下的效果最明显。大鼠病理切片显示,PRP 能明显改善KOA 的关节病变,从而减缓大鼠延缓型关节炎病程和发展趋势,表明PRP 对关节软骨损伤的恢复具有积极的作用。
综上所述,PRP对关节软骨损伤有保护作用,其作用机制可能是通过调控SOX9 的表达,进而降低炎症因子的表达且缓解Ⅱ型胶原降解和减少聚蛋白多糖的流失,缓解了软骨细胞外基质的降解,从而有效缓解了KOA 的进一步发展。目前膝关节腔内注射PRP 越来越多地成为在临床上治疗KOA 的有效方案。然而,对于PRP 的长期疗效和具体作用机制还需进一步研究。

